缺血性心肌病的连续心率减速力与心率变异性研究*
2018-03-30朱王亮刘美莲
朱王亮,宋 剑,刘 晶,刘美莲
(包头医学院第一附属医院老年医学科,内蒙古包头 014010)
缺血性心肌病(ICM)是指由于冠状动脉粥样硬化而引起冠状动脉管腔发生狭窄甚至是闭塞,因而冠脉血流量减少,从而心肌缺血缺氧,长期发展就会引起整个心脏的舒缩功能不全,或伴有局部运动障碍的一种疾病[1]。连续心率减速力(heart rate deceleration runs,DRs),是在心率减速力的基础上进一步研究推出的一项新技术,它可以更好地预警猝死以及对疾病进行危险分层,从而评价心血管疾病患者的预后[2]。同时,郭继鸿等[3]也对DRs进行了深入研究。这可以评价心脏自主神经功能强弱,进而预警由于自主神经失调发生的心脏不良事件。本文将对DRs与ICM的发病关联做研究,为ICM的发病与治疗提供一定的理论基础。本研究通过对以上介绍的几种可以判断心血管疾病预后的指标及其与ICM的关系,探讨其对ICM的高危患者的警示作用以及危险分层,为不良预后ICM患者提供良好的临床依据,致力于可以早期发现、早期治疗,为更好的诊断、治疗提供参考,从而达到理想的治疗效果。
1 资料与方法
1.1一般资料 选择2013年1月至2015年1月于本院住院治疗并诊断明确的60例ICM患者,作为ICM组,平均(61.52±10.05)岁,其中男45例,女15例。选同期行健康体检者60名,作为对照组。平均(64.35±13.17)岁,其中男42例,女18例。两组的一般情况对比差异无统计学意义(P>0.05),具有可比性,见表1。
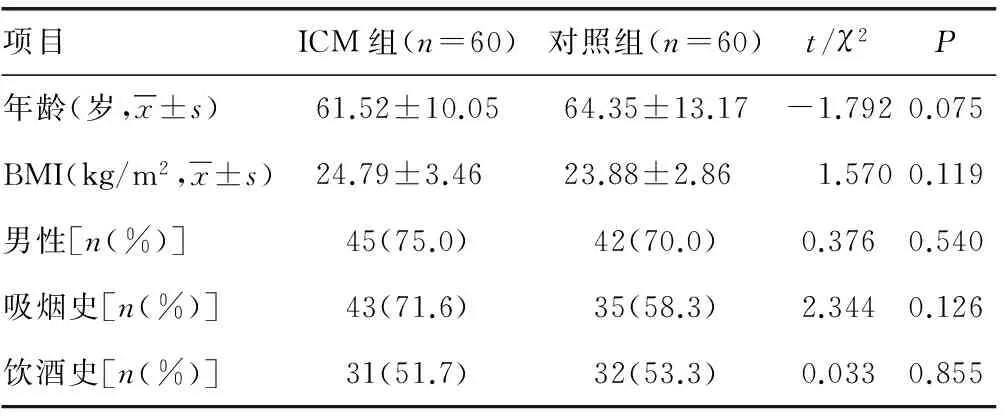
表1 两组对象一般情况比较
1.2方法
1.2.1ICM诊断标准[1](1)有冠心病史,至少有1次或以上心肌梗死(有Q波或无Q波心肌梗死),或经冠脉造影证实有单支以上血管病变;(2)劳力性呼吸困难;(3)左心室扩大(左室舒张末径,男性大于55 mm,女性大于50 mm);(4)左室射血分数小于45%;(5)脑钠肽水平高于正常水平。符合以上条件者入ICM组。
1.2.2ICM的排除标准 (1)合并室间隔穿孔、室壁瘤和乳头肌功能不全;(2)合并其他心肌病;(3)其他心脏病或其他原因引起的心脏扩大和心力衰竭;(4)非窦性心律者;(5)二度房室阻滞,或三度房室阻滞,或病态窦房结综合征者。所有受试者均签署受试同意书。
1.2.3个人史及既往史 (1)每日吸烟至少1支,连续吸烟1年以上者,视为吸烟史阳性;(2)平均每日饮酒大于100 mL,视为饮酒史阳性;(3)根据体质量指数(BMI,kg/m2)=体质量(kg)/身高2(m2)得出结果,男性大于27 kg/m2、女性大于25 kg/m2视为肥胖阳性;(4)高血压病史:距本次确诊为ICM发病前1个月已被诊断为高血压或者如果患者从未测过自身血压,此次发病被诊断为高血压,视为高血压阳性;(5)糖尿病病史:距本次确诊为ICM发病前1个月已被诊断为糖尿病或者如果患者从未测过自身血糖,此次发病被诊断为糖尿病,视为糖尿病阳性;(6)高胆固醇血症:距本次确诊为ICM发病前1个月已被诊断为高胆固醇血症或者如果患者从未测过自身血脂,此次发病被诊断为高胆固醇血症,视为高胆固醇血症阳性。
1.2.4DRs的测定 所有受检者于就诊次日清晨8:00-8:30于本院行24 h动态心电图检查。本院24 h动态心电图系统,去除伪差及干扰后,可自动计算DRs值。
1.2.5DRs的计算方法[3](1)测量逐跳的RR 值:在记录的24 h动态心电图心电图中,找出逐渐延长的RR间期,测量其具体数值,并标出;(2)计算并确定心率减速力持续的周期值:以每个心动间期(ms)为纵坐标,以心动周期(RR间期)的先后顺序的序号为横坐标,制成心率减速力周期值不同的顺序图,进而能计算出连续周期不同的DRs的各自数值;(3)计算连续周期不同的心率减速力的绝对数值及相对值:先计算持续周期不同DRs值的心率减速力各绝对值,再除以整个记录时间段内窦性心律RR 间期的总数值,则可得到持续不同的周期的相对值。
1.2.6心率变异性的计算方法 所有受检者于就诊次日清晨8:00-8:30于本院行24 h动态心电图检查。本院动态心电图系统,有自动检测心率变异性的功能。计算方法包括时阈分析法和频域分析法。
1.2.6.1时阈分析法 逐个识别一定时间记录的QRS波,去除非窦性心律和伪差,将一系列RR间期进行统计学离散趋势分析便得到时域分析指标。正常范围表示自主神经功能健全,下降表示自主神经功能受损。时域分析指标有以下几种:RR间期总体标准差(SDNN)、RR间期平均值的标准差(SDANN)、相邻RR间期差值的均方根(RMSSD)。
1.2.6.2频域分析法 频域分析法即功谱分析法,将一定心搏间期内的心电图的变化转变为频谱,以这个期间的RR间期为横坐标,以功率谱能量为纵坐标,根据功率谱能量随RR间期频率变化的关系,计算功率谱密度。总功率谱反映总的自主神经张力;在功率谱的0.04、0.10、0.15 Hz中出现3个谱峰。第1频段为低频峰段,第2频段为中频峰段,第3频段为高频峰段。第1频段主要受RASS系统影响,主要反映交感神经系统的调节作用。第2频段主要受血压、压力感受器影响。第3频段主要受呼吸的影响。本研究主要应用低频与高频两项指标。低频段主要反映交感神经张力,高频段主要反映副交感神经张力,低频与高频之比反映交感/副交感神经之间张力的平衡。此研究主要探讨反映心率变异性频域的指标包括低频成分(LF)及高频成分(HF)。
1.2.7实验试剂、仪器 24 h动态心电图记录仪由北京谷山丰生物医学技术有限公司提供。
2 结 果
2.1两组对象DRs值的比较 ICM组的DR4、DR8低于对照组,差异有统计学意义(P<0.05),见表2。
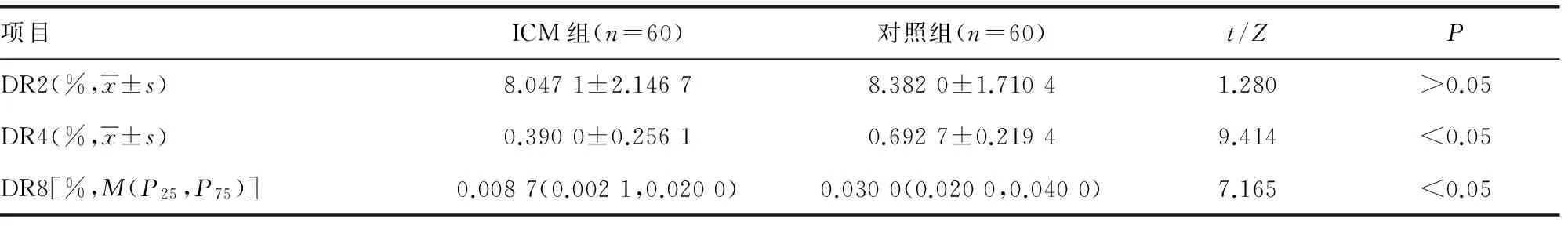
表2 两组对象DRs值的比较
2.2两组对象心率变异性比较 ICM组患者的SDNN、 SDANN水平低于对照组;ICM组患者的RMSSD水平低于对照组;ICM组患者的LF水平高于对照组;ICM组患者的HF水平低于对照组;两组之间比较差异均有统计学意义(P<0.05),见表3。
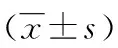
表3 两组对象HRV比较
2.3DRs值与心率变异性指标SDNN、SDANN的相关性分析 DRs的各值(DR2、DR4、DR8)与心率变异性(SDNN、SDANN、RMSSD、LF、HF)分别进行相关性分析后,DR2、DR4、DR8分别与SDNN、SDANN、RMSSD、LF、HF有正相关性,指标之间相关性均有统计学意义(P<0.05),见表4。
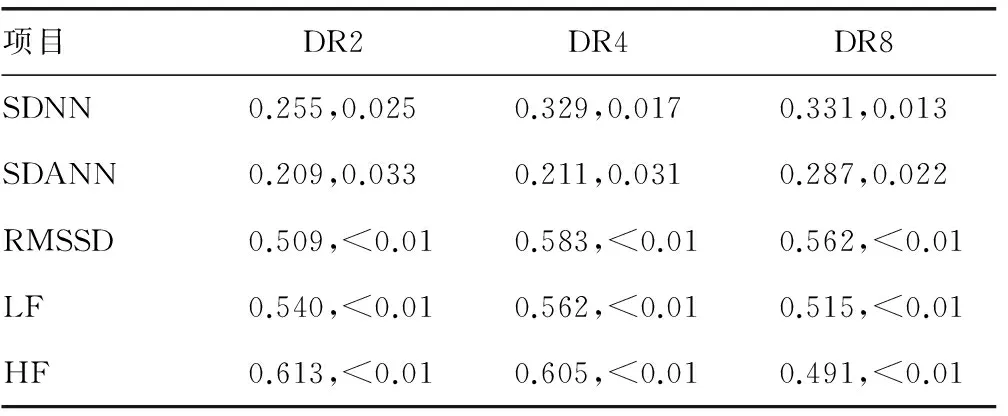
表4 DRs值与心率变异性指标SDNN、SDANN的相关性分析(r,P)
3 讨 论
ICM是冠心病的终末表现,由于冠状动脉粥样硬化,冠状动脉的血流量减少,导致心肌长期缺血缺氧,心脏的收缩和舒张功能减低,心脏运动受到限制。ICM的临床表现复杂,继而治疗上难度较大,预后也常常不能尽如人意。故对疾病的早期发现、早期治疗显得十分重要。
在过去的研究中,ICM的发病机制中提到自主神经功能紊乱尤其是交感神经的调控失衡影响心脏的收缩:心肌缺血使交感神经系统活跃,心率加快,交感神经系统的活跃也可以导致细胞内转运钙离子的肌浆网钙ATP酶活性下降,心肌耗氧量增加,心肌的负担越来越重,转运钙离子的肌浆网钙ATP酶减少,心肌收缩力下降。而本研究着重探讨其发生机制的反面迷走神经对机体的作用减弱或失调导致的结果。迷走神经神经末梢释放乙酰胆碱,与胆碱能受体结合,对相应的器官产生相应的作用,在心脏主要表现为负性肌力、负性传导、负性频率的作用。LAITIO等[4]研究认为,心血管病患者发生心脏事件的本质是交感神经与迷走神经失衡中迷走神经被过度抑制,导致迷走神经对心脏的保护性作用减弱,类似“交感风暴”的恶性事件的原因就在此。DRs是心脏的一种减速能力,属于迷走神经作用的范畴,它可以定量反映心脏迷走神经作用是否正常。 左萍等[5]研究显示,国人急性心肌梗死患者DRs值中DR4及DR8较健康人显著降低。后续的研究也较多集中于心肌梗死猝死风险的预测面,并沿用这一界值[6-8]。 DRs与急性心肌梗死患者的研究表明了其对急性心肌梗死的预测有价值[9]。常超等[10]选取58例不稳定心绞痛患者以及同期住院的58例非不稳定心绞痛患者进行研究,研究显示不稳定心绞痛组DRs值较对照组明显减低,且危险分层最终猝死率吻合。原因均与冠心病患者迷走神经作用减弱有关。本研究中,ICM组DRs各指标较对照组明显减低,可能与ICM患者迷走神经对心脏保护作用减弱有关。这与国内的研究是一致的。
心率变异性是连续窦性心跳的RR间期之间的微小差异。目前心率变异性常常被应用于临床来检测疾病的自主神经功能。它是调节心血管乃至整个机体稳态的重要因素。自主神经的功能主要表现在调节心肌、平滑肌和腺体的活动。除了少数的器官,一般器官都接受交感神经和迷走神经共同调节作用。一般情况这两个神经系统具有拮抗作用,也就是说当交感神经活跃时,迷走神经处于受抑制状态,反之,如果迷走神经起主导作用,交感神经也处于被抑制状态。自1978年 WOLF等报道了急性心肌梗死后严重心律失常事件和猝死与心率变异性的降低密切相关,使心率变异性在临床中受到高度重视,相关研究主要有心率变异性在心力衰竭、高血压、心肌病以及糖尿病中的作用[11-12]。在高血压、心力衰竭、心肌病、糖尿病中都会出现不同程度的心率变异性减低。本研究中,ICM组较对照组心率变异性明显减低,可能与ICM自主神经功能紊乱即迷走神经兴奋,而交感神经被抑制有关。本研究结果与国内外研究结果基本一致。
DRs、心率变异性都是基于24 h动态心电图得出结果。由于24 h动态心电图简便、无创、经济,容易应用于临床。在做24 h动态心电图的同时,这些指标可以同时被观察。本研究结果显示,两者呈正相关。两者可以联合反映心脏自主神经功能状况,研究ICM患者两者之间的关系可以更好地预测和评估ICM患者疾病状况,从而可以更早、更好的提供治疗方案,从而服务于ICM患者。
[1]李国庆,郭自同.缺血性心肌病性冠心病概述[J].临床心血管杂志,2001,17(4):157-158.
[2]GUZIK P,PISKORSKI J,SCHMIDT G, et al. Heart rate deceleration runs for postinfarction risk prediction[J].J Electrocardiol,2012,45(1):70-76.
[3]郭继鸿.猝死预警新技术:连续心率减速力测定[J].临床心电学杂志,2012,21(3):227-233.
[4]LAITIO T,JALONEN J,KUUSELA T,et al.The role of heart rate variability in risk stratification for adverse postoperative cardiac events[J].Anesth Analg,2007,105(6):1548-1560.
[5]左萍,杨晓云,黄芬,等.急性心肌梗死患者连续心率减速力的研究[J].临床心电学杂志,2013,22(3):186-189.
[6]KISOHARA M,STEIN P K,YOSHIDA Y,et al.Multi-scale heart rate dynamics detected by phase-rectified sifnal averaging predicts motality after acute myocardial infarction [J].Europace 2013,15(3):437-443.
[7]LIU Y,SYED Z,SCIRICA B M,et al.ECG morphological variability in beat space for risk stratification after acute coronary syndrome [J].J Am Heart Assoc,2014,3(3):e000981.
[8]GAO L,CHEN Y D,SHI Y J,et al.Predication value of deceleration capacity of rate and GRACE risk score on major adverse cardiac events in patients with acute myocardial infarction [J].Zhonghua Xin Yue Guang Bing Za Zhi,2016,44(7):583-587.
[9]何文一,邓国兰,王伶莉,等.急性心肌梗死患者连续心率减速力的临床研究[J].江苏实用心电杂志,2014,23(3):167-169.
[10]常超,刘桂芝.不稳定型心绞痛患者连续心率减速力与心率减速力的关系分析.[J]中国全科医学,2013,16:3121-3123.
[11]EBRAHIMZADEN E,POOYAN M,BIJARA.A novel approach to predict sudden cardiac death(SCD)using nonlinear and time-frequency analyses from HRV singnals[J].PloS One,2014,9(2):e81896.
[12]SIMULA S,VANNIEN E,LEHTO S,et al.Heart rate variability associates with asymptomatic coronary atherosclerosis[J].Clin Auton Res,2014,24(1):31-37.
