EGFL-7介导的促血管生成作用在婴幼儿血管瘤中的作用及干预分析
2018-03-30王胜春李真真
王 胜,王胜春,李 琳,李真真
(郑州大学附属儿童医院/河南省儿童医院/郑州儿童医院皮肤科,郑州 450018)
婴幼儿时期也存在比较常见的皮肤良性肿瘤,比如婴幼儿血管瘤,多发于女童,主要发病部位为头部和颈部的皮肤。血管内皮异常增生导致了婴幼儿血管瘤的发生[1],一般而言,婴幼儿血管瘤的临床病理分期主要是增生期、消退期和消退完成期。就目前而言,婴幼儿血管瘤的发病机制尚未完全清楚,但近年来关于血管瘤新生血管的信号通路的问题引起了广泛讨论。表皮生长因子样结构域7(EGFL-7)是一种由内皮细胞分泌的特异性生长因子类似物,可控制内皮细胞的成管、增殖等生理过程,在胚胎发育过程及成人富含血管组织中,如肺、卵巢和肾脏中均呈高水平表达[2]。有研究发现,在增生期血管瘤瘤体中EGFL-7的表达量较高[3]。本研究选取50例血管瘤婴幼儿的组织标本及30例患儿为研究对象,探讨EGFL-7介导的促血管生成作用在婴幼儿血管瘤中的作用及干预措施,现报道如下。
1 资料与方法
1.1一般资料 收集本院2013年2月至2016年3月婴幼儿血管瘤的50例石蜡组织标本,本研究已经通过本院伦理委员会审批,且均经家属或监护人同意,并签署知情同意书。其中男17例,女33例;年龄2.5~9.0个月,平均(7.5±2.2)个月。将以上石蜡标本根据患儿临床表现、病史、B超及苏木素-伊红(HE)染色,按照Takahashi和Mulliken分类法将血管瘤分为3组:增生期组、消退期组、消退完成期组,分别有14、25、11例。采用自身对照设计,选取5例癌旁正常组织作为对照组。选取同期收治的30例增生期血管瘤患儿为研究对象,纳入标准:(1)均符合增生期血管瘤的诊断标准,并经局部增强CT或超声确诊;(2)家属均同意采用普萘洛尔治疗,并签署知情同意书;(3)患儿之前未接受过任何血管瘤的治疗;(4)年龄大于1个月;(5)血管瘤直径大于1.0 cm;(6)病变部位主要位于颜面部、颈部等部位,均为浅表型血管瘤;(7)完善相关辅助检查排除绝对禁忌证。排除标准:(1)合并有呼吸道疾病,如肺炎、支气管炎、支气管哮喘等疾病;(2)合并有心血管疾病,如心源性休克、Ⅱ~Ⅲ度房室传导阻滞、窦性心率过缓等;(3)过敏或合并别的疾病;(4)治疗依从性较差。其中男10例,女20例。年龄2.4~11.0个月,平均(8.2±2.5)个月。血管瘤部位:颌面部26例,躯干3例,四肢1例。
1.2仪器、设备及试剂
1.2.1仪器及设备 本研究的实验仪器主要有光学显微镜(OLYMPUS,美国),显微镜拍照系统和石蜡切片机(Leica,德国),高速冷冻离心机(herexi HR/T20MM 湖南),还有紫外分光光度计(T6 北京普析)等。实验设备主要包括SW-CJ-2FD超净工作台(苏净,中国);BioTek Power WaveXS2全波长酶标仪(BioTek宝特,美国);Cobas 6000 C501 Roche 生物显微镜(Roche,日本);全自动高压蒸汽灭菌器(予腾,上海);倒置荧光显微镜(OLYMPUS,美国);DK-522-电热恒温水浴锅(精宏实验设备,上海)等。
1.2.2试剂 磷酸盐缓冲液(PBS),4%多聚甲醛,盐酸乙醇,50%、75%、85%、95%乙醇,30%过氧化氢,无水乙醇Ⅰ和Ⅱ,二甲苯,二甲苯Ⅰ和Ⅱ,苏木素,免疫组织化学SABC试剂盒购自(赛默飞世尔,中国);抗EGFL-7鼠抗人单克隆抗体和EGFL-7 ELISA试剂盒(赛默飞世尔,中国)。
1.3方法
1.3.1HE染色 制作好的蜡块标本经4 μm连续切片,逐步靠近切片组织所在部位。然后拿防脱载玻片将切好的成连续状的蜡片用镊子夹入温水箱里,捞片,之后烘片。切片常规二甲苯脱蜡,将组织切片浸泡于pH 6.0的PBS中采用微波炉30 min修复抗原。3%过氧化氢室温孵育10 min,消除内源性过氧化物酶的活性。将制作好的玻片一部分用于HE染色,一部分用于免疫组织化学染色。
1.3.2免疫组织化学 制作好的蜡块标本经4 μm连续切片,制作免疫组织化学切片。取上述制作好的切片,加入了一抗,在4 ℃的温度下放置过夜,然后进行40 min的复温,并用PBS将其冲洗(3次,每次2 min),然后再加入二抗,并且在室内常温下进行30 min的孵育,PBS冲洗(3次,每次2 min);然后滴加SABC工作液,显色510 min后采用苏木素复染,见标本变红后水洗5 min。脱水晾干,透明树胶封片。按照试剂盒说明的免疫组织化学实验步骤检测组织内EGFL-7蛋白的表达情况。免疫组织化学的结果判定:每个标本取3张不同层面的切片,阳性细胞为胞质或胞膜出现棕黄色颗粒[4]。在400倍光镜下采用Olympus图像采集系统,对阳性区域进行半定量分析。
1.3.3干预方法 口服普萘洛尔干预血管瘤(天津力生制药厂生产),剂量按照患儿的年龄设定。对于小于3个月的患儿口服剂量为0.5 mg/kg,3~6个月大小剂量为1 mg/kg,>6个月的患儿剂量为2 mg/kg。治疗初期患儿入院观察3~5 d。治疗时间为4~8个月。治疗期间注意观察患儿的血压、心率及其他不良反应。于治疗前及治疗后12个月检测患儿血清、尿液中EGFL-7表达的变化。具体方法为:收集患儿的外周静脉血及尿样本。将全血及尿液标准置于室温下静置2 h后离心机离心15 min,取上清液用于指标检测。EGFL-7表达采用酶联免疫吸附试验-双抗夹心法测定,按照试剂盒的操作说明进行:将样品稀释,标准品、洗液工作液、辣根过氧化物酶标记物工作液配置好后进行加样,之后加入酶标抗体,然后底物显色。波长450 nm处测定各孔的吸光度(A)值,单位为μg/mL。
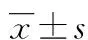
2 结 果
2.1血管瘤增生期组织的HE染色与正常皮肤组织比较 增生期血管瘤组织切片(图1A)管腔不明显,血管结构紊乱,细胞核大,染色深,可见核分裂,内皮细胞排列紊乱。与正常皮肤组织切片(图1B)相比细胞密度增加,间隔细胞少,形状不规则,成膨胀性向外生长。
2.2EGFL-7在各期血管瘤中的表达 EGFL-7在增生期与消退期组的表达高于消退完成期组和对照组,差异有统计学意义(P<0.05)。EGFL-7在消退完成期组与对照组中的表达差异无统计学意义(P>0.05),见表1。EGFL-7在增生期成强阳性或阳性表达(图2A),在消退期呈阳性表达(图2B),在消退完成期呈弱阳性或阴性表达(图2C),在对照组呈阴性表达(图2D)。
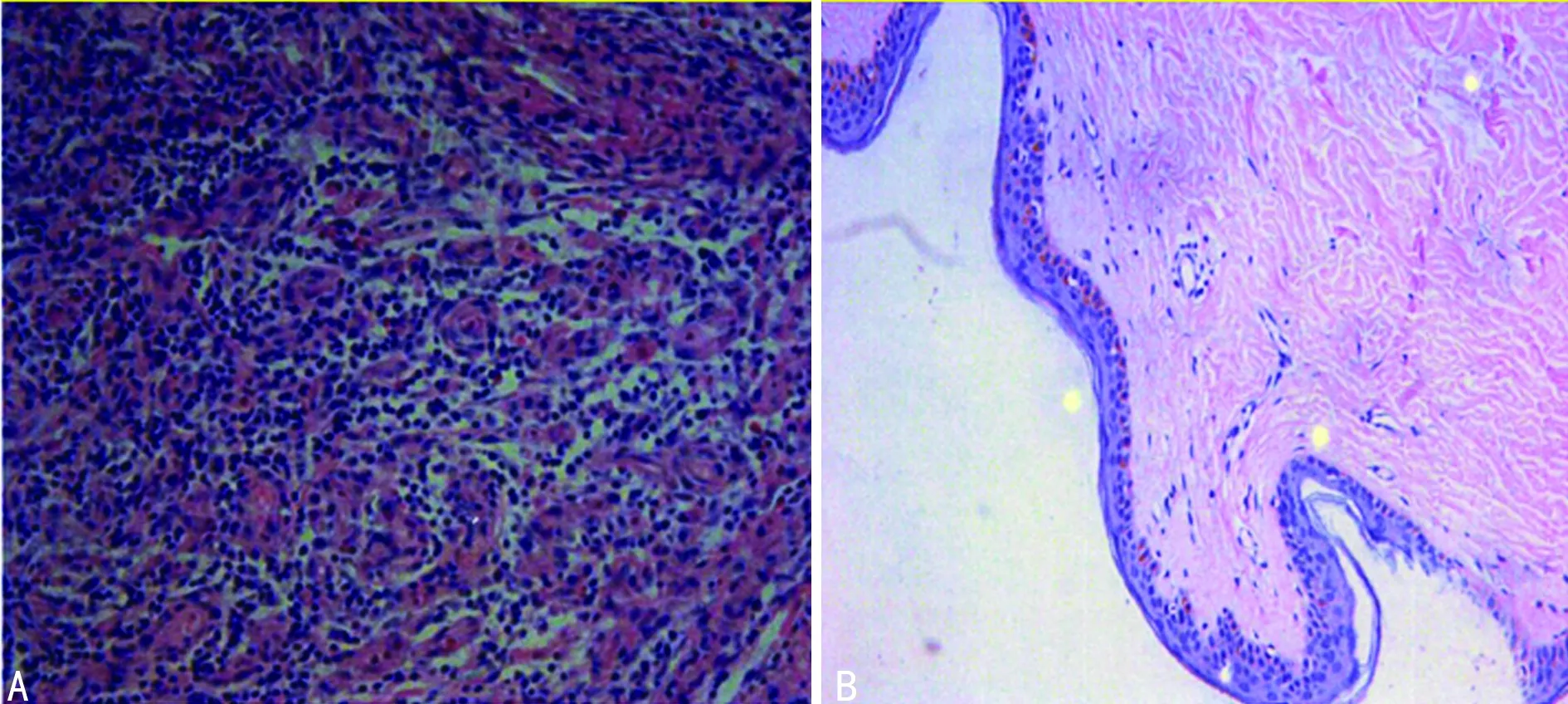
A:增生期血管瘤组织; B:正常皮肤组织
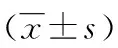
图1 组织HE染色(×100)表1 EGFL-7在各期血管瘤中的表达
a:P<0.05,与对照组比较
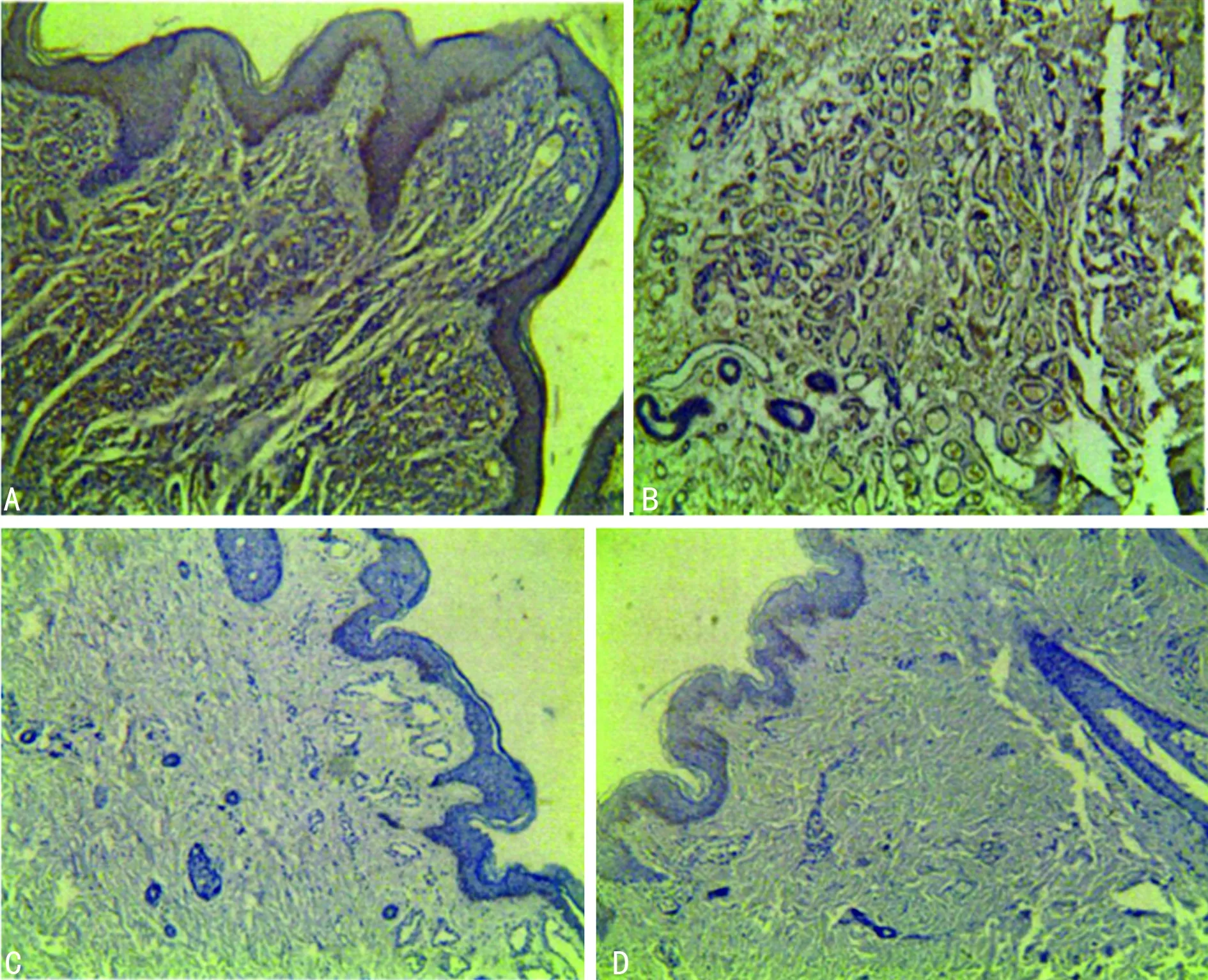
A:增生期组;B:消退期组;C:消退完成期组;D:对照组
图2 EGFL-7在各组中表达情况
2.3普洛萘尔干预前后血管瘤患者EGFL-7的表达情况 血管瘤的患儿经普萘洛尔干预后血清、尿液中的EGFL-7均低于干预前,差异有统计学意义(P<0.05),见表2。

表2 普洛萘尔干预前后血管瘤患者EGFL-7的表达情况(μg/mL)
a:P<0.05,与干预后比较
3 讨 论
血管瘤是以内皮细胞增生为特征的肿瘤,在新生儿中的发病率为1%~2%,在1岁时的婴幼儿发病率为10%~20%,可呈快速进展状态,半年内瘤体增生异常迅速,此后逐渐减慢。在血管瘤的病程进展过程中,血管内皮细胞由增生期不成熟的内皮细胞逐渐变成熟,但其具体机制并不清楚。EGFL-7是定位于人类9号染色体上的一个内皮特异性基因,包含2个生长因子类似的结构域[5]。EGFL-7是在2003年被发现,是一种血管生成的必需因子,特异性表达于内皮细胞系统,在促进内皮细胞增殖、迁移、出芽、黏附过程中有重要作用。近几年的研究发现,EGFL-7能够促进生理性和病理性的管腔形成、功能完善,在富含血管的组织和器官中有表达,而在正常成年组织中不表达或表达下调,该蛋白可以被激活,参与血管生成[6]。本研究结果显示,EGFL-7在婴幼儿血管瘤的增生期与消退期的表达高于消退完成期组和正常皮肤(P<0.05)。EGFL-7在消退完成期与正常皮肤中的表达差异无统计学意义(P>0.05)。这提示EGFL-7参与婴幼儿血管瘤的病情进展。
EGFL-7在内皮细胞上的表达可阻止平滑肌细胞迁出,使内皮细胞运动迁徙能力过度增强,维持肿瘤血管的稳定性[7]。有研究指出EGFL-7在组织扩增期的脉管系统中高表达,与本研究的结论基本一致。EGFL-7并不能刺激内皮细胞的增殖,而是通过促进血管内皮的迁徙,对内皮细胞黏附进行调节,并且还对血管平滑肌进行迁移抑制,以此来对肿瘤血管的发展起到维持的作用。因此,有研究推测,通过阻断或干扰血管瘤血管细胞EGFL-7的表达,可以阻止血管瘤微血管的形成,抑制血管生成和侵袭转移,达到治疗的目的[8]。普萘洛尔属于β肾上腺素能受体拮抗药,以往常用于心血管系统疾病的防治。但普萘洛尔于2008年被报道用于婴幼儿血管瘤的治疗中,并证实具有见效迅速、疗效显著、不良反应少等优点,所以其在婴幼儿血管瘤的治疗药物中逐渐成为了一线药物,替代了激素[9]。目前关于普萘洛尔治疗婴幼儿血管瘤的机制尚未有能被普遍接受的观点。有研究显示,普萘洛尔能够显著降低增殖期婴幼儿血管瘤患者外周血清和尿液中EGFL7水平,并认为这可能是普萘洛尔的治疗机制之一[10]。本研究通过对普萘洛尔干预治疗的血管瘤患儿的血液及尿液中的EGFL-7的表达情况进行检测发现,普萘洛尔能够下调血管瘤患儿EGFL-7的表达水平,与干预前比较差异有统计学意义。与上述研究结论基本一致。这提示普萘洛尔作用于增殖期血管瘤的作用机制中,最关键的可能是对EGFL-7的表达发生了抑制,然后间接影响血管的稳定性及血管床的构建,发挥血管增殖的抑制效果,促进血管瘤体的消退,达到治疗作用[11]。
综上所述,EGFL-7与血管生成有关,血管瘤组织中期表达显著增高,但经普萘洛尔干预后EGFL-7水平显著下降,这可能成为血管瘤干预的重要机制。
[1]MABETA P,PEPPER M S.Hemangiomas-current therapeutic strategies[J].Int J Dev Biol,2011,55(4/5):431-437.
[2]蒋卫东,曾季平,刘玉胜,等.类表皮生长因子域7与动脉粥样硬化斑块内血管生成关系[J].中华老年医学杂志,2012,31(1):39-43.
[3]高水超,杨新明,李仕晟,等.EGFL7在喉癌组织中的表达及临床意义[J].临床耳鼻喉头颈外科杂志,2013,27(3):147-150.
[4]李学军,黄纯海,李萃,等.EGFL7在人脑胶质瘤中的表达及其意义[J].肿瘤防治研究,2011,38(2):148-151.
[5]王强.miR-126、EGFL-7在婴幼儿血管瘤组织中的表达及意义[D].济南:山东大学,2015.
[6]徐广琪.普萘洛尔治疗婴幼儿血管瘤临床观察及作用机制的实验研究[D].济南:山东大学,2014.
[7]凌彬,陈曼丽,刘洁,等.普萘洛尔治疗增殖期血管瘤患者血管内皮生长因子-A及表皮生长因子样结构域7的表达分析[J].华西口腔医学杂志,2014,32(5):441-444.
[8]刘洁,凌彬,张静,等.普萘洛尔治疗婴幼儿血管瘤前后EGFL7的表达变化[J].中国口腔颌面外科杂志,2014,12(5):416-419.
[9]丁涛,曹东升,谢娟,等.普萘洛尔治疗婴幼儿血管瘤作用机制的动物实验研究[J].安徽医学大学学报,2014,49(9):1238-1241.
[10]符策奕,张泽华,张爱联,等.血管生成抑制素治疗血管瘤的研究[J].海南医学,2015,26(8):1111-1114.
[11]刘洁.普萘洛尔治疗增殖期血管瘤患者VEGF-A、HIF-1a及EGFL7的表达分析[D].乌鲁木齐:新疆医科大学,2015.
