多孔羟基磷灰石椎间融合器制备工艺研究
2018-03-29廖文波赵彦禹李学英吴明松张志敏
王 哲,刘 磊,敖 俊,廖文波,赵彦禹,李学英,吴明松,3,张志敏
(1.遵义医学院 医学遗传学教研室,贵州 遵义 563099;2.遵义医学院附属医院 脊柱外科,贵州 遵义 563099;3.遵义医学院 贵州省高等学校口腔疾病研究特色重点实验室/医学与生物学研究中心,贵州 遵义 563099)
脊椎融合术是一种可以有效恢复脊柱稳定性、保护神经功能的治疗方式。椎间融合是在椎体间隙切除椎间盘结构,刮除上下软骨终板,在两椎体间植入各种融合材料,不但可减少内固定螺钉松动、折断、拔出等并发症,同时能加速和提高椎体间融合率和融合质量[1-2]。寻求一种理想的椎间融合器材料是近年来脊柱融合的研究热点,目前临床上常用的椎间融合器多为金属[3]、可吸收的外消旋聚乳酸(Poly-DL-lactic Acid,PDLLA)[4]、聚醚醚酮[Poly(ether-ether-ketone),PEEK][5]等材料,然而,这类材料易出现诸如应力遮蔽效应、降解产物有害、不能与周围骨组织实现真正的融合进而影响椎间的力学稳定性等问题[6-8]。
羟基磷灰石(Hydroxyapatite,HA)是自然骨的主要基质组成,是骨组织中的主要无机矿物,具有优良的生物相容性、生物活性以及较高的弹性模量,目前HA陶瓷在骨科、牙科临床修复中广泛使用,是一种优异的骨组织修复材料[9-12]。理想的椎间融合器材料需要能够在有效的时间内达到真正融合,且植入体内后无毒副作用及诱发组织癌变,而目前HA用于椎间融合器制备仍存在脆性较大、力学强度较差,体内降解时间较长等缺点。因此,本研究以羟基磷灰石为原料,探索HA制备椎间融合器的制备工艺,并通过调节工艺参数寻找其孔隙率及力学强度的平衡点,使制得融合器具有与人体松质骨近似的三维连通孔隙结构,并具备合适的力学强度及较高的成骨性能,为HA的临床应用补充有效数据及提供科学依据。
1 材料与方法
1.1 主要实验材料和试剂 聚乙二醇6000(Polyethylene Glycol 6000,PEG6000)、甲基纤维素(Pethylcellulose,MC)、30%双氧水和无水乙醇等均购于四川成都市科龙化工试剂厂,羟基磷灰石粉体购于四川大学生物材料中心(生产批号:01151101)。所有试剂和原料在使用之前均未作其它改变。
1.2 实验仪器 马弗炉(上海一恒SX2-4-13),万能材料试验机(日本岛津公司AGS-X),扫描电子显微镜(日本日立公司S-4800),精密电子天平(赛多利斯科学仪器有限公司BSA-124S),超声清洗器(上海冠特超声仪器有限公司SG3300HPT),电热鼓风干燥箱(上海博迅实业有限公司GZX-9076MBE),小型台磨机(浙江永康市蒂凡工具有限公司MOD-DF-4)。
1.3 方法
1.3.1 试剂配置 分别准确称量5 g聚乙二醇和1 g甲基纤维素于不同玻璃烧杯中,分别加入100 mL去离子水,并充分搅拌直至溶液完全澄清后得到质量体积浓度为5%的PEG水溶液和质量体积浓度为1%的MC水溶液;均静置保存在室温下备用。
1.3.2 浆料的制备 准确称量5份25 g羟基磷灰石粉体于5个100 mL玻璃烧杯中,每个烧杯中依次加入5%PEG溶液7 mL、1%MC溶液10 mL和去离子水10 mL,用搅拌器充分搅拌均匀后,置于超声清洗器中超声15 min,随后加入体积分数为30%的双氧水并充分搅拌得到羟基磷灰石浆料,以不同的双氧水加入量1 mL、3 mL、5 mL、7 mL、10 mL,分别将后续得到的样品命名为S1、S3、S5、S7、S10。
1.3.3 坯体成型 采用微波辅助双氧水发泡法,将混合均匀的HA浆料放入微波炉中加热,使双氧水分解产生气泡,膨胀后的浆料倒入自制透气性良好的圆筒形模具中(φ=15 mm×10 mm),置于鼓风干燥箱中在45 ℃下烘干12 h,脱模后得到陶瓷素坯。
1.3.4 烧结切割 将烘干后的素坯置于马弗炉中烧结成瓷,烧结温度制度为:室温~300 ℃,60 min;300 ℃保温120 min;300~1 150 ℃,160 min;1 150 ℃保温120 min;1 150 ℃~室温,随炉冷却。将烧结后的羟基磷灰石陶瓷块用小型台磨机切割加工,然后打磨成同一规格尺寸的样品,再经超声清洗后烘干待用。
1.3.5 表征测试 利用阿基米德排水法测量样品孔隙率[13]。将样品上下两面用小型台磨机磨平,准确测量样品尺寸后采用万能材料试验机测试材料的抗压强度,传感器载荷为2 000 N,加载速度为1 mm/min,每种试样均测7个平行样品。样品宏观孔隙结构用番红溶液上色后进行观察,进一步使用扫描电镜(SEM)来表征样品的孔结构。

2 结果
2.1 样品形貌 烧结后的多孔羟基磷灰石陶瓷样品呈圆柱形,与素坯相比收缩率为20%~30%,属正常范围。样品浸润番红溶液后肉眼明显可见其表面孔隙结构,如图1所示,S1样品的孔较为致密,孔隙较小,材料表面观察不到较大孔隙;随双氧水加入量增多,样品孔隙越丰富,孔隙结构也变得疏松,S3、S5、S7表面已出现较大孔隙,S10表面有丰富的连通孔隙。图2为按照临床现有医用椎间融合器尺寸进行切割打磨后得到的椎间融合器模型,模型设计为类长方体型块体,模型长×宽:10 mm×8 mm,上下表面平行,模型厚度为8 mm。

图1 制备的多孔羟基磷灰石陶瓷样品

图2 制备的多孔HA椎间融合器样品(A:前视图;B:俯视图)
2.2 孔隙率及抗压强度 由图3可知,S1、S3、S5、S7、S10孔隙率分别为(24.6±5.7)%、(22.4±0.7)%、(57.7±4.0)%、(54.2±3.3)%、(78.4±2.3)%,对应样品的抗压强度分别为(13.8±3.4) MPa、(10.2±0.8) MPa、(7.3±1.0) MPa、(5.1±1.2) MPa、(0.6±0.1) MPa。随着样品的孔隙率降低,其对应的抗压强度逐渐提高,当孔隙率降低到25%左右时,样品的抗压强度为最大值13.8 MPa,样品孔隙率与其抗压强度呈负相关。为了验证该结果,我们对样品的孔隙率与抗压强度做了相关性分析,r值为-0.84,两者呈负相关且相关度较高。

* P < 0.05。图3 多孔HA陶瓷样品不同组间孔隙率(A)和抗压强度(B)的变化
由图4可知,样品组S1、S3、S5、S7的断裂方式均为刚性断裂,有明显断裂点,随后材料被破坏;各组平行样中最大载荷可达约1 500 N,对应的抗压强度为17.6 MPa。随样品孔隙率的增加,抗压强度逐渐降低,其能承受的最大载荷也逐渐降低,对于孔隙率最高的S10样品,其断裂曲线中并无明显断裂点,最大载荷仅约为50 N,强度远低于其他各组。
2.3 孔隙结构 图5为S7组样品的SEM照片,电镜下放大100倍后可以看到,样品内都有非常多的球形孔隙,孔隙大小不一,尺寸分布在100~500 μm,随机选取部分区域(图5A中白色方框范围)进一步放大至200倍,可以看到球形大孔的孔壁上有丰富的贯通孔(图5B中箭头所示),其尺寸分布在20~50 μm。
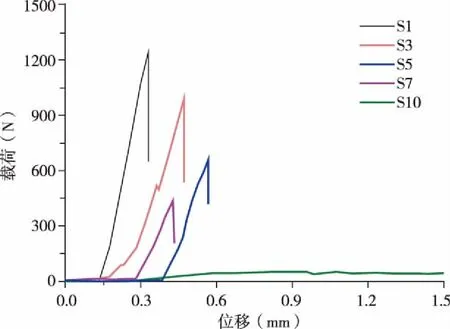
* P < 0.05。图4 不同多孔羟基磷灰石陶瓷样品的载荷-位移图
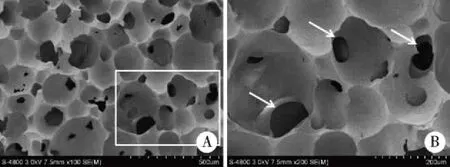
A:孔隙结构;B:贯通孔。图5 多孔羟基磷灰石陶瓷的SEM照片
3 讨论
可用于制备椎间融合器的材料应主要具有以下几方面的性质[9]:①为术后的缺损充当暂时性充填和支持功能。为此,材料应具有基本的填充功能和足够的力学强度。②引导宿主组织长入缺损部位,形成修复体与宿主组织间的牢固结合,使修复体能更好地行使修复作用和融合功能。为此,融合器的结构应考虑设计为多孔结构[14-15]。③诱导新生骨组织形成,实现损伤缺损部位的骨组织再生。因此,理想椎间融合器材料的选择,首先需具备良好的生物相容性及较高生物活性,无毒副作用及诱发组织癌变;其次应具有较强的成骨能力,能在有效的时间内完成新骨生长,实现真正的椎间融合;另外,融合器一般用于承重部位,因此需具备一定的抗压强度,避免椎弓根钉棒系统发生断钉等术后并发症。
近10年来,随着生物材料的飞速发展,部分生物活性材料诸如纳米羟基磷灰石-聚酰胺66(nHA/PA66)复合材料已经用于设计制备椎间融合器并应用于临床[11,16-19],但其自身的材料学因素限制了其临床应用范围,一方面,此类融合器的生物活性还有待提高;另一方面,降解产物可能对组织愈合产生不利影响。因此本研究选择HA陶瓷材料来制备椎间融合器。对于多孔HA陶瓷的制备,关键在于成型,目前的成型方法主要有添加造孔剂法、有机泡沫浸渍法、3D打印、气体发泡法等。其中添加造孔剂法可能会引入杂质成分,进一步带来生物毒副作用等问题;有机泡沫浸渍法制备的多孔材料力学强度较差,远不能满足承力部位所需。因此,本研究使用了工艺相对简单,成本低廉,且可以制备出大量内部贯通孔结构的气体发泡法制备工艺制孔,并希望通过调节陶瓷成型时加入双氧水的量来调节分解气体的量,从而调节孔隙率。
从结果可以看到,随着材料孔隙率的降低其抗压强度会显著提升:当多孔HA陶瓷样品孔隙率达(78.4±2.3)%时,其抗压强度仅为0.6±0.1 MPa;而孔隙率降至(24.6±5.7)%后,样品抗压强度则升至13.8±3.4 MPa,是高孔隙率样品的23倍,充分表明了通过调节孔隙率来调节样品的抗压强度是行之有效的方法。此外,从图4中可以看出,前4组(S1-S7)材料在被破坏时均为刚性断裂,表明其力学性能已适用于椎间融合术中作为植入材料,对于S10组,其强度太低,较小的载荷即可对其造成破坏,不满足本研究所需。另外,对于植入材料的高生物活性,除材料本身化学成份外还需要有大小孔均匀分布、大孔套小孔且孔间贯通的结构,该结构更易于骨组织长入,一定条件下甚至能够诱导骨髓基质干细胞向成骨细胞分化[9,20-22]。从图5中可以看到,本研究所制备的多孔HA陶瓷即具有这种大孔套小孔,孔间贯通的结构。研究指出,当植入样品的孔隙率大于30%时,才可有效促进骨长入,对比我们所制备的样品,样品S5、S7、S10组满足该条件。而对于抗压强度值来说,黄建松等[23]通过体外实验研究表明,健康成人在静态载荷作用下,胸椎(T1~T12)上的抗压强度平均值大约为6.37 MPa,腰椎(L1~L5)上的抗压强度平均值大约为6.14 MPa,对于此抗压强度值的要求,样品组S1、S3、S5满足条件。
综上所述,本研究认为,S5组多孔HA陶瓷材料初步满足了作为承力部位植入物对于孔隙率及抗压强度的要求。因此在本文所述的这一成型工艺条件下,所制得的多孔HA陶瓷同时具有合适的孔隙率及抗压强度,有望进一步用于设计加工制备椎间融合器。
[1] Delécrin J,Aguado E,Nguyen J M,et al.Influence of local environment on incorporation of ceramic for lumbar fusion.Comparison of laminar and intertrans verse sites in a canine model[J].Spine,1997,22(15):1683-1689.
[2] 郝勇,周跃.目前临床应用的腰椎椎间融合器的现状与进展[J].中国骨与关节损伤杂志,2003,18(12):854-857.
[3] Duhon B S,Cher D J,Wine K D,et al.Triangular titanium implants for minimally invasive sacroiliac joint fusion:A prospective study[J].Global Spine Journal,2016,06(3):257-269.
[4] 李开南,汪学军,兰海,等.聚-DL-乳酸生物降解腰椎融合器的设计及材料学特点[J].中国组织工程研究,2008,12(32):6300-6304.
[5] Schimmel J J,Poeschmann M S,Horsting P P,et al.PEEK cages in lumbar fusion:Mid-term clinical outcome and radiological fusion[J].Journal of Spinal Disorders & Techniques,2016,29(5):252.
[6] Heo W,Dong H K,Park K B,et al.Is titanium mesh cage safe in surgical management of pyogenic spondylitis?[J].Journal of Korean Neurosurgical Society,2011,50(4):357-362.
[7] 赵勃然,郑修军,马金荣.椎间融合器及其材料的研究与进展[J].中国组织工程研究,2017,21(2):315-321.
[8] Suzuki T,Abe E,Miyakoshi N,et al.Anterior Decompression and shortening reconstruction with a titanium mesh cage through a posterior approach alone for the treatment of lumbar burst fractures[J].Asian Spine Journal,2012,6(2):123-130.
[9] Hong Y L,Fan H S,Li Bo,et al.Biological effects,and medical applications of calcium phosphate nanoceramics[J].Materials Science and Engineering(R:Reports),2010,70:225-242.
[10]Wang Z,Tang Z R,Qing F Z,et al.Applications of calcium phosphate nanoparticles in porous hard tissue engineering scaffolds[J].Nano:Brief Reports and Reviews,2012,7(4):1230004:1-18.
[11]马龙冰,贾云兵,宋跃明,等.聚氨基酸/纳米羟基磷灰石/硫酸钙椎间融合器在腰椎融合术中的初步应用[J].中国修复重建外科杂志,2016,30(3):328-335.
[12]石岩,崔文岗,肖德明.腰椎椎间融合器临床研究进展[J].国际骨科学杂志,2013,34(1):45-48.
[13]全国工业陶瓷标准化技术委员会.多孔陶瓷显气孔率、容重试验方法:GB/T 1966-1996 [S].北京:中国标准出版社,1997:4.
[14]Hing K A.Bioceramic bone graft substitutes:Influence of porosity and chemistry[J].International Journal of Applied Ceramic Technology,2005,2(3):184-199.
[15]Hollister S J.Porous scaffold design for tissue engineering[J].Nature Materials,2005,4(7):518.
[16]马金梁,祝利平,刘克斌,等.部分可吸收椎间融合器用于山羊腰椎融合效果评价[J].生物骨科材料与临床研究,2015,12(6):5-9.
[17]邓乾兴,欧云生,蒋电明,等.n-HA/PA66椎间融合器在颈椎病前路椎间盘切除减压融合术的中期临床疗效[J].重庆医科大学学报,2016,41(5):489-494.
[18]Zou Q,Li J,Zuo Y,et al.Crosslinked chitosan coated n-HA/PA66 scaffolds with controlled drug release capability for bone tissue engineering application[J].Nanomedicine Nanotechnology Biology & Medicine,2016,12(2):494-495.
[19]陈刚,廖前德,胡优威,等.成骨诱导人脐带间充质干细胞复合nHA/PA66支架异位成骨作用的实验研究[J].医学临床研究,2017,34(4):666-669.
[20]Perez R A,Mestres G.Role of pore size and morphology in musculo-skeletal tissue regeneration[J].Materials Science & Engineering C,2016,61(1):922-939.
[21]Tang W,Lin D,Yu Y,et al.Bioinspired trimodal macro/micro/nano-porous scaffolds loading rhBMP-2 for complete regeneration of critical size bone defect[J].Acta Biomaterialia,2015,32(3):309-323.
[22]Dalby M J,Gadegaard N,Tare R,et al.The control of human mesenchymal cell differentiation using nanoscale symmetry and disorder[J].Nature Materials,2007,6(12):997.
[23]黄建松,李政年.人体胸腰椎体几何学测量及生物力学特性实验研究[J].中国生物医学工程学报,2015,34(5):629-633.
