新生儿化脓性脑膜炎临床特征分析
2018-03-28杜维纳巨容高淑强王译田欣
杜维纳 巨容 高淑强 王译 田欣
(成都市妇女儿童中心医院新生儿科,四川 成都 610031)
新生儿化脓性脑膜炎(细菌性脑膜炎,purulent meningitis, PM)是新生儿时期严重的感染性疾病,如不及时治疗,可导致新生儿死亡,幸存者亦有可能遗留失听、失明、癫痫及脑瘫等多种后遗症[1-2]。血脑屏障发育不完善是新生儿易发化脓性脑膜炎的主要原因[3],在发达国家仍有较高的发病率(0.6%)[4], 而发展中国家具有更高的发病率和病死率[5],早期识别及合理诊治是降低病死率、改善预后的关键。本研究回顾我院5年来的新生儿化脓性脑膜炎病例76例,并对该病患儿的临床表现、病原学、诊断治疗及预后等进行总结和分析,以期指导临床工作。
1 资料与方法
1.1 一般资料 以我院新生儿科2011年1月~2015年12月收治确诊的76例新生儿化脓性脑膜炎患儿为研究对象,根据胎龄分为足月儿组和早产儿组,足月儿组 50例,男性 27例,女性23例,发病年龄:0~7d 21例,8~28d 29例;早产儿组26例,男性15例,女性11例,0~7d 16例,8~28d 10例。
1.2 诊断及排除标准 参照《实用新生儿学》诊断标准[6],具备化脓性脑膜炎临床表现,脑脊液常规及生化符合化脓性脑膜炎诊断标准或脑脊液细菌培养阳性。诊断标准: ①体温异常,纳差,精神差,惊厥或凝视等。②颅高压表现: 前囟隆起,骨缝裂开,脑膜刺激征阳性。③脑脊液白细胞数: 足月儿组:日龄<1周,>32× 106/L;>1周,>10× 106/L。早产儿组:>29× 106/L;糖降低,蛋白水平升高。④脑脊液细菌培养阳性或涂片可见细菌。符合①~③可临床诊断,具备④可确诊。排除标准:①存在先天性脑发育畸形患儿。②存在缺氧缺血性脑疾病及颅内出血患儿。
1.3 治疗处理经过 所有患儿及时送检血液、脑脊液的常规检查和细菌培养。54例患儿接受了两种抗生素的抗感染治疗(青霉素类+三代头孢类者46例,碳青霉烯类+万古霉素5例),17例仅选用碳青霉烯类,6例仅选用万古霉素;14例仅接受甘露醇、11例接受丙种球蛋白等对症支持治疗。为研究化脓性脑膜炎对脑组织的损伤情况,患儿在确诊新生儿化脓性脑膜炎并接受有效治疗3周后,征得患儿家属同意,行头颅核磁、脑电图及听觉诱发电位检查,治愈患儿在出院前完成以上检查。
1.4 统计学处理 应用SPSS 16.0统计软件处理数据,计量资料组间比较采取t检验,计数资料采用2检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床表现 足月儿组、早产儿组患儿在发热、惊厥及肌张力异常方面差异均有统计学意义(P<0.05)。足月患儿常有发热、惊厥、肌张力升高或降低改变,早产患儿常有呼吸暂停发作。足月儿组患儿并发头颅血肿感染8例,与早产儿组比较,差异有统计学意义(P<0.05),两组合并肺炎、败血症均较多见,但差异无统计学意义(P<0.05),见表1。
2.2 辅助检查
2.2.1 血常规、C反应蛋白(CRP)、降钙素原(PCT)及脑脊液(CSF)检查 所有患儿在当天完成血常规、CRP、PCT及脑脊液检查。两组患儿静脉血白细胞、CRP、PCT均有升高,但组间差异无统计学意义(均P>0.05);脑脊液细胞数、蛋白及糖检测均符合新生儿化脓性脑膜炎诊断标准,差异亦无统计学意义(均P>0.05),见表2。
Table1Comparisonofclinicalmanifestationsbetweenthetwogroups
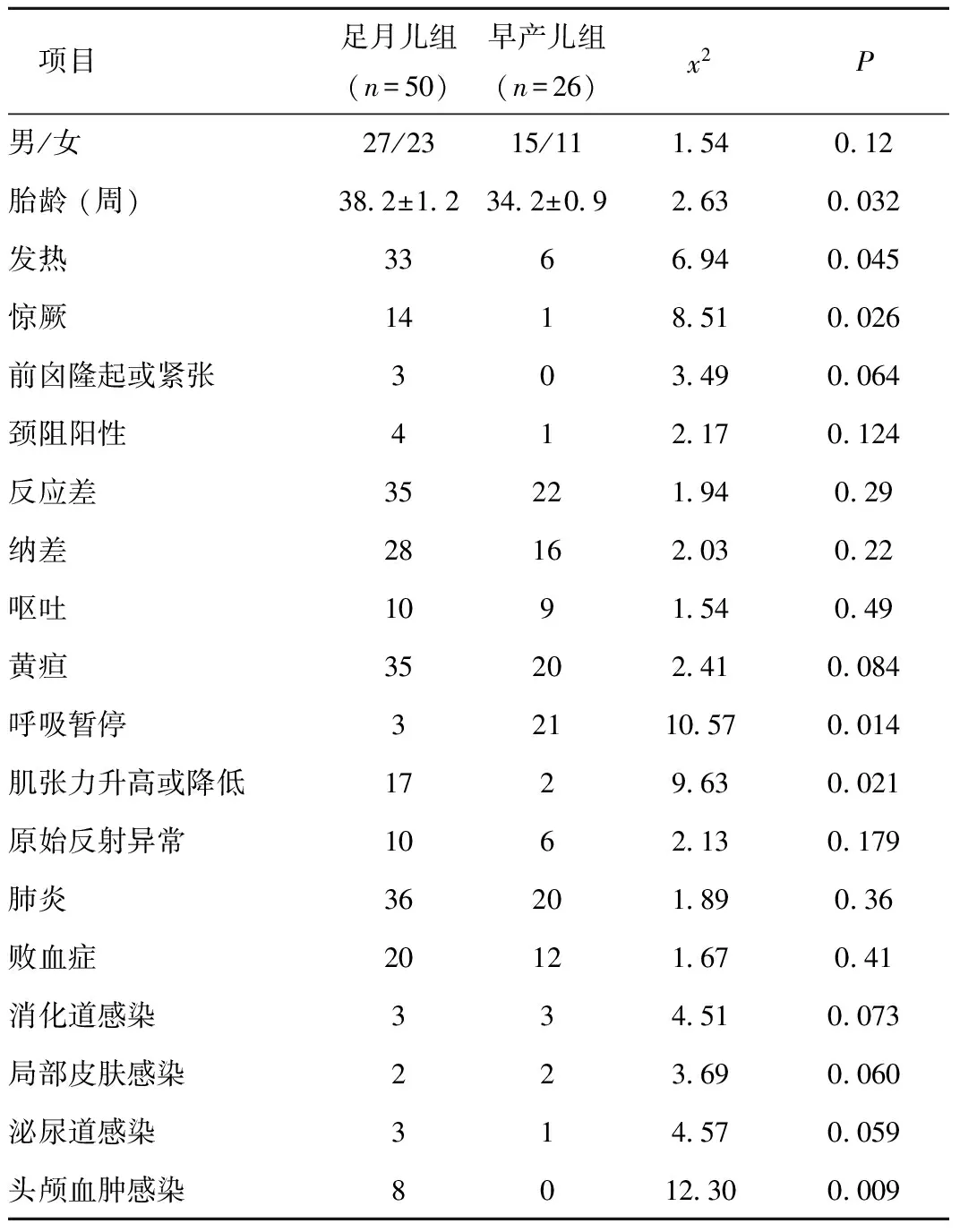
项目足月儿组(n=50)早产儿组(n=26)x2P男/女27/2315/111 540 12胎龄(周)38 2±1 234 2±0 92 630 032发热3366 940 045惊厥1418 510 026前囟隆起或紧张303 490 064颈阻阳性412 170 124反应差35221 940 29纳差28162 030 22呕吐1091 540 49黄疸35202 410 084呼吸暂停32110 570 014肌张力升高或降低1729 630 021原始反射异常1062 130 179肺炎36201 890 36败血症20121 670 41消化道感染334 510 073局部皮肤感染223 690 060泌尿道感染314 570 059头颅血肿感染8012 300 009
2.2.2 血培养及脑脊液培养结果 所有患儿均多次送检血培养及脑脊液培养检查,足月儿组血培养阳性16例(32%),早产儿组血培养阳性9例(34.6%),两组间差异无统计学意义(P>0.05);足月儿组 CSF 培养阳性9例(18%),早产儿组 CSF培养阳性5例(19.2%),两组间差异亦无统计学意义(P>0.05)。足月儿组中8 例患儿CSF 培养与血培养为同一种细菌,分别为大肠埃希菌4例,无乳链球菌 3 例,溶血葡萄球菌1例;早产儿组中4例患儿CSF培养与血培养为同一种细菌,分别为无乳链球菌2例,大肠埃希菌2例,见表2、3。
2.3 临床短期预后评估 76例患儿平均住院时间29.6d,无死亡病例。出院时痊愈(临床正常、脑脊液正常、无并发症)53例(69.7%),好转23例(30.2%)。28.9%的患儿头颅核磁检查存在不同程度脑损伤,早产患儿发生脑出血、脑白质异常信号改变及听觉诱发电位异常的机率较足月患儿增大,组间差异有统计学意义(P<0.05),见表4。
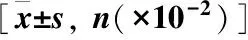
Table2Comparisonoftheresultsofvenousbloodandcerebrospinalfluidinthetwogroups

项目足月儿组(n=50)早产儿组(n=26) 2P静脉血 白细胞 (×109/L)18±412±62 780 06 CRP增高 (>8mg/L)36(72.0)17(65 4)0 060 9 PCT升高 (>2ng/ml)40(80.0)20(76 9)0 040 8 血培养阳性16(32.0)9(34 6)2 110 3脑脊液 白细胞 (×106/L)160(571198)117(69986)-1 320 4 蛋白质 (mg/L)1247(6911807)1641(8261946)-2 610 32 葡萄糖 (mmol/L)2 2±1 51 7±1 30 30 42 CSF培养阳性9(18.0)5(19 2)2 10 29
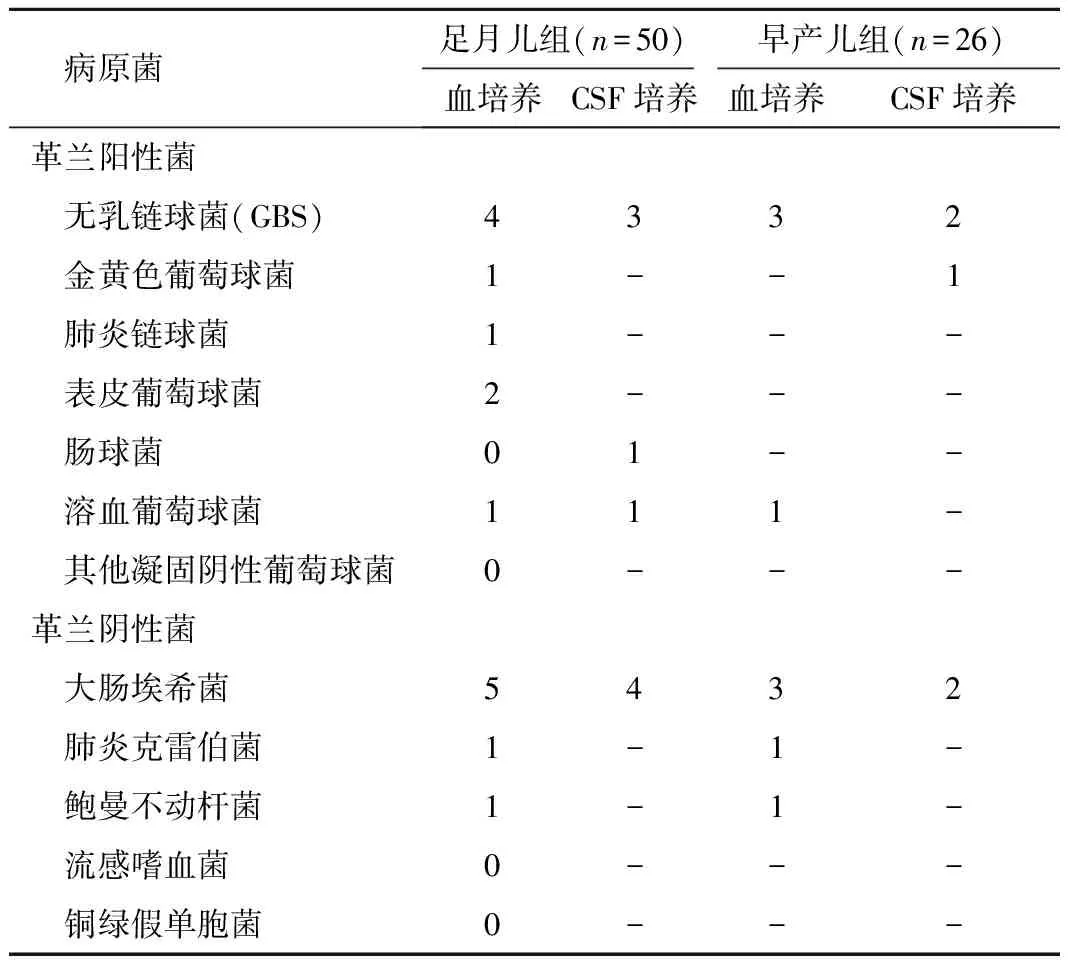
表3 两组患儿病原菌分布比较(n)Table 3 distribution of pathogenic bacteria in the two groups
3 讨论
新生儿时期,化脓性脑膜炎的发病率高于其他时段的婴幼儿[7],但由于新生儿前囟及骨缝未闭,颅骨较其他年龄组易分离,因此呕吐、前囟饱满或隆起等颅压增高表现较晚或不明显,且惊厥症状及脑膜刺激征表现不典型,故新生儿化脓性脑膜炎常缺乏特异的症状和体征,早期诊断不易。本研究发现,足月患儿多数有发热表现,早产患儿发生呼吸暂停比例大,故对于不明原因或临床无法解释的发热和呼吸暂停患儿要高度警惕化脓性脑膜炎的可能,建议行颅内感染的筛查,以免漏诊。同时本研究中共有8例患儿有头颅血肿,其中6例并发血肿感染,目前尚未见头颅血肿与化脓性脑膜炎的相关性研究报道。由于血肿感染引发的发热等症状会影响临床对化脓性脑膜炎并发症及治疗疗效的判断,故需仔细检查血肿的局部改变,必要时需外科局部清创治疗。
Table4Comparisonofshort-termprognosisbetweenthetwogroups

项目足月儿组早产儿组 2P平均住院时间(d)25±431±96 420 048治愈39(78 0)14(53 8)5 560 046好转11(22 0)12(46 2)5 940 042脑电图中度及以上异常314 360 12听觉诱发电位检查异常239 420 02头颅MRI检查 硬脑膜下积液103 020 29 脑积水11⁃0 41 脑出血258 720 013 脑脓肿00⁃0 41 脑梗塞103 020 29 脑萎缩103 020 29 脑软化012 610 34 脑白质异常信号3610 240 01
新生儿化脓性脑膜炎患儿外周血液感染相关指标同样无特异性,同其他部位感染一样,大多有C反应蛋白及降钙素原升高。有研究[8]认为,PCT 在细菌性脑炎中异常增高的程度与感染的严重程度相关,白细胞计数可能出现升高,也可表现为正常,严重的颅内感染亦可出现白细胞计数减少。本研究发现,足月患儿以白细胞计数升高为主,而早产患儿则多数有白细胞减少,这可能与早产儿自身免疫功能不成熟和感染重有关。本资料中新生儿化脓性脑膜炎血培养率为32.9%,脑脊液培养阳性率为18.4%。病原菌检出率低考虑主要与以下原因有关:新生儿化脓性脑膜炎临床表现不典型,常在抗生素应用后才进行脑脊液检查,导致脑脊液细菌检出率较低;其次,很多患儿住院前在门诊或基层医院已用过抗生素。
引起新生儿化脓性脑膜炎的病原菌在不同国家、不同地区会有所差异。法国的一项对覆盖全国61%范围的252家儿科病房、共444例新生儿细菌性脑膜炎的调查研究显示, 该病的病原体以无乳链球菌(GBS,59%) 、大肠杆菌(28%) 多见, 认为GBS是新生儿细菌性脑膜炎的主要病原菌, 而大肠杆菌是早产儿感染最常见的细菌[9]。英国Okike 等[10]的研究也表明, GBS是引起新生儿脑膜炎的主要细菌,占56.7%; 其次为大肠杆菌(14.7%) 、 肺炎链球菌(5.9%) 等。国内引起新生儿脑膜炎的病原菌报道不同地区有所差异, 但以大肠埃希菌较多见[6], 近几年国内有关GBS 感染的报道较前明显增多[11],已成为我国不少经济发达地区足月儿细菌性脑膜炎的首要致病菌[12]。本研究中引起化脓性脑膜炎的细菌以大肠埃希菌( 7.9%) 占首位,其次为无乳链球菌(6.6%),与其他研究一致[ 11,13]。大肠埃希菌和GBS寄居在正常人的生殖道和肠道,其病原菌暴露的高风险时期为分娩期。分娩时,大肠埃希菌和GBS可通过垂直传播感染新生儿,分娩后期因肠道免疫因子分泌不足及新生儿肠道黏膜通透性较大等因素, 故新生儿成为感染的高危人群[14-15]。此外,大肠埃希菌的抗体是IgM,其难以通过胎盘,导致新生儿对大肠埃希菌缺乏免疫力[16],故新生儿成为大肠埃希菌和GBS感染的高危人群。欧美等发达国家认为预防新生儿GBS 感染最关键的因素是识别母亲妊娠期定植菌情况[17],研究表明,妊娠期普遍筛查和产时抗生素预防应用可显著降低新生儿早发型GBS感染的风险[18]。由于经济条件和重视程度不够等原因,我国目前只有少数经济发达地区开展了晚期孕妇GBS的筛查工作,产科及新生儿科医生应加强对GBS感染的认识,必要时尽早完善相关筛查及抗感染治疗。
新生儿化脓性脑膜炎的后遗症发生率因国家、地区、文化、经济等差异而不同。在发达国家,20%~58%新生儿化脓性脑膜炎存活者有严重的神经系统后遗症[19]。根据病原菌不同,其后遗症发生的风险亦不同。在新生儿化脓性脑膜炎中,革兰阴性菌感染的患儿预后较差[20]。目前国内尚未见新生儿化脓性脑膜炎预后长期研究的相关报道。本研究中早产儿组的治愈率低于足月儿组,这可能与早产儿组因社会因素等原因放弃治疗有关;治愈患儿中,早产儿组住院天数整体较足月儿组长;患儿头颅MRI检查发现28.9%的患儿存在不同程度的脑损伤,其中以脑白质异常信号改变和脑出血多见,尤其是早产患儿发生脑出血、脑白质异常信号改变和听觉诱发电位异常的机率更大,提示早产患儿远期发生脑功能障碍及听力损伤的机率较足月患儿更大。
4 结论
新生儿化脓性脑膜炎的临床表现不典型,临床实践中需要细致观察临床症状及体征,抗生素应用前早期行腰穿检查,综合分析脑脊液常规、生化及培养,以期早期诊断与治疗,并根据病原菌检查早期更换有效抗生素,以期提高生存率, 降低死亡率及神经系统后遗症发生率。
[1]Hudson LD, Viner RM, Christie D. Long-term sequelae of childhood bacterial meningitis[J]. Curr Infect Dis Rep, 2013, 15(3): 236-241.
[2]李小玉,邓春,苏云娟. 98例足月儿、早产儿化脓性脑膜炎临床分析[J].第三军医大学学报,2013,35(19):2105-2107.
[3]Xu C, Zhu H, Wu J,etal. Increased permeability of blood-brain barrier is mediated by serine protease during Cryptococcus meningitis[J]. J Int Med Res, 2014, 42(1): 85-92.
[4]Bentlin MR, Ferreira CL, Rugclo LM,etal. Neonatal meningitis according to the microhiogical diagnosis a decade of experience in a tertiary center[J]. Am Nemopsiquiatr,2010,68(6):882-887.
[5]Liu L, Johnson H, Cousens S,etal. Global, regional, and national causes of child mortality: an updated systematic analysis for 2010 with time trends since 2000[J].The Lancet,2012,379(9832):2151-5161.
[6]邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].第4版.北京:人民卫生出版社,2011:347-351.
[7]Lin MC, Chiu NC, Chi H,etal. Evolving trends of neonatal and childhood bacterial meningitis in northern Taiwan[J]. J Microbiol Immunol Infect, 2013, 157(13):S1684-S1182.
[8]林应荣,江金彪,罗玲玲,等.降钙素原在儿童不同病原体感染脑膜炎鉴别中的临床应用研究[J].中华医院感染学杂志,2014,24(2):492-494.
[9]Gaschignard J, Levy C, Romain O,etal. Neonatal Bacterial Meningitis : 444 Cases in 7 Years [J]. Pediatr Infect Dis J, 2011 ,30 (3): 212 -217.
[10] Okike IO, Johnson AP, Henderson KL,etal. Incidence, etiology, and outcome of bacterial meningitis in infants aged <90 days in the United kingdom and Republic of Ireland:prospective, enhanced, national population-based surveillance [J]. Clin Infect Dis , 2014 ,59 (10 ):150-157.
[11] 赵宁,王萍,魏谋. 无乳链球菌致新生儿脑膜炎的临床特点分析[J].中国小儿急救医学,2015,22(3):177-179.
[12] 杨慧,冯晋兴,林素芳,等. 新生儿化脓性脑膜炎46例临床分析[J].神经病学与神经康复学杂志,2013,10(1) :18-21.
[13] 陶娜,王爱萍,吴玉芹.132例化脓性脑膜炎脑脊液分析[J].中国小儿急救医学,2013,20(5):507-508.
[14] 程春旭,杨立彬,张舒石,等. 应用布拉氏酵母菌预防儿童化脓性脑膜炎治疗中真菌感染的观察[J].中国妇幼保健,2013,28(27):4544-4546.
[15] 朱敏丽,麦菁芸,朱将虎,等. 大肠埃希菌致新生儿化脓性脑膜炎31例临床分析[J].中国当代儿科杂志,2012,14(12):910-912.
[16] Braun V, Eskens U, Hartmann A,etal. Focal bacterial meningitis following ascending bite wound infection leading to paraparesis in a captive California sea lion (Zalophus californianus) [J].J Zoo Wildl Med,2015,46(1):135-140.
[17] Narava S, Rajaram G, Ramadevi A,etal. Prevention of perinatal group B streptococcal infection: a review with an Indian perspective [J].Indian J Med Microbio,2014,32(1):6.
[18] Verani J R, Spina N L, Lyneield R,etal. Early-onset group B streptococcal disease in the United States: potential for further reduction [J]. Obstet Gynecol,2014,123(4):828-837.
[19] Funk Js,Swann 0,Molyneux E.Systematic review:neonatal men-ingitis in the developing world[J]. Trop Med Int Health,2011,16:672-679.
[20] Stevens JP,Eames M,Kent A.Long-term outcome of neonatal men-ingitis[J]. Arch Dis Child Fetal Neonatal Ed,2003,88:179-184.
