盆腔器官脱垂与COL3A1基因多态性的Meta分析
2018-03-28樊冬梅杨夏楠齐朋伟晋熙梦张蕾赵丹丹
樊冬梅 杨夏楠 齐朋伟 晋熙梦 张蕾 赵丹丹
(河南科技大学临床医学院·河南科技大学第一附属医院妇产科,河南 洛阳 471300)
盆腔器官脱垂[1-2]是由于盆底肌肉和筋膜组织薄弱造成的盆腔器官下降而引发的器官位置及功能异常,主要症状为阴道口组织物脱出,可伴有排尿、排便和性功能障碍,且近年来发病率有所提高,几乎影响了一半的女性[3-4]。但其病因和发病机理尚不明确[5]。目前认为,盆腔器官脱垂的发生与出生创伤、盆腔组织发育不良、退行性变化和长期腹压增加具有一定的相关性。一些学者通过研究已经证实,年龄、肥胖和家庭等[6-9]多个因素影响下可导致盆腔器官脱垂的发生。盆腔器官脱垂的发生与盆底支持组织结构功能性被破坏密切相关。盆底支持组织主要是一些韧带和筋膜[10-11],由平滑肌细胞、成纤维细胞基胶原构成,其中主韧带、宫骶韧带、肛提肌、阴道筋膜更是支撑子宫、膀胱、直肠的重要结构。其支持和稳定的功能主要取决于细胞外基质中不同类型纤维间的相互作用,主要包括胶原蛋白、蛋白聚糖、弹性蛋白、层粘连蛋白和纤连蛋白,但大部分是由胶原蛋白提供的。盆底组织主要由Ⅰ型和Ⅲ型胶原蛋白构成。Ⅰ型胶原蛋白与支持作用有关,而Ⅲ型胶原蛋白与组织的弹性有关。Ⅲ型胶原蛋白存在于皮肤、韧带、肌腱和骨,并有助于维持组织的弹性。Ⅲ型胶原蛋白α链的合成编码基因即COL3A1,位于2q24.3~q31染色体[12]。Tao H证实[13]了COL3A1可增加中国汉族颅内动脉瘤患者的易感性。那么,COL3A1与盆腔器官脱垂的发生是否具有相关性呢?Martins K de F[14]和 Lince SL[15]认为二者并无明显相关性。然而Chen H-Y[16],Jeon MJ[14]和 Kluivers KB[18]则持相反意见,认为二者具有相关性。本文旨在通过meta分析来探讨COL3A1基因的多态性与盆腔器官脱垂的发生是否具有相关性。
1 资料与方法
1.1 检索策略 通过检索各大数据库尽可能全面检索文献。时间从建库至2016年10月,语言为汉语和英语,国家不限。数据库包括PubMed、Medline、Embase、中国国家知识基础设施(CNKI)和万方。检索关键词如COL3A1、阴道穹窿脱垂等。
1.2 纳入标准 ①研究类型符合病例-对照研究。②研究内容:评价了COL3A1基因多态性与盆腔器官脱垂的相关性。③研究对象:病例组为临床确诊的盆腔器官脱垂患者,且临床分期为Ⅱ、Ⅲ-Ⅳ期,分期标准遵循Bump提出的盆腔器官脱垂定量分度法(pelvic organ prolapse quantitation,POP-Q)。对照组为健康人群或临床分期为I 期者。④文献一般资料齐全,数据完整,有病例组和对照组的观察人数或可计算出相关观察人数。⑤对照组基因型符合Hardy-Weinberg(H-W)遗传平衡定律。
1.3 排除标准 ①缺失重要研究数据的病例对照研究。②缺失主要结局指标数据的文献。③无可用信息的文献。④重复文献或重复数据的文献取资料最完整或最新发表的文献,排除其他文献。
1.4 方法学质量评价 对纳入文献,根据STREGA原则评价质量:①样本量是否充分。②诊断标准是否明确。③分组匹配情况如何。④对照组与病例组是否具有可比性,对照组基因型分布是否符合Hardy-Weinberg(H-W)遗传平衡定律。⑤基因检测方法是否合理。⑥数据是否充分等严格评价文献质量。以上6项,每满足一项记为1分,总分≥3分者,认为质量可靠。
1.5 文献筛选及资料提取 通过检索并筛选,本研究最终纳入5篇文献[12-16]。一般资料的提取包括第一作者、发表年份、国家、盆底器官脱垂诊断标准、病例数量、对照数量和基因型分布等,见表1~2。
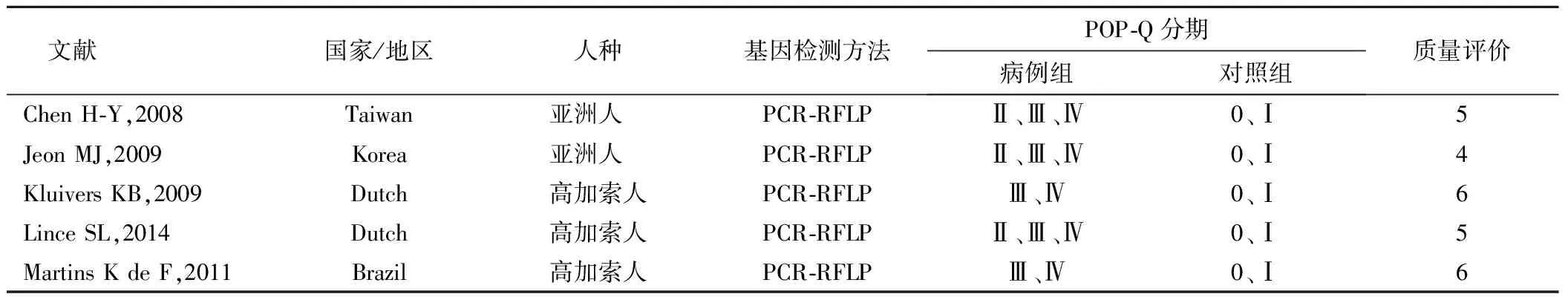
表1 纳入文献特征表Table1 The characteristics of included studies
注:H-W定律,当P>0.05,提示群体基因遗传平衡,样本来自同一蒙德尔群体

表2 纳入文献基因型分布情况(n)Table 2 The genotype distribution of included studies
1.6 统计学处理 采用RevMan 5.2软件进行Meta分析。利用OR值和95%CI来衡量发病风险的高低。采用I2检验合并数据的异质性,当I2≤ 50%,表明所合并数据异质性小,采用固定效应模型进行Meta分析;反之,当I2>50%,则采用随机模型。发表偏倚采用倒漏斗图进行检验。
2 结果
2.1 发表偏倚 经过RevMan5.2软件分析发现,杂合子模型(GA与GA+GG基因型比较)、隐性模型(AA与GA+AA基因型比较)的漏斗图分布基本对称,见图1、2,可认为无明显发表偏倚。
2.2 Meta分析结果
2.2.1GAvsGA+GG以GA+GG基因型为参照,统计个体携带GA基因型罹患盆腔器官脱垂的风险。由图3可知,I2=27%<50%,采用固定模型,OR=0.89,95%CI 0.69,1.14,P=0.37,可以认为GA基因型在病例组和对照组中频率分布差异无统计学意义。

图1 杂合子模型倒漏斗图Figure 1 The funnel figure of heterozygous model
2.2.2AAvsGA+AA 以GA+AA基因型为参照,统计个体携带AA基因型罹患盆腔器官脱垂的风险。由图4可知,I2=68%>50%,采用随机模型,OR=1.64,95%CI 0.54,4.95,P=0.38,可以认为,AA基因型在病例组和对照组中频率分布差异无统计学意义。
2.3 亚组分析 通过合并不同人种(亚洲人和高加索人)数据,经过meta分析结果发现,在高加索人中I2明显减小,可以降至零,见图5。
2.4 异质性分析 通过I2判断合并数据的异质性,在排除Jeon MJ 2009文献后合并数据的异质性明显下降,其中显性模型、单基因模型和杂合子模型的I2可降至零。可能是因为该文献样本量较少的原因(病例组36例,对照组36例)。
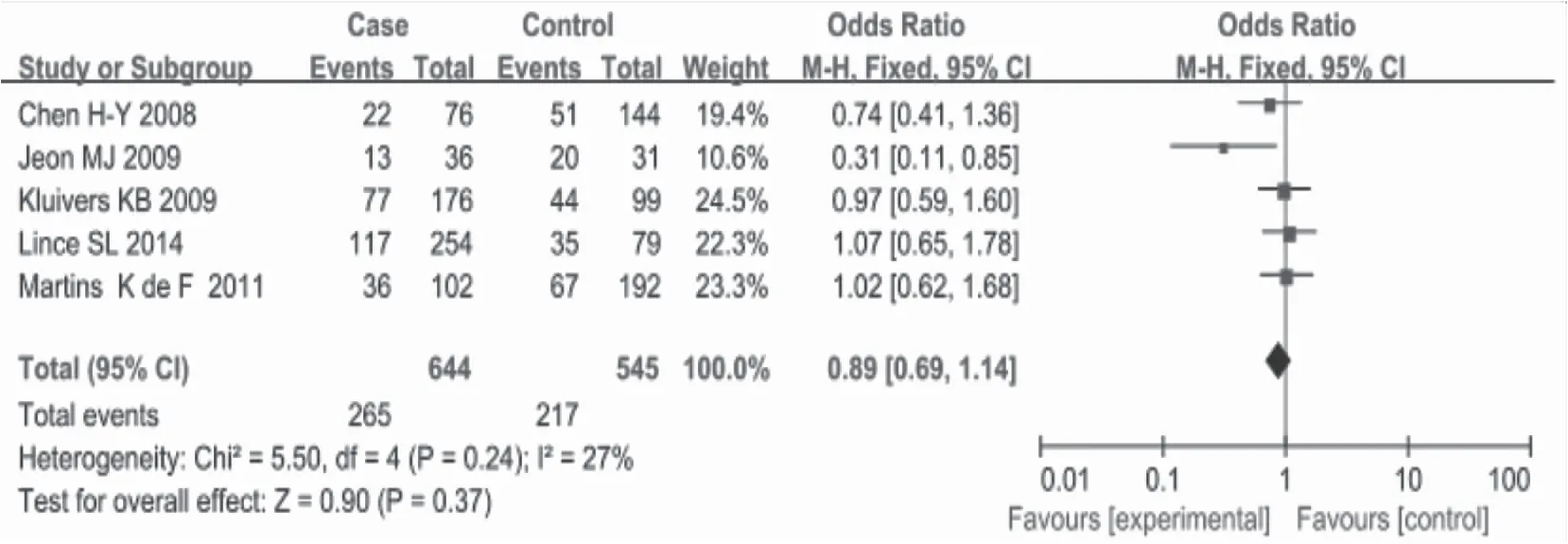
图3 杂合子模型与POP发生的危险性分析森林图Figure 3 The forest figure of risk analysis between heterozygous model and POP

图4 隐性模型与POP发生的危险性分析森林图Figure 4 The forest figure of risk analysis between recessive model and POP

图5 高加索人与POP发生的危险性分析森林图Figure 5 The forest figure of risk analysis between Caucasian and POP
3 讨论
盆腔器官脱垂[19]是一种由于各种原因引起的骨盆壁薄弱而导致盆腔器官从正常位置下移,进而引发盆腔脏器功能紊乱和障碍的疾病。近年来,盆底器官脱垂的发生率有所增加,越来越多的妇女受到疾病的困扰。目前该疾病的治疗主要通过盆底肌功能锻炼和手术,但其效果均不是很理想。如若可以明确该疾病的发生发展过程,从根本上治疗,将会给患者带来莫大的受益。目前认为肥胖[20-21]和分娩[22-23]是盆腔器官脱垂发生的危险因素。
盆腔器官脱垂的发生与骨盆底支持结构的完整性密切相关。而骨盆底的支持结构在很大程度上取决于细胞外基质胶原蛋白,其中胶原蛋白I型和Ⅲ型最普遍存在于该组织。Ⅲ型胶原蛋白主要维持肌肉的弹性,其较少后引起肌肉松弛。因此,本研究通过探讨其编码基因,即COL3A1的多态性与盆腔器官脱垂发生的相关性。
通过对1274例参与者(701例病例和573例对照)的基因型进行Meta分析,可知COL3A1基因多态性与盆腔器官脱垂的发生无明显相关性。但是由图2、3可知,区分不同人种合并后的数据异质性明显下降,提示盆腔器官脱垂的发生可能与种族有关。由于本研究的局限性:第一,语言限制为汉语和英语,可能存在选择性偏倚;第二,盆腔器官脱垂的分期诊断主要依靠医师的检查,而不同的医师其检查结果可能不同,特别是处于Ⅰ期和Ⅱ期的患者,这直接影响到参与者的分组情况,从而影响结果;第三,样本量较少。鉴于存在以上局限性,盆腔器官脱垂与COL3A1基因多态性的发病风险无明显相关性,但是可能与种族有关这一结论还需从基因-人种等方面开展更多、更大样本、更严谨的研究去验证,从而明确盆腔器官脱垂的发生发展,以期探寻新的靶点,为疾病的治疗提供更具有说服力的证据。
4 结论
本研究通过Meta分析探讨COL3A1基因多态性与盆腔器官脱垂发生易感性的相关性。结果显示,COL3A1基因多态性与盆腔器官脱垂的发生无明显相关,但盆腔器官脱垂的发生可能与种族有关。
[1]Bo K. Pelvic floor muscle training in treatment of female stress urinary incontinence, pelvic organ prolapse and sexual dysfunction [J]. World J Urol, 2012, 30(4): 437-443.
[2]Boyles S H, Weber A M, Meyn L. Procedures for pelvic organ prolapse in the United States, 1979-1997 [J]. Am J Obstet Gynecol, 2003, 188(1): 108-115.
[3]Nygaard I, Bradley C, Brandt D. Pelvic organ prolapse in older women: prevalence and risk factors [J]. Obstet Gynecol, 2004, 104(3): 489-497.
[4]Swift S E. The distribution of pelvic organ support in a population of female subjects seen for routine gynecologic health care [J]. Am J Obstet Gynecol, 2000, 183(2): 277-285.
[5]Schaffer J I, Wai C Y, Boreham M K. Etiology of pelvic organ prolapse [J]. Clin Obstet Gynecol, 2005, 48(3): 639-647.
[6]Buchsbaum G M, Duecy E E, Kerr L A,etal. Pelvic organ prolapse in nulliparous women and their parous sisters [J]. Obstet Gynecol, 2006, 108(6): 1388-1393.
[7]Chiaffarino F, Chatenoud L, Dindelli M,etal. Reproductive factors, family history, occupation and risk of urogenital prolapse [J]. Eur J Obstet Gynecol Reprod Biol, 1999, 82(1): 63-67.
[8]Mclennan M T, Harris J K, Kariuki B,etal. Family history as a risk factor for pelvic organ prolapse [J]. Int Urogynecol J Pelvic Floor Dysfunct, 2008, 19(8): 1063-1069.
[9]Tegerstedt G, Miedel A, Maehle-schmidt M,etal. Obstetric risk factors for symptomatic prolapse: a population-based approach [J]. Am J Obstet Gynecol, 2006, 194(1): 75-81.
[10] Swift S, Woodman P, O'boylf A,etal. Pelvic Organ Support Study (POSST): the distribution, clinical definition, and epidemiologic condition of pelvic organ support defects [J]. Am J Obstet Gynecol, 2005, 192(3): 795-806.
[11] Delancey J O. Anatomic aspects of vaginal eversion after hysterectomy [J]. Am J Obstet Gynecol, 1992, 166(6 Pt 1): 1717-24; discussion 24-28.
[12] Dalgleish R. The Human Collagen Mutation Database 1998 [J]. Nucleic Acids Res, 1998, 26(1): 253-255.
[13] Hua T, Zhang D, Zhao Y L,etal. Correlation of COL3A1 gene with type III collagen stability in intracranial aneurysm [J]. Zhonghua Yi Xue Za Zhi, 2008, 88(7): 445-448.
[14] Martins Kde F, De Jarmy-Dejarmy Z I, Da Fonseca A M,etal. Evaluation of demographic, clinical characteristics, and genetic polymorphism as risk factors for pelvic organ prolapse in Brazilian women [J]. Neurourol Urodyn, 2011, 30(7): 1325-1328.
[15] Lince S L, Van Kempen L C, Dijkstra J R,etal. Collagen type III alpha 1 polymorphism (rs1800255, COL3A1 2209 G>A) assessed with high-resolution melting analysis is not associated with pelvic organ prolapse in the Dutch population [J]. Int Urogynecol J, 2014, 25(9): 1237-1242.
[16] Chen H Y, Chung Y W, Lin W Y,etal. Collagen type 3 alpha 1 polymorphism and risk of pelvic organ prolapse [J]. Int J Gynaecol Obstet, 2008, 103(1): 55-58.
[17] Jeon M J, Chung S M, Choi J R,etal. The relationship between COL3A1 exon 31 polymorphism and pelvic organ prolapse [J]. J Urol, 2009, 181(3): 1213-1216.
[18] Kluivers K B, Dijkstra J R, Hendriks J C,etal. COL3A1 2209G>A is a predictor of pelvic organ prolapse [J]. Int Urogynecol J Pelvic Floor Dysfunct, 2009, 20(9): 1113-1118.
[19] Jelovsek J E, Maher C, Barber M D. Pelvic organ prolapse [J]. Lancet, 2007, 369(9566): 1027-1038.
[20] Kudish B I, Iglesia C B, Sokol R J,etal. Effect of weight change on natural history of pelvic organ prolapse [J]. Obstet Gynecol, 2009, 113(1): 81-88.
[21] Bradley C S, Zimmerman M B, Qi Y,etal. Natural history of pelvic organ prolapse in postmenopausal women [J]. Obstet Gynecol, 2007, 109(4): 848-554.
[22] Henrix S L, Clark A, Nygaard I,etal. Pelvic organ prolapse in the Women's Health Initiative: gravity and gravidity [J]. Am J Obstet Gynecol, 2002, 186(6): 1160-1166.
[23] Yeniel A O, Ergenoglu A M, Askar N,etal. How do delivery mode and parity affect pelvic organ prolapse [J]. Acta Obstet Gynecol Scand, 2013, 92(7): 847-851.
