缺血后处理结合PCI对急性心肌梗死患者心率震荡的保护作用*
2018-03-28周珏珉罗贵全禹丽杨雨衡
周珏珉 罗贵全 禹丽 杨雨衡
(遂宁市中心医院 心电图室,四川 遂宁629000)
急性心肌梗死(acute myocardial infarction, AMI)为临床中最常见、猝死率最高的疾病,而且我国发病率近年显著增高[1]。近年关于心肌细胞缺血的保护性研究已由缺血预处理转为更为接近临床的缺血后处理,是指心肌细胞在长时间缺血后, 于再灌注前或再灌注开始的几分钟内通过模拟内源性心脏保护作用机制而发挥保护效果,主要针对缺血再灌注损伤,抑制再灌注时氧自由基的堆积和炎症因子大量产生及释放,为缺血后处理的主要作用机制[2]。经皮冠状动脉介入治疗(Percutaneous coronary intervention,PCI)目前是临床中治疗心肌梗死最有效的方法,但同时也可导致再灌注损伤。那么能否将PCI与缺血后处理相结合从而达到保护心肌细胞的作用呢?目前已有少量相关研究表明,PCI结合缺血后处理对心肌细胞存在保护作用[3],但是具体机制有待进一步研究。目前对于缺血后处理对心肌细胞保护作用主要集中于药物后处理的研究[4]。
窦性心率震荡(heart rate turbulence,HRT)为Sehimdt G等[5-7]提出的一项预测缺血性心肌病,特别是急性心肌梗死后长期预后的新指标,其精确性及有效性都已得到认可。HRT是反映人体自主神经功能是否正常的电生理学指标之一,目前研究认为其可作为预测急性心肌梗死、慢性心力衰竭等心肌损伤猝死风险的无创性监测指标,已成为近年来心脏及心肌细胞病理生理学机制的研究热点。目前关于HRT用于评价PCI结合缺血后处理保护心肌细胞的研究报道极少,尤其未见其相关机制研究。本研究拟通过HRT评估PCI结合缺血后处理对心肌细胞的保护作用,并试图揭示其保护自主神经的具体机制。
1 资料与方法
1.1 一般资料 选择2014年1月~2016年1月在我院经冠脉造影证实的AMI患者100例,男56例,女44例,年龄42~84岁,平均(65.7±12.2)岁。纳入标准:①持续胸痛≥30 min,至少2个相邻胸导联ST段上抬≥0.2 mV或肢导联ST段上抬≧0.1 mV。②急诊冠状动脉造影证实为100%急性闭塞病变。③胸痛开始时间至冠脉内球囊扩张时间<12 h。④知情同意。排除标准:①陈旧性心肌梗死。②伴有感染、全身免疫性疾病、结缔组织疾病及近期使用抗炎、溶栓等药物治疗。急诊介入前后用药参照有关指南[8]。
1.2 动态心电图数据采集 使用12导联动态心电图(深圳博英 BI9100)进行24h监测,测量并计算HRT各项指标。冠脉造影使用血管造影机(西门子,Artis zee ceiling)Judkins法选择性冠状动脉造影。常规PCI 组(A组)标准方法行PCI;缺血后处理组(B组)在常规PCI 组的基础上,于梗死动脉再通后前5min内,冠状动脉病变处应用低气压充盈和回撤球囊,每次循环60 s,共循环4次。两组均在治疗前和治疗后12、24、48h及7d行24h动态心电监测,并计算HRT各项指标。HRT:人工剔除伪差以及干扰,选取动态心电图记录中有室性期前收缩的部分,且至少有3个窦性心律,室性期前收缩后至少有20个窦性心律。用计算机测量并计算反映HRT震荡初始(TO)、震荡斜率(TS)值。
1.3 ELISA法检测血清IL-6、IL-8、hs-CRP及TNF-α含量 所有AMI 患者分别于PCI前及后12、24、48h及7d抽取静脉血3~5 ml,保存于预先加入抗凝剂(乙二胺四乙酸,EDTA)及抑肽酶试管,然后快速加入高速冷冻离心机中3 000r /min 离心15 min,获得血清,保存于-70℃冰箱集,避免反复冻溶。使用ELISA检测100例患者血清IL-6、IL-8、hs-CRP及TNF-α含量,按操作说明进行测定(Sigma公司,美国),酶标仪MODEL-550(Bio-Rad公司,美国)。

2 结果
2.1 一般情况 两组性别、年龄、高血压、糖尿病、吸烟及总胆固醇分布差异无统计学意义(P>0. 05),提示常规组与后处理组具有可比性,见表1。
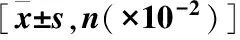
表1 后处理组与常规组基本特征比较Table 1 Essential features of control group and regular group
2.2 两组PCI术前后TO、TS值比较 后处理组与常规组比较,TO值在术后24h差异有统计学意义(P<0.05),而TS值在术后24h及7d时差异均有统计学意义(P<0.05);TO值术后与术前相比呈下降趋势,而TS为上升趋势,见图1。
2.3 两组PCI术前后IL-6、hs-CRP、TNF-α及IL-8变化情况 与常规组相比,后处理组IL-6术后24h含量最高值较低(P<0.05),整体呈现较低趋势,术后7d含量已低于术前。术后24h hs-CRP已经达到最高峰,术后7d时两组差异无统计学意义(P>0.05)。而IL-8、TNF-α均呈先增加后减少的趋势,但与常规组相比, 后处理组TNF-α值较IL-8低, 48h时差异已无统计学意义(P>0.05),见图2。

图1 心率震荡随时间变化情况 Figure 1 The change of HRT with time
图2 两组PCI术前后 IL-6、hs-CR P、IL-8和TNF-α的含量变化情况Figure 2 A, B, C, and D diagrams for IL-6, hs-CRP, IL-8, and TNF-alpha注:A、B、C及D分别为 IL-6、hs-CR P、IL-8和TNF-α的含量变化,与常规组相比,①P<0.05
3 讨论
AMI是一种多因素相关的、以冠状动脉狭窄诱发严重的心肌缺血而发生心肌细胞急性坏死的疾病。随着急诊PCI的广泛开展,已极大地降低了AMI的病死率,但常伴发术后严重的并发症,最终影响患者的生活质量,甚至远期寿命。那么能否减少其并发症,究竟是什么原因导致的预后欠佳呢?研究表明,在PCI时发生了心肌细胞缺血再灌注损伤,这是一种复杂的病理生理过程,心肌梗死面积中约50%是由这类损伤引起。赵志青等[9-10]发现,心肌细胞缺血后处理在动物体内能减少约44%的心肌梗死面积,并减少心肌细胞水肿、嗜中性粒细胞聚集和细胞凋亡,改善内皮细胞而提出缺血后处理的概念。
HRT是窦房结对室性早搏的一种双向生理反应,也就是一次短的初期心率加速和随后发生的心率减慢,自主神经功能完好时这种短时间的变化以心率震荡的形式体现,而自主神经功能受损时这种变化会明显减弱或消失,HRT可通过TO及TS进行定量表达[11]。以往研究表明,自主神经的调节功能与心脏功能及心肌细胞的活性相关:交感神经兴奋,心肌细胞活性降低,电稳定性下降,容易发生恶性室性心律失常,心脏功能差;而副交感神经张力高时,心肌细胞活性较好,电稳定性提高,恶性室性心律失常发生率下降,心脏功能较好[12]。冠状动脉血供急剧减少或中断使心肌缺血、缺氧而损伤或坏死,心肌细胞内各种感受器也随之受损,心脏自主神经传导系统功能异常,紧张性的冲动超过正常,自主神经平衡被打破,窦性心率震荡现象减弱或消失[13]。而PCI术后心肌得到再灌注,使感受器敏感性恢复,TO及TS明显改善。HRT目前已为评价心肌梗死预后的一个指标。本研究表明,缺血后处理在PCI术中确实能减少对心肌细胞的损伤。后处理组与常规组比,TO在术后24h有统计学差异,TS在术后24h及7d时均有统计学差异;TO术后与术前相比呈下降趋势,而TS为上升趋势。TO在术后7d时无统计学差异,但TS在术后7d时较B组高。因此可以认为,缺血后处理在PCI术中确实可以起到保护HRT的作用,也就是缺血后处理能有效保护心肌自主神经的调节功能。
那么,PCI术中缺血后处理是通过什么机制起到保护心肌自主神经调节功能的呢?本研究缺血后处理组中炎症因子较常规PCI组明显减少。炎症反应在AMI的发生、发展、转归及PCI开通冠状动脉中的作用日益受到重视,而PCI时使缺血心肌再灌注引发一系列不良事件而导致比缺血损伤更严重的心肌损伤,其损伤可能与炎症因子的大量释放有密切关系[14]。本研究中IL-6、hs-CRP、IL-8和TNF-α术前及术后含量变化总体呈现为先增加后下降趋势。与 常规组相比,后处理组术后24h含量最高值较低(P<0.05),整体呈现较低趋势,术后7d时含量已低于术前。hs-CRP术后24h已达到最高峰,术后7d时两组无统计学差异(P>0.05)。IL-8及TNF-α均呈先增加后减少的趋势,但与常规组相比,后处理组TNF-α增加相对较IL-8低,TNF-α在术后48h时已无统计学差异(P>0.05)。
TNF-α、IL-6在正常心肌组织无表达或偶有表达,慢性应激后心肌组织中表达明显增强,可能会导致心肌细胞的病理损伤[24]。心肌梗死损伤的调控可能与释放炎症因子IL-1β与TNF-α,进而通过中枢神经元纤维投射调控外周炎性因子释放量增多,促进神经元敏化,进一步影响心功能[25]。TNF-α通过TNF-α及ICAM-mRNA调节炎性反应的程度,TNF-α浓度升高本身加剧炎症反应程度,致心脏循环功能障碍,进而扩大心肌梗死面积,降低心功能;TNF-α改变内皮细胞基因表达,激活内皮细胞产生其他炎症介质[15-16]。本研究中后处理组TNF-α含量较低,可能通过以上两个方面的机制导致炎性反应程度较常规组明显减轻。hs-CRP是AMI 较好的炎性监测标志物, AMI 患者明显升高,且hs-CRP处于持续高水平的AMI 患者,其炎症细胞对于多种潜在刺激的反应性增强[17]。本研究中常规组hs-CRP在术后早期(48h)持续处于高水平状态,其可能通过激活免疫系统,诱导各种免疫细胞向心肌细胞周围聚集,分泌各种细胞因子,如TNF- 及IL-6(两者A组均高于B组)等,细胞因子直接抑制心肌收缩力或者损坏心肌细胞,参与心室重构[18-20]。以往的研究也支持本研究结果,IL-6为循环中的细胞因子,在急性心肌梗死时血清水平出现反应性升高[21]。
Blankenberg等[22-23]发现,IL-8是预测未来发生致死性心血管事件的独立因子,急性心肌梗死时 IL-8水平明显升高。研究表明,hs-CRP与心肌梗死患者HRT的所有参数呈负相关,是自主神经功能损害的最强预测因素。也就是说,PCI术中缺血后处理通过减少IL-6、hs-CRP、IL-8和TNF-α的产生,炎症因子通过减少自身和相互作用两个方面的机制,减少其对心肌细胞和自主神经的损伤,尤其是术后早期,进而起到保护心肌自主神经的调节功能,呈现为HRT受到保护。
4 结论
PCI术中结合缺血后处理通过减少IL-6、hs-CRP、IL-8和TNF-α的产生,减少自身和相互作用,从而减少其对心肌细胞和自主神经的损伤,进而起到保护心肌自主神经调节功能。
[1]Wang L, Zhou Y, Qian C,etal. Clinical characteristics and improvement of the guideline-based management of acute myocardial infarction in China: a national retrospective analysis[J]. Oncotarget, 2017,8(28):46540-46548.
[2]Gao X, Liu Y, XieY,etal. Remote ischemic postconditioning confers neuroprotective effects via inhibition of the BID-mediated mitochondrial apoptotic pathway[J]. Mol Med Rep, 2017,16(1):515-522.
[3]Ekstrom K, Dalsgaard M, Iversen K,etal. Effects of liraglutide and ischemic postconditioning on myocardial salvage after I/R injury in pigs[J]. ScandCardiovasc J, 2017, 51(1): 8-14.
[4]Araszkiewicz A, Grygier M, Pyda M,etal. Postconditioning attenuates early ventricular arrhythmias in patients with high-risk ST-segment elevation myocardial infarction[J]. J Cardiol, 2015, 65(6): 459-65.
[5]Bauer A, Zurn CS, andSchmidt G. Heart rate turbulence to guide treatment for prevention of sudden death[J]. CardiovascPharmacol, 2010, 55(6): 531-538.
[6]KudrynskiK, Strumillo P, and Ruta J. Computer software tool for heart rate variability (HRV), T-wave alternans (TWA) and heart rate turbulence (HRT) analysis from ECGs[J]. Med SciMonit, 2011, 17(9): MT63-71.
[7]VerrierRL, Schmidt G. Independent and complementary utility of ambulatory electrocardiogram-based T-wave alternans and heart rate turbulence for predicting major cardiac events in patients after myocardial infarction[J]. Circ J, 2013, 77(4): 1084-1085.
[8]中华医学会心血管病学分会编写. 急性ST段抬高型心肌梗死诊断和治疗指南[J]. 中华心血管病杂志, 2015,43(5):380-393.
[9]Kerendi F, Kin H, Halkos ME,etal. Remote postconditioning. Brief renal ischemia and reperfusion applied before coronary artery reperfusion reduces myocardial infarct size via endogenous activation of adenosine receptors[J]. Basic Res Cardiol, 2005, 100(5): 404-412.
[10] Zhao, ZQ. Postconditioning in reperfusion injury: a status report[J]. Cardiovasc Drugs Ther, 2010,24(3):265-279.
[11] 刘茜,时晓迟. 心率震荡的相关研究及进展[J]. 中华老年心脑血管病杂志, 2016,18(9):999-1002.
[12] 李晓君,柳丽萍,杨淑英. PCI对急性心肌梗死患者窦性心率震荡及QT离散度的影响[J]. 江苏实用心电学杂志, 2011,20(2):121-123.
[13] Tuomainen P, Hartikainen J, Vanninen E,etal. Warm-up phenomenon and cardiac autonomic control in patients with coronary artery disease[J]. Life Sci, 2005, 76(19): 2147-2158.
[14] Diepenhorst GM, Ciurana CL, Diaz Padilla N,etal. IgM antibodies against apoptotic cells and phosphorylcholine in patients with acute myocardial infarction in relation to infarct size and inflammatory response[J]. Adv Clin Exp Med, 2012, 21(4): 455-467.
[15] Kacimi R, Karliner JS, Koudssi F,etal. Expression and regulation of adhesion molecules in cardiac cells by cytokines: response to acute hypoxia[J]. Circ Res, 1998, 82(5): 576-586.
[16] Moreira DM, da Silva RL, Vieira JL,etal. Role of vascular inflammation in coronary artery disease: potential of anti-inflammatory drugs in the prevention of atherothrombosis. Inflammation and anti-inflammatory drugs in coronary artery disease[J]. Am J Cardiovasc Drugs, 2015, 15(1): 1-11.
[17] 龚国忠,刘友迎,黄刚动态监测hs-CRP和NT-proBNP对急性心肌梗死的临床意义[J]. 国际检验医学杂志, 2013, 34(8):930-933.
[18] van Vuren EJ, Malan L, von Kanel R,etal. Hyperpulsatile pressure, systemic inflammation and cardiac stress are associated with cardiac wall remodeling in an African male cohort: the SABPA study[J]. Hypertens Res, 2016, 39(9): 648-653.
[19] Heinzmann D, Bangert A, Muller AM,etal. The Novel Extracellular Cyclophilin A (CyPA)-Inhibitor MM284 Reduces Myocardial Inflammation and Remodeling in a Mouse Model of Troponin I-Induced Myocarditis[J]. PLoS One, 2015, 10(4): e0124606.
[20] Uryash A, Bassuk J, Kurlansky P,etal. Non-invasive technology that improves cardiac function after experimental myocardial infarction: Whole Body Periodic Acceleration (pGz) [J]. PLoS One, 2015, 10(3): e0121069.
[21] Cen W, Chen Z, Gu N,etal. Prevention of AMI Induced Ventricular Remodeling: Inhibitory Effects of Heart-Protecting Musk Pill on IL-6 and TNF-Alpha[J]. Evid Based Complement Alternat Med, 2017, 2017: 3217395.
[22] Blankenberg S, Luc G, Ducimetiere P,etal. Interleukin-18 and the risk of coronary heart disease in European men: the Prospective Epidemiological Study of Myocardial Infarction (PRIME) [J]. Circulation, 2003, 108(20): 2453-2459.
[23] Zeller T, Haase T, Muller C,etal. Molecular Characterization of the NLRC4 Expression in Relation to Interleukin-18 Levels[J]. Circ Cardiovasc Genet, 2015, 8(5): 717-726.
[24] 徐艳秋.慢性应激大鼠血清TNF-α、IL-6的变化及其在心肌组织中的表达[D].蚌埠医学院,2010:1-35.
[25] 杜东书.下丘脑室旁核P2X7受体对大鼠急性心肌梗死损伤的调控作用及其分子机制研究[D].复旦大学,2013:1-89.
