NLRP3-ASC-Caspase-1-IL-18/IL-1β-TGF-β信号通路与Ⅱ型糖尿病临床相关性研究*
2018-03-28胡龙江周音频曹运兰吕湛蓝运竞宁琳向立权肖鹏
胡龙江 周音频 曹运兰 吕湛 蓝运竞 宁琳 向立权 肖鹏
(1.重庆市涪陵中心医院心血管内科,重庆 涪陵 408000;2.贵州省人民医院心血管内科,贵州 贵阳 550002;3.川北医学院附属医院心血管内科,四川 南充 637000)
目前,Ⅱ型糖尿病(type 2 diabetes mellitus, T2DM)已成为全球化的流行性疾病,其慢性进行性病程及产生的多种急慢性并发症,严重影响着患者的生活质量。最近流行病学调查显示,我国T2DM的患病率已达9.7%,糖尿病前期人群已达15.5%。因此,阐明T2DM的发病机制、开发新的有效防治方法是目前医学界亟待解决的难题和热点。最近研究证实,T2DM的发生与机体固有免疫系统介导的炎症反应密切相关,T2DM的免疫防治作为新兴治疗途径而备受关注。NLRP3炎性小体能感受代谢性应激信号的刺激,从而导致caspase-1活化及一系列炎性因子的产生,与T2DM的发生发展密切相关,而当机体炎性因子如白介素-1β(IL-1β)、白介素-18(IL-18)增加时,机体的抗炎因子如转化生长因子(transfor-ming growth factor-β,TGF-β)亦会发生变化。本文就以核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-bmding oligomerization domain-like receptor protein3,NLRP3)炎性小体为中心的NLRP3-ASC-Caspase-1-IL-18/IL-1β-TGF-β信号通路在T2DM发生发展过程中的作用进行探讨。
1 资料与方法
1.1 临床资料 2016年3月~2017年3月,在我院健康体检中心收集健康对照组30例,内分泌科收集T2DM组40例,年龄30~80岁,对照组符合肝心肾肺检查均正常,排除T2DM(诊断依据为1999年WHO制定的糖尿病诊断分型标准)、急性和慢性感染性疾病、肿瘤、自身免疫性疾病、痛风、近期创伤、正在使用抗炎药物者及其他代谢性疾病,排除家族中有传染病及遗传病史者。T2DM组符合患初诊T2DM(诊断依据同上),未使用降糖、降脂药物治疗者,亦未正规采用饮食及运动疗法者,排除1型糖尿病(在30岁以前诊断为糖尿病并使用胰岛素治疗)、内分泌相关糖尿病及T2DM合并急性并发症(如糖尿病酮症酸中毒、糖尿病乳酸酸中毒)、严重慢性并发症(如心肝肾功能不全、急性和慢性感染性疾病、肿瘤、自身免疫性疾病、痛风)和近期创伤、正在使用抗炎药物者以及其他代谢性疾病者。所有操作程序由涪陵中心医院伦理委员会批准,入选对象均对本研究内容知晓并签署知情同意书。
1.2 主要仪器及试剂 Step One Plus 荧光定量PCR测定仪(新加坡ABI公司),PTC-2000PCR测定仪(美国MJR公司),Neofuge1600R台式高速冷冻离心机(香港力康科技有限公司),AllegraTM64R高速台式离心机(美国BECKMAN公司),LAS 4000mini 凝胶成像系统(美国GE公司),NANODROP2000超微量紫外分光光度计(美国Thermo公司),电泳装置(美国Bio-rad公司),酶标仪(美国Emax公司),HB-100恒温金属浴(杭州博日科技有限公司),隔水式电热恒温培养箱(重庆帝凡商贸);人淋巴细胞分离液由北京达科为生物技术有限公司提供,PrimeScriptTMRT reagent Kit、RNAiso plus试剂盒、SYBR Premix Ex TaqTMII荧光定量试剂盒均由Takara公司提供,Anti-NLRP3 antibody、Anti-TMS1 antibody、Anti-Caspase-1 antibody均由abcam公司提供,western及IP细胞裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒、SDS-PAGE蛋白上样缓冲液均由上海碧云天生物有限公司提供,人IL-1β、IL-18、TGF-β ELISA试剂盒均由上海广锐生物科技有限公司提供。
1.3 实验方法
1.3.1 基本资料及临床生化资料采集 收集所有研究对象的性别、年龄、吸烟史、血压、身高、体重等基本资料,并计算出平均动脉压(mean arterial pressure,MAP)、体重指数(body mass index,BMI),所有研究对象均隔夜空腹8h以上,次日清晨空腹抽取肘静脉血20ml,取2ml全血离心获得血浆后置-80℃冰箱备用。剩余全血应用人淋巴细胞分离液,采用Ficoll-Hypaque密度梯度分离法分离出T2DM组和对照组人PBMCs备用,操作严格按试剂盒说明书进行。在我院检验科检测所有入选对象的FPG、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDLC)、低密度脂蛋的胆固醇(Low density liporotein cholesterol, LDLC)、极低密度脂蛋白胆固醇(very low density lipoprotein cholesterol,VLDLC)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)等生化资料。
1.3.2 RNA提取及逆转录 应用RNAiso plus试剂盒提取人PBMCs总RNA,操作严格按试剂盒说明书进行,采用分光光度仪测定RNA浓度及纯度,均符合要求后,利用PrimeScriptTMRT reagent Kit进行逆转录反应,合成cDNA,操作严格按试剂盒说明书进行。引物序列见表1,由Takara公司合成。

表1 引物序列Table 1 Primer sequences
1.3.3 RT-qPCR反应 应用SYBR Premix Ex TaqTMII荧光定量试剂盒进行实时定量PCR反应,反应体系按照说明书配制,反应条件为95℃ 30s,95℃ 5s,60℃ 30s,50个循环。反应结束后,作扩增及溶解曲线,每个样本均设置3个复孔,取均值统计数据,采用Ct值计算目的基因的相对表达量:△△Ct=(CtT2DM组-CtGAPDH)-(Ct对照组-CtGAPDH),病例组目的基因mRNA的相对表达量= 2-△△Ct。
1.3.4 Western blot 按照western及IP细胞裂解液说明书操作提取人PBMCs总蛋白,并采用BCA法测定蛋白浓度。取40μg蛋白进行8%SDS-PAGE凝胶电泳(条件:80V 30min,100V 60min),裁剪适合宽度的PDVF膜,甲醛浸泡15s,转膜60min,BSA封闭液室温封闭4h,浸入含蛋白NLRP3(1:100)、ASC(1:1000),Caspase-1(2.5μg/ml)、内参蛋白GAPDH(1:500)的一抗稀释液中, 4℃孵育过夜,次日TBST缓冲液洗膜5min,5次,加入辣根过氧化物酶标记的二抗(1:5000),室温孵育1h,TBST缓冲液洗膜5min(6次,凝胶成像分析系统扫描蛋白条带,蛋白相对表达量=目的蛋白/内参蛋白GAPDH。实验重复3 次,取均值统计数据。
1.3.5 ELISA检测 采用人IL-1β、IL-18、TGF-β ELISA试剂盒,严格参照说明书操作,反应终止后,酶标仪测定450nm处的吸光度值(OD值),根据试剂盒提供的标准品浓度及测定的OD值作标准曲线,计算各组血浆样本浓度,每个血浆样本均设置2个复孔,取均值统计数据。

2 结果
2.1 两组基本情况及血脂、血糖水平变化比较 两组性别、年龄、吸烟、MAP、TC、LDLC无显著性差异(均P>0.05);T2DM组BMI、FPG、HbA1c、TG、VLDLC高于对照组,HDLC低于对照组,差异均有统计学意义(P<0.05),见表2。

Table2Comparisonoftheplasmalevelsofglucose,lipoproteinsandgeneraldata
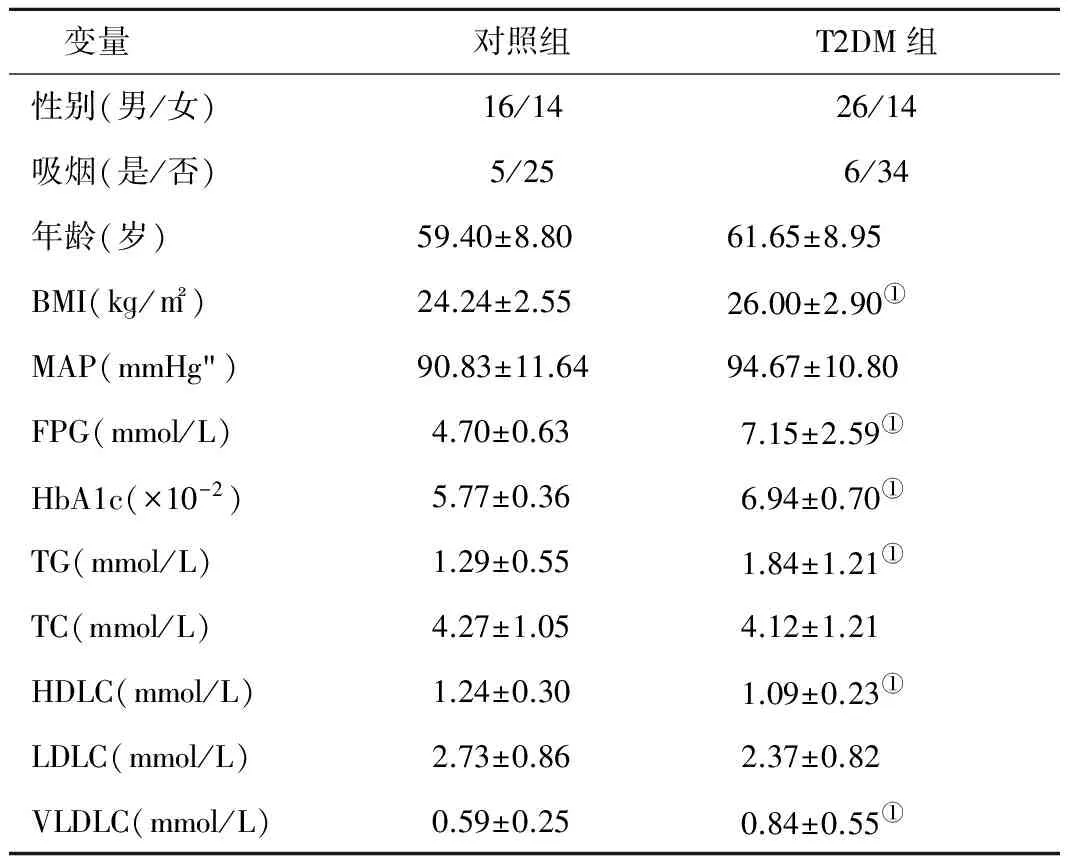
变量对照组T2DM组性别(男/女)16/1426/14吸烟(是/否)5/256/34年龄(岁)59.40±8.8061.65±8.95BMI(kg/m2)24.24±2.5526.00±2.90①MAP(mmHg")90.83±11.6494.67±10.80FPG(mmol/L)4.70±0.637.15±2.59①HbA1c(×10-2)5.77±0.366.94±0.70①TG(mmol/L)1.29±0.551.84±1.21①TC(mmol/L)4.27±1.054.12±1.21HDLC(mmol/L)1.24±0.301.09±0.23①LDLC(mmol/L)2.73±0.862.37±0.82VLDLC(mmol/L)0.59±0.250.84±0.55①
注:与对照组比较,①P<0.05
2.2 两组血浆IL-1β、IL-18、TGF-β水平变化比较 T2DM组IL-1β、IL-18、TGF-β高于对照组,差异均有统计学意义(P<0.05),见表3。
2.3 两组NLRP3、ASC、Caspase-1 mRNA水平比较 两组NLRP3、ASC、Caspase-1 mRNA水平在PBMCs中的表达差异均无统计学意义(P>0.05),见图1。

Table3ComparisonoftheplasmalevelsofIL-1β,IL-18andTGF-βbetweenT2DMgroupandcontrolgroup

变 量对照组T2DM组IL⁃1β(ng/L)IL⁃18(ng/L)TGF⁃β(ng/L)12 53±2 7950 02±10 181538 33±262 1922 86±1 66①144 14±14 20①2131 38±302 10①
注:与对照组比较,①P<0.05
2.4 两组NLRP3、ASC、Caspase-1水平比较 T2DM组NLRP3、ASC、Caspase-1 在PBMCs中的表达均较对照组增高,差异均有统计学意义(P<0.05),见图2、3。
2.5 两组NLRP3、ASC、Caspase-1mRNA水平与各变量的Spearman相关性分析 结果显示,NLRP3mRNA在对照组、T2DM组均无相关性;ASCmRNA在对照组无相关性,在T2DM组与TC呈正相关,相关系数为0.466(P=0.038);Caspase-1mRNA在对照组与FPG呈正相关,相关系数为0.394(P=0.031),在T2DM组与BMI呈正相关,相关系数为0.463(P=0.040)。
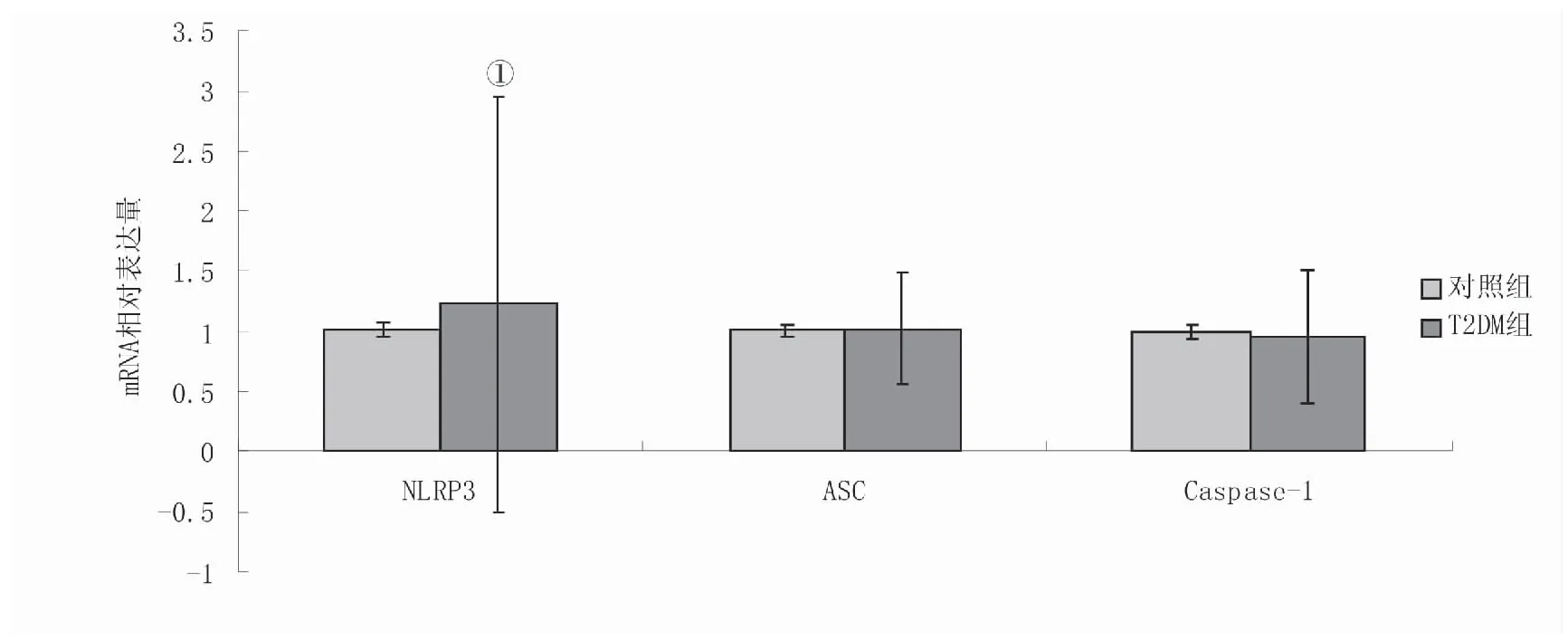
图1 两组NLRP3、ASC、Caspase-1 mRNA水平比较Figure 1 Expression of NLRP3, ASC and Caspase-1mRNA in T2DM group and control group注:与对照组比较,①P<0.05
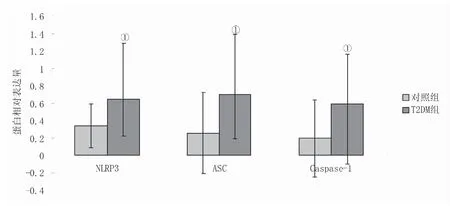
图2 两组NLRP3、ASC、Caspase-1水平比较Figure 2 Expression of NLRP3, ASC and Caspase-1 in T2DM group and control group注:与对照组比较,①P<0.05
2.6 两组NLRP3、ASC、Caspase-1与各变量的Spearman相关性分析 结果显示,NLRP3在对照组与性别呈正相关,相关系数为0.429(P=0.020),在T2DM组无相关性;ASC在对照组与FPG呈正相关,相关系数为0.405(P=0.026),在T2DM组与MAP、FPG、TC、IL-1β、IL-18呈正相关,相关系数分别为0.465(P=0.039)、0.626(P=0.003)、0.564(P=0.010)、0.502(P=0.024)和0.480(P=0.032);Caspase-1在对照组与MAP、FPG呈正相关,相关系数分别为0.447(P=0.013)、0.396(P=0.030),在T2DM组与吸烟、FPG、LDLC 、IL-1β呈正相关,相关系数分别为0.546(P=0.013)、0.585(P=0.007)、0.662(P=0.010)和0.624(P=0.003)。

图3 两组Western blot检测结果
Figure3ResultsofWesternblotinT2DMgroupandcontrolgroup
2.7 IL-1β、IL-18、TGF-β之间Spearman相关性分析 结果显示,IL-1β在T2DM组与TGF-β呈正相关,相关系数为0.564(P=0.010),3者之间在对照组无相关性。
3 讨论
T2DM是一种由胰岛β细胞受损分泌胰岛素减少和胰岛素抵抗导致的慢性炎性疾病,但T2DM 发病机制目前尚不完全清楚。近年来,随着固有免疫研究的迅速进展,有关固有免疫细胞炎性途径介导的炎症反应在自身免疫炎症性疾病中的作用越来越受到关注。NLRP3炎性小体是由NLRP3、ASC和无活性的caspase-1前体(pro-caspase-1)组成的多蛋白复合体,是机体固有免疫系统的一员,是炎性免疫反应的重要组成部分,是炎症-免疫的桥梁。其活化需要NLRP3氨基端热蛋白结构域(pyrin domain,PYD),通过PYD-PYD 之间的相互作用结合ASC,再由ASC 通过CARD-CARD之间相互作用招募无活性的pro-caspase-1,最后炎症小体生成,并对caspase-1进行自身激活,活化后的caspase-1 将对pro-IL-1β、pro-IL-18等底物进行切割,以促进炎性因子IL-1β 和IL-18 的成熟及分泌[1-3]。
IL-18是活化的单核巨噬细胞分泌的一种前炎症因子,在T2DM的发生发展过程中起中心介质作用,在T2DM前期即出现升高,可作为T2DM发生、病情变化及预后的预测因子,并且与T2DM心血管并发症有关[4],是T2DM并发心血管事件的一个预测因子。IL-1β是NLRP3炎性小体活化后产生的主要炎性分子。正常情况下,短暂的血糖水平升高引起急性、低剂量IL-1β产生,刺激胰岛β细胞增殖和胰岛素分泌,抑制食欲,减少摄食,从而维持外周血糖水平的稳定[5]。但是在慢性高血糖状态下,T2DM患者体内IL-1β持续升高,其受体表达上调,一方面 IL-1β可引起β 细胞凋亡,其功能衰退及胰岛素抵抗[6-7];另一方面,IL-1β 和其他炎性因子如肿瘤坏死因子(tumor necrosis factor,TNF)等协同干扰体内葡萄糖代谢平衡[8]。因此,IL-1β在T2DM 的发生发展中起着重要作用[9],被认为是T2DM的重要驱动者。而糖代谢紊乱作为危险信号进一步激活IL-1β 的平台NLRP3 炎性小体。TGF-β是一类蛋白质超家族,在机体通过抑制白细胞的募集,降低巨噬细胞的功能[10],减少单核巨噬细胞的趋化聚集,维持外周调节T细胞的作用,抑制T细胞向Th1和Th2增殖、激活和分化[11]等机制抑制炎性反应。但其过度表达,将会促进T2DM并发症的发生发展,其机制包括促进细胞外基质成分的合成与积聚,抑制细胞外基质的降解[12-13],促进平滑肌细胞的增生、迁移、分化[13-14],诱导血管重构[12-13],刺激内皮细胞合成纤溶酶原激活物抑制剂(plasminogen activator inhibitors, PAI)等细胞因子而促进血栓形成[13],促纤维化作用增加纤维帽厚度等。
本研究显示,初诊T2DM 患者血浆中的炎性因子IL-1β、IL-18 和抗炎因子TGF-β水平显著高于对照组,提示T2DM患者存在慢性炎症反应;初诊T2DM 患者PBMCs中NLRP3、ASC、Caspase-1mRNA的表达与对照组比较无显著性差异,但ASCmRNA及 Caspase-1mRNA在T2DM组分别与TC、BMI呈正相关,提示虽然T2DM患者NLRP3炎性小体在转录水平的表达无显著性增加,但T2DM患者的血脂代谢异常、肥胖因素已经存在促进NLRP3炎性小体表达的倾向;初诊T2DM 患者PBMCs中NLRP3、ASC、Caspase-1的表达均较对照组显著增高,并且ASC在T2DM组与MAP、FPG、TC呈正相关, Caspase-1在T2DM组与吸烟、FPG、LDLC呈正相关,一方面提示T2DM患者炎性小体在翻译水平的表达明显增加,为NLRP3蛋白复合体在T2DM患者中激活创造物质条件;另一方面提示T2DM患者高血压、高血糖、TC、LDLC、吸烟是激活NLRP3炎性小体在翻译水平表达增加的危险因素,但激活NLRP3炎性小体在翻译水平表达增加的危险因素不尽相同。NLRP3炎性小体表达增加后,T2DM患者体内高血糖[15]、活性氧(ROS)[15]、硫氧还原蛋白结合蛋白[16]、神经酰胺浓聚物[17]、胰岛淀粉样多肽[18]等物质将通过半通道依赖途径[19]、溶酶体依赖途径[20]、ROS的依赖途径[21-22]等模式激活NLRP3炎性小体。另外,在T2DM组,ASC还与IL-1β、IL-18呈正相关, Caspase-1还与IL-1β呈正相关,且IL-1β与TGF-β呈正相关,提示NLRP3炎性小体的激活,进一步导致IL-1β 和IL-18等炎性分子的表达增加,而IL-1β的表达增加将促使抗炎因子TGF-β的过度表达,IL-1β 和IL-18等炎性分子的表达增加及TGF-β等抗炎因子的过度表达,在T2DM及其并发症的发生发展过程中起着重要作用。
由此可见,高血压、高血糖、高血脂、吸烟、肥胖是激活NLRP3炎性小体表达的重要危险因素,NLRP3炎性小体激活后进一步促进IL-1β、IL-18等炎性分子的表达及TGF-β等抗炎因子的表达,NLRP3 炎性小体是糖代谢紊乱诱导T2DM 发生发展的中心环节。加强对血脂、血压、血糖水平的控制及烟、减肥,阻断NLRP3炎性小体的表达及活化途径,可能对T2DM及其并发症的发生发展起到抑制作用。进一步研究NLRP3炎性小体激活及其调控机制,研究IL-18、IL-1β、TGF-β在T2DM发生发展过程中的作用,有望进一步明确T2DM及其并发症在细胞和分子水平的发病机制,为T2DM的临床诊断、疗效观察、预后判断提供新的实验室检测指标,为T2DM及其并发症的治疗和预防提供新的突破点。
4 结论
高血压、高血糖、高血脂、吸烟、肥胖是激活NLRP3炎性小体表达的重要危险因素。以NLRP3炎性小体为中心的NLRP3-ASC-Caspase-1-IL-18/IL-1β-TGF-β信号通路可能在初诊T2DM的发生发展过程中发挥重要作用。
[1]EunKyeong Jo,Jin Kyung Kim,DongMin Shin,etal. Molecular mechanisms regulating NLRP3 inflammasome activation[J]. Cell Mol Immunol,2016,13(2): 148-159.
[2]Amna Abderrazak,Tatiana Syrovets,Dominique Couchie,etal. NLRP3 inflammasome: From a danger signal sensor to a regulatory node of oxidative stress and inflammatory diseases[J]. Redox Biol,2015,4: 296-307.
[3]Shao BZ, Xu ZQ, Han BZ,etal. NLRP3 inflammasome and its inhibitors: a review[J].Front Pharmacol, 2015,6:262.
[4]Dezayee ZM. Interleukin-18 can predict pre-clinical atherosclerosis and poor glycemic control in type 2 diabetes mellitus[J]. Int J Appl Basic Med Res, 2011,1(2):109-112.
[5]Schroder K, Zhou R, Tschopp J. The NLRP3 inflammasome: a sensor for metabolic danger[J] Science,2010,327(5963):296-300.
[6]Stienstra R, Joosten L A, Koenen T,etal. The inflammasomemediated caspase-1 activation controls adipocyte differentiation and insulin sensitivity[J].Cell Metabolism,2010,12(6): 593-605.
[7]Park YJ, Warnock GL, Ao Z,etal. Dual role of interleukin-1β in islet amyloid formation and its β-cell toxicity: Implications for type 2 diabetes and islet transplantation[J]. Diabetes Obes Metab, 2017,19(5):682-694.
[8]Stanley T L, Zanni M V, Johnsen S,etal. TNF-alpha antagonism with etanercept decreases glucose and increases the proportion of high molecular weight adiponectin in obese subjects with features of the metabolic syndrome[J]. J Clin Endocrinology and Metabolism,2011,96(1): 146-150.
[9]Zhao G, Dharmadhikari G, Maedler K,etal. Possible role of interleukin-1β in type 2 diabetes onset and implications for anti-inflammatory therapy strategies[J]. PLoS Comput Biol, 2014,10(8):1003798.
[10] Zhang XL,Topley N,Ito T,etal. IL-6 regulation of TGF-(beta) receptor compartmentalization and turnover enhances TGF-beta signalling[J]. Biol Chem,2005,280(13):12239-12245.
[11] Takimoto L, Wakabayashi, Sekiya T,etal.Smad2 and Smad3 are redundantly essential for the TGF-beta-mediated regulation of regulatory T plasticity and Th1development[J].J Immunol,2010,185(2):842-855.
[12] Redondo S, Navarro-Dorado J, Ramajo M,etal. The complex regulation of TGF-β in cardiovascular disease[J].Vasc Health Risk Manag, 2012,8:533-539.
[13] Ian Toma and Timothy A. McCaffrey Transforming growth factor-β and atherosclerosis: interwoven atherogenic and atheroprotective aspects[J].Cell Tissue Res,2012,347(1): 155-175.
[14] Suwanabol PA, Seedial SM, Shi X,etal. Transforming growth factor-β increases vascular smooth muscle cell proliferation through the Smad3 and extracellular signal-regulated kinase mitogen-activated protein kinases pathways[J].J Vasc Surg, 2012,56(2):446-454.
[15] 胡龙江,周音频,吕湛,等. NLRP3 炎性小体与2 型糖尿病及冠心病并发症的关系[J/CD]. 中华临床医师杂志:电子版,2015,9(23):4428-4431.
[16] Masters SL, Latz E, O'Neill LA. The inflammasome in atherosclerosis and type 2 diabetes[J].Sci Transl Med,2011,3(81):81ps17.
[17] Vandanmagsar B, Youm YH, Ravussin A,etal. The NLRP3 inflammasome instigates obesity-induced inflammation and insulin resistance[J].Nat Med,2011,17(2):179-188.
[18] Masters SL, Dunne A, Subramanian SL,etal. Activation of the NLRP3 inflammasome by islet amyloid polypeptide provides a mechanism for enhanced IL-1β in type 2 diabetes[J].Nat Immunol, 2010,11(10):897-904.
[19] Marina-García N, Franchi L, Kim YG,etal. Pannexin-1-mediated intracellular delivery of muramyl dipeptide induces caspase-1 activation via cryopyrin /NLRP3 independently of Nod2[J]. J Immunol,,2008,180(6):4050-4057.
[20] Hornung V, Bauernfeind F, Halle A,etal. Silica crystals and aluminum salts activate the NALP3 inflammasome through phagosomal destabilization[J]. Nat Immunol,,2008,9(8): 847-856.
[21] Cassel SL, Eisenbarth SC, Iyer SS.etal. The Nalp3 inflammasome is essential for the development of silicosis[J]. Proc Natl Acad Sci USA,2008,105(26):9035-9040.
[22] Dostert C, Pétrilli V, Van Bruggen R,etal. Innate immune activation through Nalp3 inflammasome sensing of asbestos and silica[J]. Science,2008,320(5876): 674-677.
