预适应联合后适应对大鼠缺血再灌注损伤的影响*
2018-03-28张涛许文胜郝冬梅何宏伟单新亮李鑫瑶孙旭高彩凤
张涛 许文胜 郝冬梅 何宏伟 单新亮 李鑫瑶 孙旭 高彩凤
(包头医学院基础医学与法医学院免疫学教研室,内蒙古 包头 014040)
脑缺血再灌注损伤主要是指恢复缺血脑组织的血流灌注对脑组织造成的严重损伤,其可引起一系列的细胞和生理反应,如产生大量氧自由基等活性分子、诱导前列腺素合成、诱导活化信号分子和诱导炎症因子产生等,导致线粒体功能障碍,严重影响患者的生活质量[1-2]。而缺血预适应主要是指短暂缺血再灌注可增强脑组织对随后较长时间缺血损伤的耐受性现象,缺血后适应主要是指在脑缺血后再灌注早期采用反复数次短暂缺血再灌注可保护脑组织以防止再灌注损伤,二者均可调动细胞内源性保护机制,进而抵抗神经细胞损伤,但具体作用机制目前尚不完全清楚[3-4]。为了进一步讨论预适应联合后适应对大鼠脑缺血/再灌注损伤的保护作用,本研究将SD大鼠制作脑缺血/再灌注损伤模型后的神经功能、脑梗死灶体检、脑组织氧化应激损伤生化指标及神经元凋亡情况进行了检测分析,并与正常大鼠进行了比较,旨在为临床提供理论依据。
1 材料与方法
1.1 实验动物与分组 选取清洁级雄性SD大鼠50只,体质量240~300g,由内蒙古科技大学包头医学院动物中心提供,合格证号:201407413,ddY系SPF级。将大鼠随机分为5组,每组各10只:假手术组(仅分离大鼠颈部血管,不插线栓)、模型组(线栓法行大脑中动脉阻闭120min后再灌注)、预适应组(在造模前24h和1h行3个循环的缺血15s+再灌注30s)、后适应组(在造模后行3个循环的再灌注30s+缺血15s)和预适应+后适应组(在造模前24h和1h行3个循环的缺血15s+再灌注30s以及在造模后行3个循环的再灌注30s+缺血15s)。
1.2 仪器与试剂 精密电子天平(DV215CD)购自日本奥豪斯公司;高速离心机(CRII)购自日本日立公司;数码相机(A-550)购自日本SONY公司,彩色病理图文分析系统(HPIAS-1000)购自武汉千屏影像公司,紫外分光光度计(UV-2550)购自日本岛津仪器公司,显微镜(Ls-210)购自日本奥林巴斯公司。丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒和考马斯亮兰蛋白测定试剂盒购自北京中金杉生物技术有限公司;TUNEL试剂盒购自德国Roche公司;氯化三苯基四氮唑(TTC)购自美国Sigma公司。
1.3 模型制备 所有实验大鼠在术前均禁食12h,自由饮水,随后行大脑中动脉阻闭120min后再灌注造成局灶性脑缺血再灌注损伤模型,具体造模方法如下:腹腔注射10%水合氯醛麻醉后颈部备皮、消毒,在颈正中做长约1.5 cm切口,分离右侧颈总动脉、颈外动脉及颈内动脉,结扎颈外动脉远心端及颈内动脉的颅外分支翼腭突动脉。利用动脉夹夹闭颈总动脉近心端和颈内动脉远心端,防止血液返流,随后在颈外动脉近分叉处剪一切口,经颈外动脉将线栓插入颈内动脉,松开颈内动脉远心端的动脉夹后继续插入线栓,直至到达大脑前动脉近端壁,阻断大脑中动脉来自颈内动脉、大脑前动脉及大脑后动脉的所有血供。去除颈总动脉上的动脉夹,依次缝合肌肉和皮肤切口,但将线栓外留。阻断120min后再次麻醉动物,将线栓缓慢拔出,恢复血流再灌注。假手术组仅分离颈内动脉和颈外动脉,不插线栓。
1.4 预适应与后适应处理 预适应方法:预适应组大鼠和预适应+后适应组大鼠在造模前24h和1h分别行3个循环的大脑中动脉缺血15 s+再灌注30 s作为预适应,即阻断大脑中动脉15s后拔出线栓再灌注30s,重复3个循环。后适应方法:后适应组和预适应+后适应组大鼠在造模后拔出线栓再灌注30s,然后将线栓再次插入颈内动脉阻闭大脑中动脉15s,重复3个循环后进行持续再灌注48h。
1.5 脑梗死灶测定 各组于造模48h后随机取4只处死后断头取脑,除去嗅球、小脑和低位脑干部分后切成约2 mm厚脑片,迅速放入氯化三苯基四氮唑溶液(TTC)中37℃染色30min,正常组织可被TTC染为深红色,而缺血坏死的脑组织不与TTC反应,应为白色。将切片多聚甲醛固定后放置比例尺并拍照,利用图像处理软件描绘出每一层面染色成白色的区域后,按比例求出各脑片的梗死面积(红色区域为正常脑组织,白色区域为梗死区)。
1.6 脑组织匀浆生化指标测定 各组再随机取4只大鼠断头后取脑,去除小脑和嗅球后用冷生理盐水漂洗,滤纸拭干后称重,随后加入等体积预冷的生理盐水后利用匀浆机制成匀浆,高速离心机以6000r/min离心15min后取上清液,于冰箱保存待测。取少量上清液分别加入考马斯亮兰蛋白测定试剂盒、SOD试剂盒和MDA试剂盒进行处理,并利用紫外分光光度计分别在590nm、550nm和532nm处测定吸光度,根据公式求出样本中蛋白质浓度、SOD活性和脂质过氧化产物MDA的含量,具体操作步骤严格按照试剂盒说明书进行。
1.7 细胞凋亡测定 将各组剩余大鼠麻醉后先经心脏灌注生理盐水,把血液冲净后再用4%多聚甲醛灌注,随后断头取脑,将缺血侧脑组织用4%多聚甲醛固定。常规脱水和石蜡包埋处理,在视交叉后1mm处及4mm处行冠状切片后做连续切片,厚约5μm。将相邻大脑切片用TUNEL试剂盒进行染色后于显微镜下观察并记录实验结果。阳性细胞结果应为棕黄色(核)或棕褐色,背景呈蓝紫色,每张切片在普通光镜下随机釆集5个不重叠视野进行观察,记录每个视野中的凋亡细胞个数,取平均值作为凋亡细胞数。
1.8 神经功能缺陷评分 采用Longa等描述的5级神经缺陷评分法对大鼠手术后再灌注6、12、24和48h神经功能进行评分:0级为无神经功能缺陷,记为0分;Ⅰ级为不能完全伸展缺血病灶对侧前肢,记为1分;Ⅱ级为行走时向缺血病灶对侧转圈,记为2分;Ⅲ级为行走时向缺血病灶对侧倾倒,记为3分;Ⅳ级为不能自发行走,昏迷,记为4分。

2 结果
2.1 各组大鼠神经功能缺损评分比较 再灌注后6h各处理组与模型组神经功能缺陷评分差异无统计学意义(P<0.05);再灌注12、24和48h模型组神经功能缺陷评分明显高于其他处理组(P<0.05);再灌注12、24和48h处理组中,预适应+后适应组神经功能缺陷评分最低(P<0.05),而预适应组和后适应组神经功能缺失评分比较差异无统计学意义(P>0.05),见表1。

表1 各组大鼠神经功能缺陷评分比较分)Table 1 Comparison of neurological function defects in each group
注:与模型组比较,①P<0.05;与预适应组比较,②P<0.05;与后适应组比较,③P<0.05
2.2 各组大鼠脑梗死灶体积比较 预适应+后适应组脑梗死灶体积为(100.41±33.26)mm3,明显低于模型组、预适应组和后适应组(均P<0.05);预适应组和后适应组脑梗死灶体积较模型组降低(P<0.05);预适应组和后适应组脑梗死灶体积比较差异无统计学意义(P>0.05),见表2。
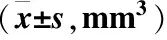
表2 各组大鼠脑梗死灶体积比较Table 2 Comparison of volume of cerebral infarction in rats
注:与模型组比较,①P<0.05;与预适应组比较,②P<0.05;与后适应组比较,③P<0.05
2.3 各组大鼠脑组织SOD和MDA比较 假手术组SOD活性明显高于模型组,而MDA低于模型组(P<0.05);模型组与预适应组SOD和MDA比较差异无统计学意义(P>0.05);后适应组和预适应+后适应组SOD活性较模型组升高,而MDA较模型组降低(P<0.05),见表3。

Table3SODactivityandMDAofratbraintissueineachgroup

组别SOD(μn/mgprot)MDA(nmol/mgprot)假手术组122 41±24 61①②③43 51±9 64①②③模型组45 56±10 31113 43±21 07预适应组48 63±11 07110 53±25 66后适应组76 81±9 83①②78 60±13 27①②预适应+后适应组110 13±12 16①②③④61 51±12 15①②③④ F84 63291 062 P<0 05<0 05
注:与模型组比较,①P<0.05;与预适应组比较,②P<0.05;与后适应组比较,③P<0.05;与假手术组比较,④P<0.05
2.4 各组大鼠皮质神经元凋亡影响 假手术组细胞凋亡数明显低于模型组(P<0.05);各处理组细胞凋亡数较模型组有所降低(P<0.05),其中预适应+后适应组神经元细胞凋亡数最少,为(47.20±9.21)个,见表4、图1。

表4 各组大鼠皮质神经元细胞凋亡比较Table 4 Comparison of apoptosis of cortical neurons in each group
注:与模型组比较,①P<0.05;与预适应组比较,②P<0.05;与后适应组比较,③P<0.05;与假手术组比较,④P<0.05
3 讨论
缺血、低氧(I/HPC)指机体预先受一次或多次短暂、非致死性缺血/低氧刺激,再恢复常态后而获得的更严重甚至致死性缺血或缺氧,是临床医学的常过程和基本病理死因,如CO中毒、缺血性脑病(肺性脑病、高血压脑病、肝性脑病等)、帕金森氏病、新生儿窒息后由缺血缺氧引起的脑病,病情危重且病死率较高,甚至可以产生诸如智力低下、脑瘫、癫痛、痉挛以及共济失调等[5],也是航天、高原、深水等极端环境所面临的基本问题。
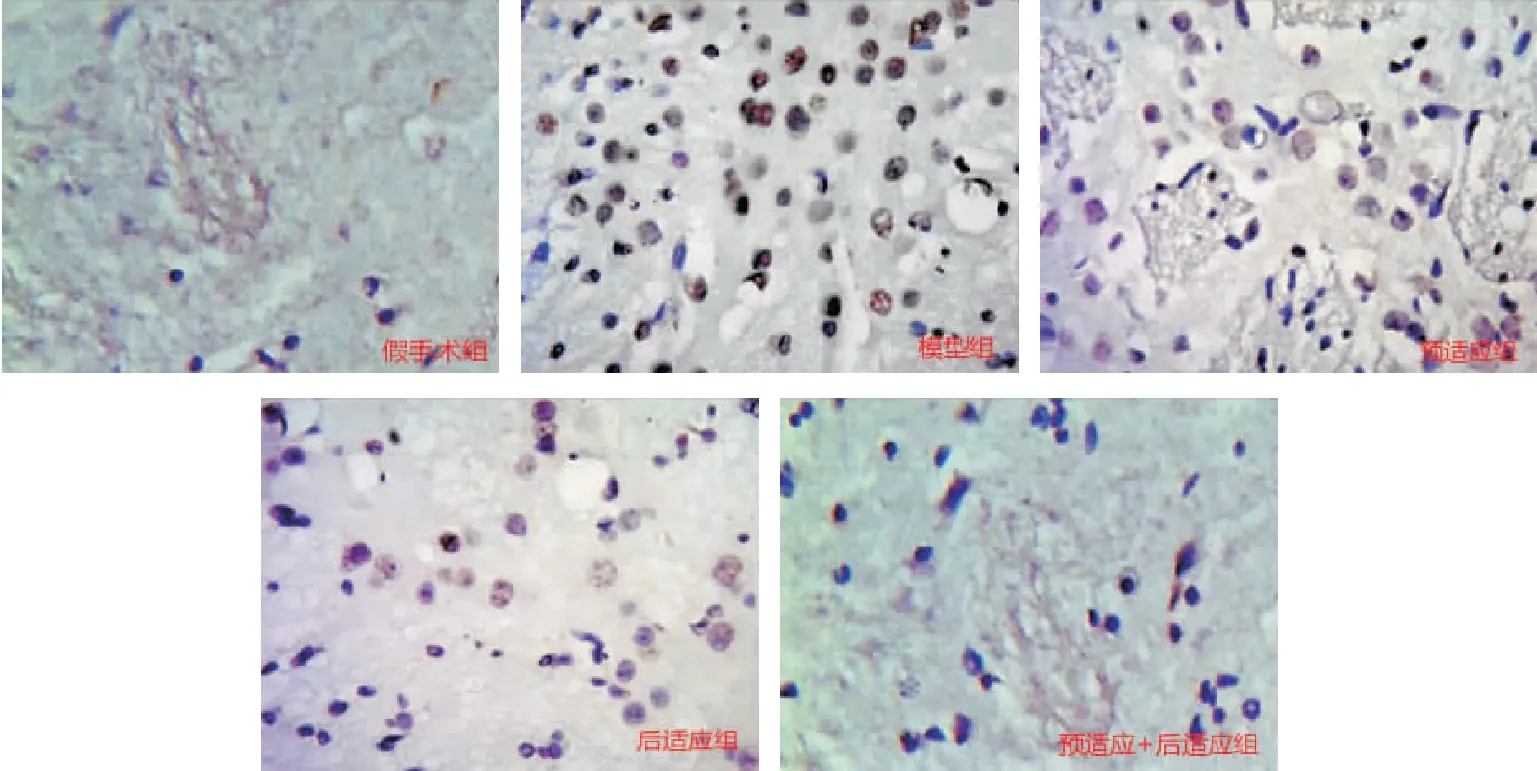
图1 各组大鼠缺血侧皮质TUNEL染色结果(×400)Figure 1 Results of TUNEL staining of ischemic lateral cortex in rats
缺血、低氧可导致机体免疫功能紊乱,诱发一些免疫炎症性疾病,并可导致细胞和组织由于能量供给不足等一系列问题而出现炎症、损伤,甚至死亡,而脑是人体对缺血最为敏感的器官,脑组织缺血将会导致局部脑组织及其功能的损害,即使短暂的缺血也可导致神经元的损伤或死亡,而长时间的完全缺血或严重缺血会引起梗死[6]。缺血后血流恢复无疑是维持和防止脑组织进一步损伤的必需措施,但再灌注后往往发生复杂的脑循环机能和代谢的变化,加重缺血后的脑组织损伤,常表现于围术期脑外伤及头颈部大血管手术[7]。Murry等[8]1986年发现,I/HPC后阻断犬冠状动脉40min所致的心肌梗死范围比对照组减少75%,由此首次提出I/HPC的神经保护作用,并于1990年发现类似状况[9]。I/HPC被认为是细胞内源性防护机制的启动[9],如促红细胞生成素(EPO)血管内皮生长因子(VEGF)等[10-11]均在中枢神经系统中广泛表达,机体抗缺氧或缺血可以促进二者表达增加,通过与配体结合,启动内源性保护机制,依次激活一系列信号转导通路及多种可能的机制发挥神经保护作用,减轻低氧/缺血引起的神经元损伤。这种防护机制一般通过预先给机体一个温和的(亚致死性)缺血/低氧刺激。这一细胞内源性保护现象在大脑、肾脏、小肠和肝脏等器官都存在,脑缺血时脑细胞生物电会发生改变,并出现病理性慢波,缺血一定时间后再灌注,慢波持续并加重,而颞叶组织内神经递质性氨基酸代谢也会发生明显变化,即兴奋性氨基酸随缺血-再灌注时间延长而逐渐降低,抑制性氨基酸在缺血-再灌注早期明显升高。缺血再灌注损伤时间越长,兴奋性递质含量越低,脑组织超微结构改变越明显,但其具体机制目前尚不完全清楚[12-13]。
脑缺血再灌注损伤的机制目前己有多种学说,如自由基(ROS)学说、兴奋性氨基酸毒性学说、韩超载学说、水通道学说、蛋白质合成抑制学说及基因遗传学说等,其中ROS引发的脂质过氧化反应被认为是脑缺血/再灌注损伤的最为重要机制之一,其介导的连锁反应是脑缺血/再灌注的核心病理生理过程[14-15]。ROS生成增多与黄嘌呤氧化酶形成增多、中性粒细胞的呼吸爆发、线粒体功能受损、儿茶酚胺自身氧化增加,而急剧增加的ROS可与细胞膜不饱和脂肪酸发生反应,形成脂质过氧化并导致细胞损伤破裂、血脑屏障破坏以及脑水肿形成[16]。ROS还可以攻击细胞膜,造成细胞膜和线粒体损伤,最终导致细胞膜破坏及神经元损伤,并诱导细胞凋亡[17]。而细胞膜受损会加重血管源性脑水肿及缺血性脑损伤,并使大脑缺血半暗区出现血管痉挛与内凝血,从而导致脑梗死范围扩大[18]。有研究表明,缺血预适应和缺血后适应均对脑缺血/再灌注损伤具有一定的保护作用[19],但其具体机制目前尚不完全清楚。
本研究对SD大鼠脑缺血/再灌注损伤模型的神经功能、脑梗死灶体积、脑组织氧化应激损伤生化指标及神经元凋亡情况进行检测分析,并与正常大鼠进行比较,结果表明,再灌注12、24和48h模型组神经功能缺陷评分明显高于其他处理组,再灌注12、24和48h处理组中,预适应+后适应组神经功能缺陷评分最低,而预适应组和后适应组神经功能缺失评分比较差异无统计学意义(P>0.05),提示预适应+后适应可明显改善脑缺血/再灌注损伤导致的神经功能下降程度,且比单独预适应或后适应的效果更好。同时发现,假手术组SOD活性明显高于模型组,而MDA低于模型组;模型组与预适应组SOD和MDA比较差异无统计学意义(P>0.05);后适应组和预适应+后适应组SOD活性较模型组升高,而MDA较模型组降低。SOD可清除超氧阴离子,其活性的下降则意味着机体抗氧化能力的降低;而MDA的含量变化可间接反映脑组织中ROS含量的变化和脑组织的损伤程度,而后适应可明显上调SOD水平并降低MDA水平,进而抑制ROS的爆发,其抗氧化作用较强。研究还发现,各处理组细胞凋亡数较模型组有所降低,其中预适应+后适应组神经元细胞凋亡数最少,而预适应+后适应组脑梗死灶体积明显低于模型组、预适应组和后适应组,预适应组和后适应组脑梗死灶体积较模型组也明显降低,提示预适应和后适应均可明显改善脑组织的损伤程度,从而抑制再灌注期的氧化应激损伤,进而减少神经细胞的凋亡与坏死,且联合后的保护效果更好。但本研究限于样本量不足,对预适应联合后适应对大鼠脑缺血再灌注损伤保护作用的具体机制仍需做进一步研究。
4 结论
预适应和后适应均能对大鼠脑缺血再灌注损伤具有保护作用,而两者联合应用能进一步加强保护作用。
[1]Qingbo Zhou, Chengzhu Duan, Qing Jia,etal. Baicalin attenuates focal cerebral ischemic reperfusion injury by inhibition of protease-activated receptor-1 and apoptosis[J]. Chinese Journal of Integrative Medicine, 2014, 20(2):116-122.
[2]Jiang Z, Chen C H, Chen Y Y,etal. Autophagic Effect of Programmed Cell Death 5 (PDCD5) after focal cerebral ischemic reperfusion injury in rats[J]. Neuroscience Letters, 2014, 566(18):298-303.
[3]赵晓楠, 袁恒杰, 朱学慧,等. 无创性延迟肢体缺血预适应对抗大鼠脑缺血再灌注损伤的内皮机制[J]. 中国医院药学杂志, 2015, 35(10):877-881.
[4]张江, 常莉莎, 梁鹏,等. 反复无创性肢体缺血后适应对大鼠脑缺血的保护作用[J]. 中华老年心脑血管病杂志, 2015,14(11):1201-1203.
[5]Sun Y X, Liu T, Dai X L,etal. Neuroprotective Activity of Water Soluble Extract from Chorispora bungeana against Focal Cerebral Ischemic/Reperfusion Injury in Mice[J]. Journal of Chemistry, 2014, 14(7):1-9.
[6]Fan Z, Tong X, Yan L I,etal. Protective effect of propofol against cerebral ischemic/reperfusion injury may involve inhibition of gap junction[J]. Journal of Southern Medical University, 2015, 35(12):33-35.
[7]CE, Jennings RB, Reimer KA. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium[J]. Circulation, 1986, 74 (5):1124-1136.
[8]Kitagawa K, Matsumoto M, Tagaya M,etal. Ischemic tolerance' phenomenon found in the brain[J]. Brain Res, 1990,528 (1):21-24.
[9]Bergeron M, Gidday JM, Yu AY,etal. Role of hypoxia-inducible factor-1 in hypoxia-induced ischemic tolerance inneonatal rat brain[J]. Ann Neurol, 2000, 48 (3):285-296.
[10] 杨洁,邵国.促红细胞生成素在低氧预适应中的神经保护作用[J].生理科学进展,2015,(5):120-122.
[11] 石雪英,邵国,刘晓光.血管内皮生长因子在低氧预适应中的神经保护作用[J]. 医学与哲学,2015, 36(11B):57-60.
[12] 范加维, 杨森, 杨拯,等. 原花青素对脑缺血再灌注损伤后肠道功能的保护作用[J]. 中国康复理论与实践, 2015,21(10):1138-1144.
[13] 张卫同, 柴栋, 徐珊,等. 石菖蒲对脑缺血大鼠纹状体氨基酸类神经递质含量变化的影响[J]. 中国应用生理学杂志, 2014,22(4):352-356.
[14] 翟晓晨, 吴捷. 三七总皂苷对脑缺血/再灌注损伤保护机制的研究进展[J]. 中国药学杂志, 2016, 51(1):6-9.
[15] 杨帅, 李绪东, 钟镝,等. 脑缺血再灌注损伤机制的研究进展[J]. 神经疾病与精神卫生, 2015, 15(6):114-116.
[16] 纪元, 龙建纲, 刘健康. 自噬发生中的ROS调节机制[J]. 中国生物化学与分子生物学报, 2014,16(4):321-327.
[17] 徐水岭, 朱嘉,张辛宏,等. 线粒体损伤在创伤弧菌诱导树突状细胞凋亡中的作用[J]. 中国病理生理杂志, 2014, 30(9):1682-1688.
[18] 魏霞, 潘红, 姚旋,等. 外源性硫化氢通过抑制闭合蛋白和闭锁小带蛋白1表达减轻脑缺血再灌注大鼠脑水肿和脑损伤[J]. 国际脑血管病杂志, 2015, 23(12):223-225.
[19] 姜维喜, 刘庆, 袁贤瑞. 预适应与后适应联合干预对脑缺血/再灌注损伤的保护作用[J]. 中南大学学报(医学版), 2014, 39(01):30-35.
