实验小猪急性心肌梗死后心肌细胞凋亡机制的动态研究*
2018-03-28孙维娜王绍欣董平栓汪砚雨王可李转珍魏丽娟闫鹏刘向勇程建新王丽平段娜娜王闯
孙维娜 王绍欣 董平栓 汪砚雨 王可 李转珍 魏丽娟 闫鹏 刘向勇 程建新 王丽平 段娜娜 王闯
(河南科技大学第一附属医院心血管内科,河南 洛阳471003)
急性心肌梗死(Acute myocardial infarction, AMI)是急性起病、发展迅速并死亡率高的心血管疾病,近年大量研究表明,AMI后的心肌细胞中存在有细胞凋亡[1],并与AMI的预后及演变有关。细胞凋亡是基因调控的程序性死亡,是机体产生变化或者受到刺激时在基因调控及信号转导下引起的一系列连锁反应。目前国内外有大量心肌细胞凋亡相关的研究,但对其心梗后心肌凋亡的动态演变研究较少。本研究通过建立中华小猪急性心肌梗死模型后对心肌梗死的缺血区心肌细胞的凋亡指数(AI)及心肌组织中caspase-3蛋白的表达进行动态观察并分析其变化规律,从而探讨AMI后心肌细胞凋亡的机制。
1 对象及方法
1.1 实验对象 健康中华小猪8只,由泰州泰和生物技术有限公司提供,均同窝出生,体重15~21kg,雌雄各半,全部经防疫检验合格,检疫证号:3205197447,许可证号:SCXK(苏)2011-0002。排除近期患病、体质差及进食不佳的小猪。
1.2 分组及建模 分组:选取其中1只小猪作为对照组,余7只小猪作为实验组并随机分成7个亚组,给予编号1~7组,分别对应心梗后1、3、5、7、10、14及28d的小猪,所有小猪均正常喂养,饮食、室温均相同。建模:将小猪禁食水8~12h后,行肌肉注射诱导麻醉(氯胺酮),并备皮固定于手术台上,同时给予吸氧、心电监护并建立静脉通路,消毒铺巾,穿刺部位(右侧股动脉搏动最强点)局部麻醉,沿右侧股动脉处穿刺进针并送入J型导引导丝及6F动脉鞘管,追加肝素后将Guiding导管送入升主动脉根部,行左右冠状动脉多体位造影。将Runthrough微导管远端送入OM支近端,撤出导丝,将明胶海绵混悬液(明胶海绵溶于造影剂碘普罗胺内)经微导管推入,造影显示OM支远端血流中断,撤出微导管,拔鞘管,置入人工套管,肝素封闭创口并压迫6 h,术毕。对照组仅行冠脉造影术。在整个手术过程中小猪心率维持在120~200 次/min,血压维持在140~180/110~150mmHg(心电监护显示)。手术结束后,将动物送回饲养中心,单猪饲养,避免感染并注意观察生命体征变化。
1.3 备制标本 在成功建立AMI模型后,分别于AMI后第1、3、5、7、10、14及28 d处死实验组小猪并取出8只小猪的整体心脏,经4%的甲醛固定后于左室侧壁切取不同部位的梗死缺血区及对照组正常心肌各3块组织,经脱水、石蜡包埋后切片(每块组织均切5张切片),脱蜡,行TUNEL检测及caspase-3免疫荧光检测。TUNEL试剂盒购于美国罗氏abcam公司 In Site Death TMR红色标记,编号:12156792910;caspase-3兔抗购于上海优宁维生物科技有限公司,货号:ab90437。
1.4 实验步骤
1.4.1 TUNEL法检测 按照TUNEL试剂盒说明书进行。将组织切片放入干燥箱2h,再依次进行组织脱蜡、抗原修复、甲醇-H2O2阻断液、TUNEL试剂混合液(按抗体混合液:PBS为1:2,其中红:蓝为45:5,抗体在暗湿盒中孵育1h,37℃)、DAPI染液(按每张组织切片50~100μl 时间10~15min)、覆盖玻片及中性树胶封片(从阻断液后均避光),将暗湿盒中的切片置于4℃冰箱中保存过夜,每步前后均用PBS洗涤3次×5min,于×40倍电子荧光显微镜下观察心肌凋亡数目及细胞核的情况并摄片记录。
1.4.2 Caspase-3免疫荧光 caspase-3免疫荧光检测一抗为兔抗猪多克隆抗体,二抗为通用型二抗兔抗鼠免疫荧光试剂盒。先将组织切片放入干燥箱中2h,再依次进行脱蜡、抗原修复、甲醇-H2O2阻断液、10%山羊血清封闭(山羊血清用PBS稀释为1:9,时间10min)、一抗孵育(用抗体稀释液稀释为1:800, 4℃过夜,弃去血清直接滴加)、二抗孵育(用抗体稀释液稀释为1:200, 孵育1h, 37℃)、DAPI染液(按每张组织切片50~100μl,时间10~15min)、覆盖玻片及中性树胶封片(从一抗孵育后均避光)封片,4℃冰箱避光保存,每步前后均用PBS洗涤3次×5min,于×40倍电子荧光显微镜下观察caspase-3的表达情况并摄片。
1.5 观察指标 TUNEL法检测:在显微镜观察下任选阳性集中表达区域的10个视野,通过Photoshop-13-LS3软件进行计数及图片整理,统计视野中阳性指标数目与所占总心肌细胞数目百分比的平均值作为凋亡指数(AI),以定量评价心肌的凋亡程度。免疫荧光:按照caspase-3阳性表达密度依次从0、20%、40%、60%、80%、100%进行统计,同时计算其平均值。
2 结果
2.1 AMI 模型成功建立 实验组小猪在局麻下行冠脉造影及OM支明胶海绵封堵术后,通过对比术前冠脉造影结果,显示OM支远端血流中断,AMI模型建立成功,见图1。
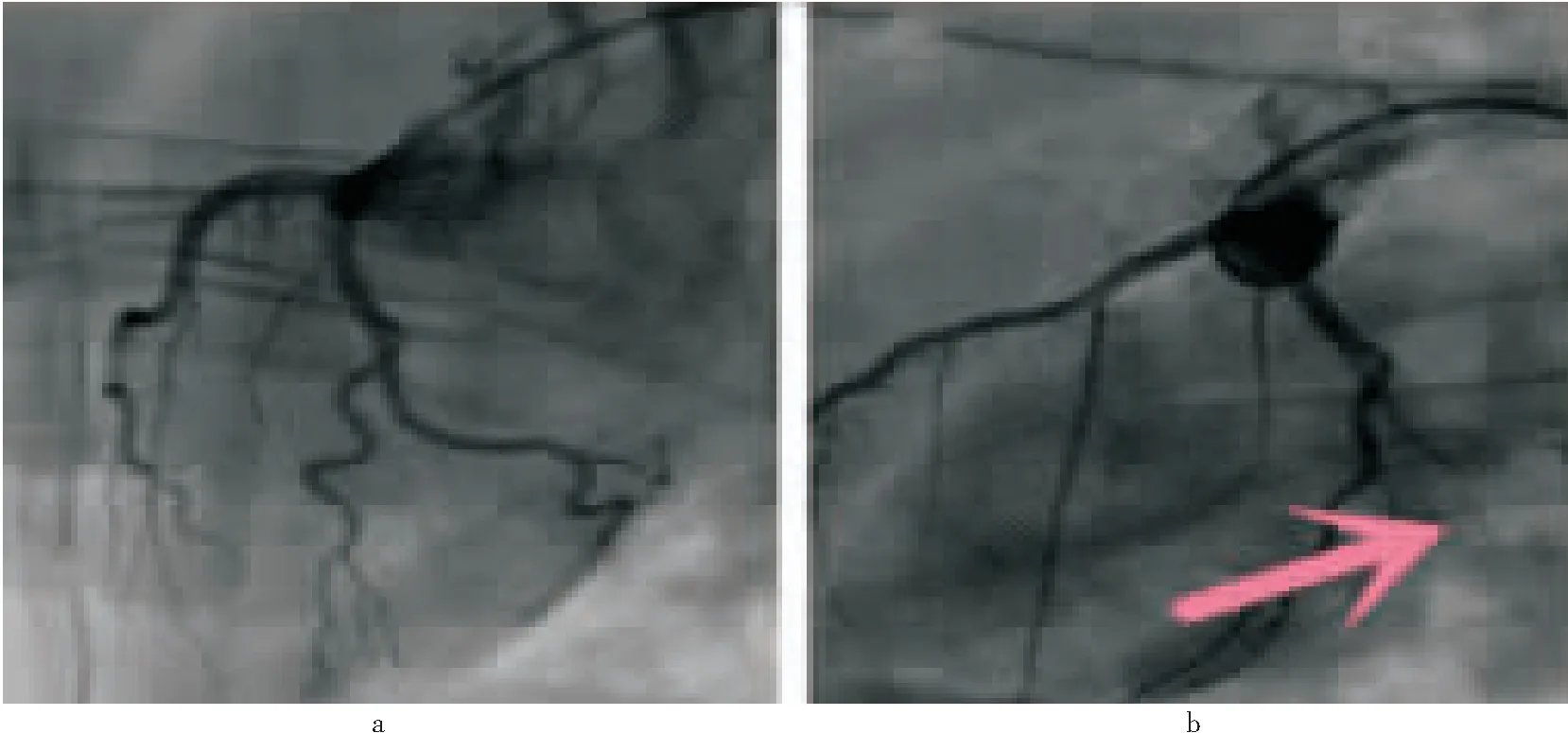
图1 建立模型前后冠脉血流情况Figure 1 Coronary blood flow condition before and after the model注:a为实验组行冠脉封堵术前,可见血流通畅;b为实验组冠脉封堵术后,可见局部血流消失
2.2 TUNEL法检测结果 AMI模型建立成功后,行TUNEL法检测,结果显示,正常未梗死心肌(对照组)未见阳性复合物表达,见图2a;AMI后实验组第1d即出现明显阳性表达,同时即为高峰,而后逐渐下降,于第3~7d基本平稳,随后至第14~28d基本降至偏低水平,见图2b~h和图3。
2.3 caspase-3免疫荧光检测结果 在荧光显微镜下观察caspase-3抗体复合物的阳性表达见图4。实验组及对照组各切片的阳性表达结果见图5。
3 讨论
本实验通过成功建立AMI实验小猪模型,分别对不同时期心肌梗死周边缺血区行TUNEL检测及caspase-3蛋白免疫组化检测。从实验图片中可见梗死后心肌细胞核与未梗死细胞核相比,出现明显细胞核体积减小及固缩现象,证实心肌细胞凋亡存在;TUNEL检测结果显示,AMI后第1 d AI达高峰,表明心肌梗死周边缺血区存在大量凋亡细胞,这与 Eeva等[1]实验结果相一致。随后AI逐渐下降,在第7d左右处于短期平衡状态,这正是心肌梗死后炎症反应时期,同时心肌细胞也处于逐渐修复过程中。在AMI后第14~28 d左右心肌处于肉芽及瘢痕组织修复过程中,凋亡细胞处于低水平状态。TUNEL法检测及免疫荧光的阳性指标动态演变趋势大致相同,这进一步证实心肌细胞在AMI后从凋亡、细胞坏死、炎症反应及修复等一系列复杂的病理变化过程。

图2 显微镜下AMI后心肌细胞不同时期的TUNEL检测结果Figure 2 After AMI, TUNEL of myocardial cell in different periods注:a 指心肌细胞核,b 指阳性结果,b~h分别指AMI后第1、3、5、7、10、14、28d的TUNEL检测结果

图3 AMI后心肌细胞不同时期的AIFigure 3 AI of myocardial cells in different periods after AMI注:横坐标为AMI后不同时期,即心梗后第1、3、5、7、10、14、28d;纵坐标表示凋亡指数

图4 AMI后心肌细胞的Caspase-3免疫荧光检测检测结果Figure 4 Caspase-3 immunofluorescence result of myocardial cells after AMI注:a表示对照组免疫荧光结果,未见阳性表达,蓝色表示细胞核;b表示心梗后第3d的阳性表达,其中桃红色表示Caspase-3抗原抗体复合物
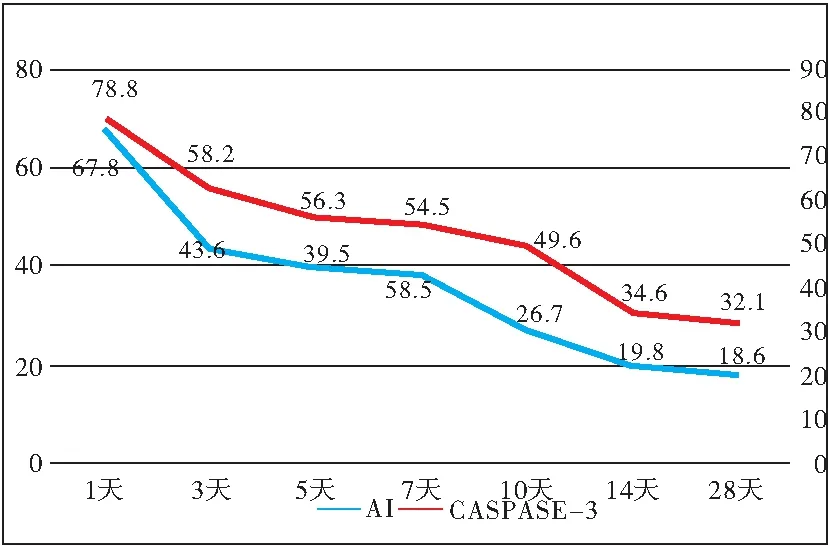
图5 AMI后心肌细胞AI及Caspase-3免疫荧光结果
Figure5AIandCaspase3immunofluorescenceofmyocardialcellsafterAMI
注:横坐标为AMI后不同时期;纵坐标蓝色线表示凋亡指数(AI),红色线表示免疫组化Caspase-3阳性表达
国内外研究表明,急性心肌梗死后出现的细胞凋亡是除了坏死以外的另一种细胞的死亡形式[2],是在外界因素的影响下导致细胞自身基因调控的启动所发生的连锁反应。细胞凋亡是一种由多基因调控的细胞程序性死亡,不存在炎症反应,因此是由基因调控、凋亡因子的激活及凋亡蛋白的执行所形成的一系列反应[3]。目前研究细胞凋亡的经典途径有死亡受体途径、线粒体途径及内质网途径,其中线粒体途径是在机体缺血缺氧、应激等状态下引起线粒体细胞色素C的释放,从而激活细胞凋亡的“执行者”-caspase-3(含半胱氨酸的天冬氨酸蛋白水解酶cysteinyl aspartate specific proteinase)的激活,继而引发细胞凋亡的过程。caspase-3是caspase家族中的一员,是细胞凋亡过程中最主要的终末剪切酶,正常情况下以无活性的caspase-3前体形式存在于细胞质中,在机体受到刺激而出现缺血缺氧时,即可立即激活caspase-3前体,从而启动细胞的凋亡[4],可见Caspase-3蛋白在细胞凋亡过程中具有至关重要的作用[5-6]。
先前大量实验研究表明,心肌缺血、缺氧及再灌注损伤都可导致心肌细胞的凋亡[7],心肌细胞的凋亡参与了多种心血管疾病,并与心肌演变、修复及预后有密切关系。AMI是各种原因引起的心肌在短时间内长期持续性缺血缺氧所引起的心肌损害,心肌的缺血缺氧首先表现在“能量工厂”-线粒体,由于线粒体内存在多种促凋亡因子及参与凋亡的蛋白,因此在机体受到外界因素的刺激时,线粒体在能量ATP下降的同时,诱导促凋亡因子的激活和释放,从而在基因的调控下启动并开始细胞凋亡的过程。在线粒体能量严重缺乏的情况下出现各种炎症因子及钙超载等反应,从而引起细胞的坏死[8]。在传统观点上,心肌梗死后出现的主要病理变化是以心肌坏死为主[9-11],而目前大量相关研究表明,AMI时在心肌梗死部位首先出现大量的凋亡细胞,而后出现坏死[12],这进一步说明心肌凋亡参与多种缺血性心肌病的发生发展过程。
姚玉宇等[13]通过结扎雄性大鼠冠状动脉左前降支建立AMI模型的动物实验研究表明,动态观察AMI后1、7、14、28d的心肌梗死范围及AI值,结果显示AMI后1d细胞凋亡达高峰,随后逐渐下降,28d左右趋于低水平状态,这与本实验结果基本相符。本实验同时印证了心肌细胞凋亡过程中重要参与者-caspase-3蛋白在细胞凋亡机制中占有不可或缺的作用。
近几年国内外大量文献研究,关于急性心肌梗死后应用药物干预降低心肌凋亡,进一步改善心肌重构及预后,如阿托伐他汀、辛伐他汀及芪苈强心等药物[14-16],不仅证实心肌细胞凋亡的存在,同时通过药物干预组及对照组的对比后得出结论:经过应用药物干预细胞凋亡途径,导致心肌细胞凋亡数目减少,左室舒张末直径及射血分数等均较前改善,保护受损心肌,降低病死率及死亡率。有关文献显示,通过调节凋亡因子探究细胞凋亡不同途径,进一步证实细胞凋亡的存在及凋亡机制[17]。Luo K Q等[18]通过首先建立家兔AMI模型,应用SDF-1抗体(stromal cell-derived factor-1 )干预死亡途径(NF-κB),减弱心肌细胞凋亡,促进血管生成及改善心脏功能。
4 结论
本研究结果发现,在AMI后心肌梗死周边及缺血区域有大量凋亡因子Caspase-3蛋白存在;当心肌细胞短时间内受到缺血缺氧时,可通过细胞线粒体途径诱导细胞凋亡的启动而出现心肌凋亡现象,进而参与AMI后心肌重构及影响心肌舒缩功能等病理变化过程。未来若应用细胞凋亡抗体则可减少细胞的不可逆性凋亡。但本研究的样本数量较少,未来仍需大样本研究以进一步进行认证。
[1]Eeva palojoki, Saraste A, Eriksson A,etal.Cardiomyocyte apoptosis and ventricular remodeling after myocardial infarction in rats[J]. Am J Physiol Heart Circ Physiol,2001, 280:2726.
[2] Mishra N C, Kumar S. Apoptosis: a mitochondrial perspective on cell death[J]. Indian Journal of Experimental Biology, 2005, 43(1): 25-34.
[3]Majno G, Joris I. Apoptosis, oncosis, and necrosis. An overview of cell death[J]. Am J Pathol,1995,146(1):3-15.
[4]Brentnall M, Rodriguez-Menocal L, Guevara R L D,etal. Caspase-9, caspase-3 and caspase-7 have distinct roles during intrinsic apoptosis[J]. BMC Cell Biology, 2013, 14(1):32.
[5]Guven B A, Ercan E, Asgun H F,etal. Experimental acute myocardial infarction in rats: HIF-1α, caspase-3, erythropoietin and erythropoietin receptor expression and the cardioprotective effects of two different erythropoietin doses[J]. Acta Histochemica, 2013, 115(7): 658-668.
[6]Schwarz K, Simonis G, Yu X,etal. Apoptosis at a distance: remote activation of caspase-3 occurs early after myocardial infarction[J]. Molecular and Cellular Biochemistry, 2006, 281(1): 45-54.
[7]Jin HJ, Xie XL, Ye JM,etal. TanshinoneIIA and cryptotanshinone protect against hypoxia-induced mitochondrial apoptosis in H9c2 cells[J]. PLoS One,2013,8(1): e51720.
[8]Oba T, Yasukawa H, Sasaki K I,etal. Cardiac-Specific Deletion of SOCS3 Prevented Myocardial Apoptosis After Acute Myocardial Infarction Through Inhibiting Mitochondrial Damage[J]. Journal of Cardiac Failure, 2009, 15(7): S151-S151.
[9]Itoch G, Tamura J, Suzuki M,etal. DNA fragmentation of human infarcted myocardial cells demonstrated by the nick end labeling method and DNA agarose gel electrophoresis[J]. American Journal of Pathology, 146(6), 1325-1331.
[10] Kajstrua J, Cheng W, Reiss K,etal. Apoptotic and necrotic myocyte cell deaths are independent contributing variables of infarct size in rats[J]. Laboratory Investigation,1996,74(1): 86.
[11] Veinot JP, Gattinger DA, Fliss H,etal. Early apoptosis in human myocardial infarcts[J].Human Pathology,1997,28(4),485.
[12] Zhao ZQ, Nakamura M, Wang NP,etal. Reperfusion induces myocardial apoptotic cell death[J].Cardiovascular Research, 45,2000,45(3):651-660.
[13] 姚玉宇, 马根山, 刘乃丰,等. 急性心肌梗死后凋亡和炎症及相关因子的动态变化[J]. 江苏医药, 2008, 34(12):1271-1273.
[14] Xian Jing Song, Chun Yan Yang, Bin Liu,etal. Atorvastatin Inhibits Myocardial Cell Apoptosis in a Rat Model with Post-myocardial Infarction Heart Failure by Downregulating ER Stress Response[J]. International Journal of Medical Sciences, 2011, 8(7):564.
[15] Luo K Q, Long H B, Xu B C. Reduced Apoptosis After Acute Myocardial Infarction by Simvastatin[J]. Cell Biochemistry and Biophysics, 2015, 71(2):1-6.
[16] Tao L, Li X, Xiao J. GW25-e3529 Traditional Chinese Medication Qiliqiangxin attenuates cardiac remodeling after acute myocardial infarction in mice[J]. Journal of the American College of Cardiology, 2014, 64(16):235-236.
[17] Ling H, Lou Y, Wu H,etal. Total flavones from Elsholtzia blanda reduce infarct size and improve heart function during acute myocardial infarction by inhibiting myocardial apoptosis in canines[J]. Acta Cardiologica, 2005, 60(3): 295-301.
[18] Wang X,Meng H,Chen P,etal. Beneficial effects of muscone on cardiac remodeling in a mouse model of myocardial infarction[J]. International Journal of Molecular Medicine, 2014, 34(1):103.
