炎症性肠病合并自身免疫病临床特征及药物治疗方案研究
2018-03-28谢巧玉林霖
谢巧玉 林霖
炎症性肠病(Inflammatory bowel disease,IBD)为累及直肠、回肠、结肠的一组不明原因的特发性肠道炎症性疾病,包括克罗恩病(Crohn's disease,CD)和溃疡性结肠炎(Ulcerative colitis,UC)。UC是黏膜下层和结肠黏膜层连续性炎症,通常会先累及直肠,然后逐渐向全结肠蔓延。CD为非连续性全层炎症,可累及全消化道,最常累及部位为末端回肠、结肠和肛周。自身免疫病(autoimmune disease,AD)是指机体免疫系统对自身抗原发生的免疫应答而导致自身组织损害进而产生的疾病,只有在自身免疫反应超出生理限度或持续过久,损伤了自身组织器官并引起病变或临床症状时,才能导致自身免疫病的发生。IBD发病机制尚不明确,但随着研究的深入,发现免疫应答失调、肠道菌群紊乱及基因易感性等与IBD发病密切相关[1,2]。有研究表明,IBD也是免疫相关性疾病的一种,其主要发病机制为免疫应答失调[3,4]。目前,国内关于IBD合并AD相关报道较少,本研究回顾性分析IBD合并AD患者临床特征,并探讨药物治疗方案的差异,以期为IBD治疗提供参考依据,现报道如下。
1 材料与方法
1.1 一般资料选取2012年1月~2017年5月我院消化内科收治的IBD患者为研究对象。IBD诊断标准:依据2012年广州《炎症性肠病诊断及治疗的共识意见》[5],并经过内镜和组织病理学证实。病理诊断依据《2014年中国炎症性肠病病理诊断共识意见》[6]。UC诊断内容为:临床严重程度(轻、中、重),临床类型(初发型、复发型),病情分期,病变范围,肠外表现及并发症。CD诊断内容为:严重程度(缓解期、轻度活动期、中度活动期、重度活动期),临床类型(按照蒙特利尔CD表型分类),肠外表现及并发症。AD诊断参照《临床免疫学》同时符合相应疾病的诊断标准。纳入标准:①符合相关诊断标准者;②处于AD非活动期者;③入院前3个月病情稳定者;④入院前未使用糖皮质激素治疗者;⑤临床资料完整。排除标准:①感染或其他非感染性结肠炎者;②重症感染者;③严重心肺疾病者;④住院期间死亡者;⑤因非IBD原因行胃或肠切除术治疗者;⑥治疗期间放弃治疗出院者。最终纳入符合标准IBD合并AD 62例,同期单纯IBD患者84例。
1.2 方法通过数据库收集所有患者的详细资料,进行回顾性分析,记录患者一般信息、临床类型、病程、分期、分度、病理资料及治疗情况(治疗药物、用药途径等)。按照是否合并AD分为CD+AD组22例,CD组35例,UC+AD组40例,UC组49例,对4组患者的临床流行病学特点进行比较分析。研究获得我院伦理委员会批准。
1.3 统计学方法应用SPSS 19.0软件包行数据处理,正态分布的计量资料采用t检验,非正态分布采用秩和检验,计数资料采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料CD组与CD+AD组、UC组与UC+AD组组间性别、年龄、病变范围差异不明显,差异无统计学意义(P>0.05),CD+AD组病程明显长于CD组,UC+AD组病程明显长于UC组,差异有统计学意义(P<0.05),见表 1、2。

表1 CD组与CD+AD组患者一般资料

表2 UC组与UC+AD组患者一般资料
2.2 临床特征
2.2.1 严重程度 所有CD患者均统计严重程度、临床类型等,CD+AD组轻度活动期患者比例低于CD组,重度活动期患者比例高于CD组,差异有统计学意义(P<0.05),中度活动期患者比例差异无统计学意义(P>0.05),见表 3。

表3 CD组与CD+AD组患者临床特征[n(%)]
所有UC患者统计疾病分期、临床类型及严重程度,UC+AD组轻度患者比例低于UC组,重度患者比例高于UC组,差异有统计学意义(P<0.05),中度患者比例差异无统计学意义(P>0.05),见表4。

表4 UC组与UC+AD组患者临床特征[n(%)]
2.2.2 肠外表现 IBD患者主要肠外表现为关节炎、脂肪肝、口腔溃疡、皮疹等,CD+AD组肠外表现发生率高于CD组,UC+AD组发生率高于UC组,差异均有统计学意义(P<0.05),其中关节炎发生率最高,其次为脂肪肝,见表5。

表5 4组患者肠外表现[n(%)]
2.3 治疗方案所有患者均接受内科治疗,其中2例UC患者转外科手术治疗。治疗药物以氨基水杨酸制剂为主,合并自身免疫病者部分联合糖皮质激素、免疫制剂。轻度患者多采用灌肠给药,中度患者静脉或灌肠给药,重度患者多采用联合给药。常规治疗无效或病情十分严重者给予激素治疗,激素使用率IBD+AD组明显高于IBD组(P<0.05),IBD+AD组有8例使用氨基水杨酸制剂和糖皮质激素治疗效果不佳,改用激素+免疫抑制剂缓解,见表6。
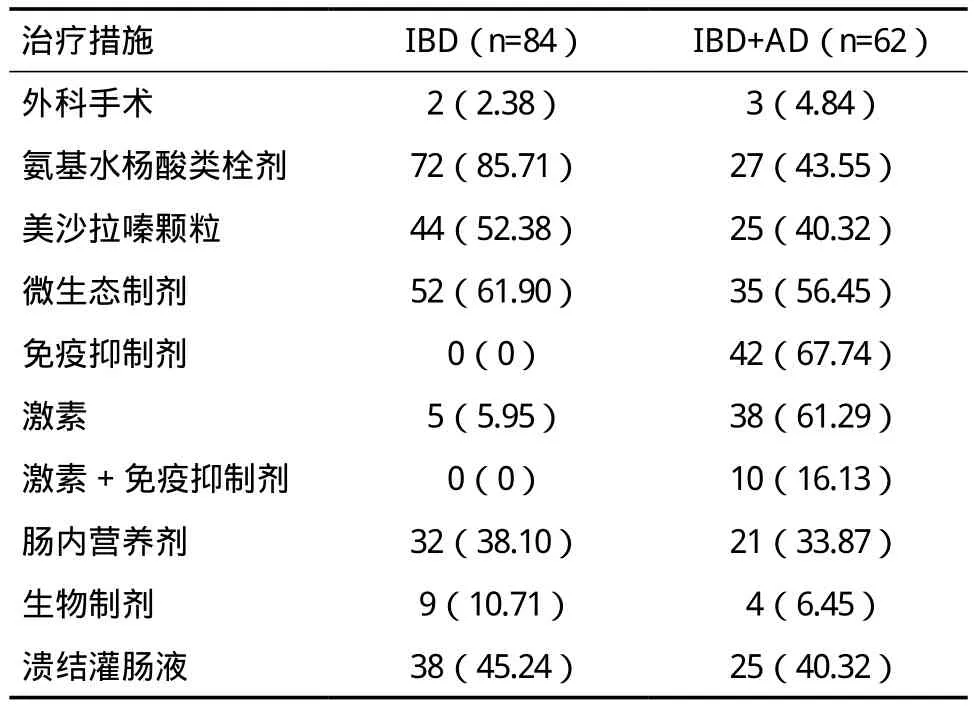
表6 IBD组和IBD+AD组治疗方案[n(%)]
2.4 转归84例IBD患者临床缓解31例(36.90%),有效52例(61.90%),无效1例,转外科手术治疗后缓解。62例IBD+AD患者临床缓解19例(30.65%),有效39例(62.90%),无效4例,转外科手术治疗后3例缓解,1例治疗无效死亡。
3 讨论
IBD是一类由多种病因引起的、肠道慢性复发性炎症,有终生复发倾向。流行病学调查显示,美国、欧洲等发达国家IBD发病率最高,但上升趋势变缓,我国发病率呈逐年上升趋势。AD是指机体免疫系统对自身抗原发生的免疫应答而导致自身组织损害所产生的疾病,既往研究显示,IBD患者合并AD风险远高于非IBD人群[7]。已有研究证实IBD与AD存在遗传上的重叠[8],主要有系统性红斑狼疮、强直性脊柱炎、银屑病和类风湿性关节炎等。IBD合并AD患者病情严重,肠外多器官受累,对患者消化系统整体功能造成不利影响,严重影响患者的健康和生活,故针对IBD合并AD患者的临床特征和治疗方案进行研究具有重要意义。
IBD好发于青壮年人群,其中UC好发于40~49岁人群,CD好发于20~29岁及50~59岁人群。在IBD患者男女构成比上,有研究发现男性高于女性[9],有研究则发现男女比例约为1∶1[10],本资料显示组间性别差异不明显,提示IBD无明显性别倾向。
本资料中CD和UC患者病程多少于2年,UC是诱发直肠癌的高危因素,其癌变率约为4.5%,病程越长,癌变的风险越高,病程超过20年,癌变率为7.00%,病程超过30年,可增加至12.00%[11],故临床上IBD病程超过10年的患者通常进行定期肠镜检查。国外文献报道[12],UC患者左半结肠发病率最高,本资料中左半结肠型最为常见,UC组左半结肠发病率65.31%,UC+AD组左半结肠发病率72.50%,与文献报道一致。欧美国家青壮年CD患者小肠型最多,中老年患者结肠型最多,本资料CD组病变部位以回肠型最多见(17例),CD+AD组末端回肠最多(12例)。所有患者全部为活动期,CD+AD组轻度活动期患者比例低于CD组,重度活动期患者比例高于CD组,UC+AD组轻度患者比例低于UC组,重度患者比例高于UC组,说明合并有AD患者病情严重,多为中、重度。
IBD肠外表现复杂多样,常涉及多个器官,主要为坏疽性脓皮肤、关节炎、结节性红斑、肝胆科疾病等,AD可能出现自身免疫性甲状腺炎、强直性脊柱炎等。国外文献报道[13],IBD肠外表现发生率为25.00%,国内约为14.00%[14],本资料中IBD肠外表现发生率为10.71%(9/84),而IBD+AD肠外表现发生率为53.23%(33/62),明显高于IBD组,可能与IBD合并AD患者病情严重,累及多个器官系统相关。此外有研究表明肠道免疫反应激活产生的特异性人原肌球同工蛋白5抗体或T细胞能够经过机体循环与肠外器官发生免疫炎性反应[15],表明IBD肠道慢性炎性反应可引起肠外组织免疫炎性反应,可能与IBD反复发作,机体持续产生同时针对肠道和结缔组织的刺激因子相关。
IBD药物治疗以氨基水杨酸制剂为主,而IBD合并AD应用氨基水杨酸制剂治疗效果并不理想,改用激素+免疫抑制剂后可以缓解。84例IBD患者临床缓解 31例(36.90%),有效 52例(61.90%),无效1例,转外科手术治疗后缓解。62例IBD+AD患者临床缓解 19例(30.65),有效39例(62.90%),无效4例,转外科手术治疗后3例缓解,1例治疗无效死亡。对于常规治疗无效或病情十分严重的患者给予激素或激素+免疫抑制剂治疗,故IBD+AD组激素使用率明显高于IBD组(P<0.05),说明IBD合并AD患者常规治疗无效可以选择激素或免疫制剂控制病情。
综上所述,IBD合并AD患者临床表现多样性,肠外表现最常见的是关节炎和脂肪肝。常累及多个肠外器官,病情严重,多为中、重度,早期内科药物治疗对于病情缓解有效。
1 涂梦莹,宋丽君.炎症性肠病的诊断和治疗进展[J].实用儿科临床杂志,2012,7:127-129
2 Jong SL,Jee HL,Ji HL,et al.Efficacy of early treatment with infliximab in pediatric Crohn's disease[J].World Journal of Gastroenterology,2010,14:1452-1455
3 谢华,何良梅,刘瑶,等.肠道菌群与炎症性肠病[J].赣南医学院学报,2017,4:86-88
4 康熙雄.临床免疫学[M].北京:人民卫生出版社,2010:373
5 中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2012年,广州)[J].中华消化杂志,2012,32(12):796-813
6 中华医学会病理学分会消化病理学组筹备组,中华医学会消化病学分会炎症性肠病学组.中国炎症性肠病组织病理诊断共识意见[J].中华病理学杂志,2014,43(4):268-274
7 葛文松.炎症性肠病肠外表现的诊治策略[J].中华消化病与影像杂志(电子版),2017,7(3):97-100
8 沈通一,姬彦彬.炎症性肠病微生态和免疫治疗临床进展[J].中国实用外科杂志,2017,37(3):309-312
9 卞莹莹,王洁,李安,等.炎症性肠病的药物治疗现状[J].药学实践志,2017,35(3):197-200,228
10 张夏璐,李冶夫,周平.炎症性肠病肠外临床表现及对应治疗策略的研究进展 [J].世界华人消化杂志,2016,24(6):894-901
11 戎兰.免疫抑制剂在炎症性肠病治疗中的应用[J].上海医药,2016,37(1):11-15
12 Peyrin-Biroulet L,Loftus EV Jr,Colombel JF,et al.Long term complications,extraintestinal manifestations.Andmortality in adult Crohn's disease in population-based cohorts[J].Inflamm Bowel Dis,2014,17(1):471-478
13 Cucino C,Sonnenberg A.The comorbid occurrence of otherdiagnoses in patients with ulcerative colitis and Crohn's disease[J].Am J Gastroenterol,2014,96(7):2107-2112
14 梅晨雪,王恩铭扬,孙妍,等.英夫力西治疗炎症性肠病与肠道菌群改变的相关性研究[J].实用药物与临床,2017,20(4):394-397
15 Kaistha A,Levine J.Inflammatory bowel disease:the classic gastrointestinal autoimmune disease[J].Curr Probl Pediatr Adolesc Health Care,2014,44(11):328-334
