基于小鼠脊髓背侧半切损伤模型的小胶质细胞激活情况的观察
2018-03-26高忠文邹小丽张伯寅朱庆三
高忠文,邹小丽,张伯寅,蔡 军,朱庆三*
(1.吉林大学中日联谊医院 骨科,吉林 长春130033;2.University of Louisville,pediatrics,KY,USA)
脊髓损伤是一种中枢神经系统的严重创伤,常导致灾难性的神经功能障碍,治疗恢复手段十分有限,预后不佳。脊髓损伤的病理过程一般被分为原发性损伤和继发性损伤,原发性损伤主要与受伤原因和暴力严重程度有关,损伤过程主要发生在暴力发生的瞬间或是之后几秒内,所以干预的机会和手段十分有限[1]。继发性损伤是在原发性损伤因素的基础上发生局部出血,细胞坏死,细胞内酶类释放,自由基的生成等所导致局部内环境的紊乱,组织破坏,主要包括炎症反应、神经细胞死亡、轴突脱髓鞘、胶质瘢痕形成等过程,继发性损伤往往更大程度上决定着脊髓损伤患者的预后水平[2]。炎症反应是决定神经功能恢复水平的最重要因素之一,脊髓局部的炎症细胞主要由外来侵入的单核巨噬细胞和局部定居的小胶质细胞组成。在亚急性期和慢性期,随着血脑屏障的重新建立和局部组织的修复,外来细胞难以进入脊髓组织,局部炎症反应主要由小胶质细胞完成。当前对炎症反应在脊髓损伤中作用的基本共识认为,小胶质细胞在发挥吞噬细菌、碎片的有利作用的同时,又具有持续的组织破坏作用。所以,调控脊髓损伤后的小胶质细胞激活水平,控制局部组织相关炎症因子的释放是减轻脊髓继发性损伤,促进神经功能恢复的重要研究方向和治疗目标。本研究采用脊髓背侧半切损伤的小鼠模型观察局部小胶质细胞激活和相关炎症因子的合成情况。
1 材料与方法
1.1试验动物和分组
本试验研究对象采用的是C57BL/6品系野生型Wt小鼠,小鼠均来自于美国Louisville大学蔡军博士实验室提供(6-7周龄,20-24 g)。每组小鼠雌雄数量相当,试验动物分为两组,损伤组和对照组。分别在术后4,7,14,35,42天作为观察点取材,每个时间点实验动物不少于6只,中途死亡需另外补全。
1.2动物模型的制作
麻醉生效后,小鼠取俯卧位,颈后部剃毛,定位颈项部上下方最突起点即为C3和T2棘突,取正中切口1.5-2.0 cm,仔细剥离从C3至T2颈椎椎板上附着的肌肉等软组织。自T2棘突向上查数棘突,定位目标节段C5-6节段,微型剪刀轻轻水平剪开硬膜,显露脊髓。将小鼠固定到脊髓切割装置LISA上,在显微镜下微调刀刃,轻轻接触脊髓表面,刀刃对脊髓进行高频摆动切割(100-150次/s,摆幅5度),切割深度0.70 mm。切口整齐为合格,依次缝合皮下,皮肤组织,术后给与腹腔注射1 ml 0.9%生理盐水补液,随后置小鼠于保温毯上麻醉复苏。损伤组小鼠腹腔内注射0.9%生理盐水,1 ml/次,2次/每日,术后常规护理1周。对试验动物的处理均依照Louisville大学研究资源中心的有关规定执行。
1.3主要试验和药品
GFAP(1∶500,rabbit,Abcam),CD68(1∶50,rat,Abcam),GFAP(1∶200,mouse,igG1,Santa Cruz),IL-6(1∶2 000,mouse,Cell Signaling),OCT (Sakura Finetek,USA),β- Actin(1∶1500,rabbit,Santa Cruz)。
1.4检测方法和指标
分别在术后4,7,14,42天收集新鲜脊髓标本,主要步骤为小鼠全麻生效后,打开胸腔,经左心室穿刺灌流0.9%生理盐水10-15 ml,切取颈段脊柱,打开椎管,以C5-6为中心截取脊髓,上下各保留0.5 mm,将脊髓组织置于液氮中快速冰冻留存备用。采用 Western Blot 的方法检测两组标本不同时间点 IL-6的合成水平。
分别在术后4,7,14,35天收取新鲜脊髓标本,主要步骤为小鼠全麻生效后,打开胸腔,经左心室穿刺灌流0.9%生理盐水10-15 ml,继续4%多聚福尔马林液(4% PFA)灌流固定。灌流完毕后,切取颈段脊柱,在显微镜下剪开椎板,打开椎管,以损伤处为中心截取完整脊髓组织2.0cm,对照组同样截取同等大小脊髓组织。将标本置于30-40 ml 4%PFA中浸泡过夜,第二日换到20%蔗糖液(20% sucrose buffer)中脱水过夜,采用OCT包埋,置于-80℃冰箱保存备用。
1.5统计学分析
本实验所获取数据采用均数±标准差的形式进行统计,利用SPSS17.0 软件和IMAGE图像处理软件进行统计分析处理,所得数据采用单因素方差分析,以P值<0.05代表统计学上的显著性差异。
2 结果
2.1脊髓损伤局部小胶质细胞激活情况的观察
脊髓损伤区域可见明显CD68+染色细胞,CD68是小胶质细胞激活的特异标志物,可以反映小胶质细胞的激活状态。在术后第4天,可见脊髓组织开放缺损,缺损中心可见明显的CD68+小胶质细胞激活;在术后第7天,脊髓组织缺损被闭合,组织有效修复,损伤区域周围可见更多的小胶质细胞激活,周围区域内小胶质细胞表现出向损伤中心迁移聚集的趋势;在术后第14天,损伤区域为中心的脊髓组织内小胶质细胞激活数量达到峰值水平;在术后第35天,小胶质细胞的激活已经减弱,但是仍有部分处于激活状态。见图1。
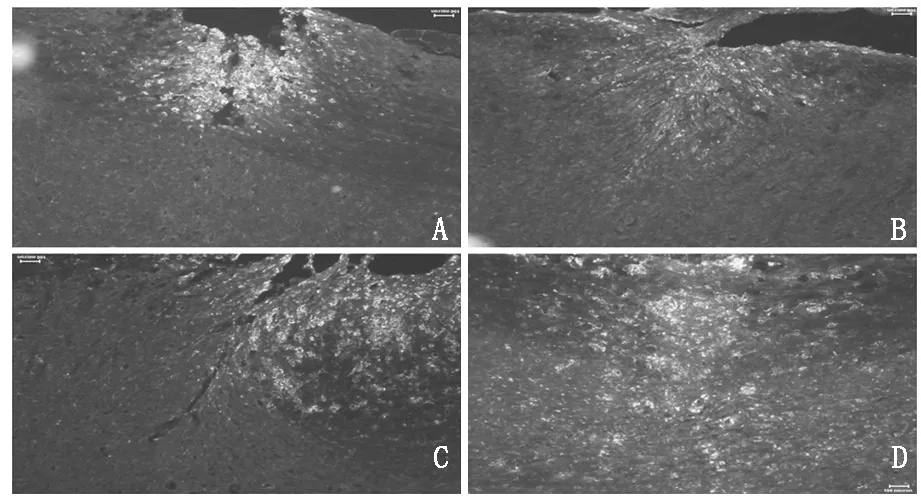
图1脊髓损伤局部CD68+小胶质细胞激活情况(A-D分别为术后4,7,14,35天,CD68为绿色荧光标记,蓝色为细胞核DAPI染色)
2.2脊髓损伤局部组织内IL-6的表达情况
Western Blot的结果显示:损伤组脊髓损伤后组织内的IL-6的合成较对照组增强;术后第7天(7dpi),IL-6的合成明显升高;术后第42天(42dpi),IL-6水平已经明显下降,但是仍然高于对照组水平(P<0.05)。见图2。
3 讨论
在脊髓损伤过程中,随着血脑屏障的破坏,血液循环中的单核巨噬细胞侵入到损伤区域,和局部定居的小胶质细胞共同在继发性损伤中发挥着重要的作用。研究结果显示,在脊髓损伤发生12-24小时之后,小胶质细胞和外来单核巨噬细胞快速激活出现在脊髓损伤区域;在伤后4-8天时,损伤区域炎症细胞的数量达到高峰,随后缓慢下降并进入慢性炎症反应阶段[3]。由于缺乏特异性的抗原标志物来鉴别定居的小胶质细胞和外来侵入的单核巨噬细胞,所以无法区别脊髓损伤炎症反应过程中的主要细胞来源。在我们的研究中发现,脊髓损伤后早期,首先是损伤中心脊髓组织内的小胶质细胞快速激活;至术后第7天可以观察到周围灰质和白质中小胶质细胞发生激活样形态学变化,并向损伤中心迁移、聚集;在术后第7-14天,激活小胶质细胞的表达在损伤组织中达到峰值;同时,IL-6表达水平亦在术后第7天时呈高表达状态,随后随着时间的推移,IL-6水平逐步下降,其表达水平的变化与损伤区域小胶质细胞的激活聚集的情况变化相一致。我们的结果与其它文献中报道的小胶质细胞在脊髓损伤中的激活过程相似[4]。

图2 脊髓损伤后脊髓局部组织内IL-6的表达情况(Sham为对照组,SCI为损伤组)
早期的研究认为小胶质细胞在脊髓损伤中的作用是负面的,激活的小胶质细胞除了吞噬细菌、组织碎片之外,自身还释放大量的炎症介质,激活的小胶质细胞除了消灭“有害物质”之外,还对正常的神经细胞产生杀伤作用,导致神经轴突脱髓鞘,星形胶质细胞活化,局部胶质瘢痕的形成等,形成对神经细胞有害的局部微环境[5]。近几年的一些研究发现,小胶质细胞合成一些神经营养因子如NT-3、BDGF等,具有促进神经细胞存活的作用;此外,小胶质细胞还能合成具有促进神经轴突再生延伸作用的神经生长因子如NGF、IGF-1等[6,7]。所以,采用相关的治疗手段,控制损伤局部的炎症反应在“适当”程度内,抑制小胶质细胞的过度激活,减少相关促炎因子的合成,从而发挥小胶质细胞的保护性作用。
最近的研究结果显示,根据细胞表面特异性标志物的不同,小胶质细胞的激活过程中可以发生两种不同的表型分化(M1和M2型)。M1型小胶质细胞主要提高免疫水平,合成促炎因子(TNF-α、IL-1、IL-6),M2型小胶质细胞则具有抑制细胞免疫状态,释放抑炎因子(IL-4、IGF-1、IL-10)等[8]。这两种表型分化在小胶质细胞的激活过程中是可以进行相互转化,有研究中发现,在损伤一周内,损伤区域周围可以观察到M1和M2两种表型分化;而在损伤后28天,损伤区域只能观察到M1型小胶质细胞激活,通过调控小胶质细胞向M2表型定向分化和M1表型小胶质细胞向M2表型的转化,小鼠的神经运动功能相应地得到了更好的恢复[9]。
综上我们认为,炎症反应与脊髓损伤的预后具有密切的关系,控制脊髓损伤后小胶质细胞的激活状态,调控小胶质细胞的表型分化是调节脊髓损伤后炎症反应水平,促进运动功能恢复的重要研究方向和重要途径之一。
[1]David S,Kroner A.Repertoire of microglial and macrophage responses after spinal cord injury.Nature reviews[J].Neuroscience,2011,12(7):388.
[2]Kong X,Gao J.Macrophage polarization:a key event in the secondary phase of acute spinal cord injury[J].Journal of cellular and molecular medicine,2017,21(5):941.
[3]Okada S.Astrocyte reactivity and astrogliosis after spinal cord injury[J].Neuroscience research,2018,126:39.
[4]Hausmann ON.Post-traumatic inflammation following spinal cord injury[J].Spinal cord,2003,41(7):369.
[5]何 娟,王忠华.电针对脊髓损伤大鼠星形胶质细胞的影响及机制[J].西安交通大学学报(医学版),2013,02:253.
[6]Zhou X,X He,Y Ren.Function of microglia and macrophages in secondary damage after spinal cord injury[J].Neural regeneration research,2014,9(20):1787.
[7]Arnold SA,T Hagg.Anti-inflammatory treatments during the chronic phase of spinal cord injury improve locomotor function in adult mice[J].Journal of neurotrauma,2011,28(9):1995.
[8]Ransohoff RM.A polarizing question:do M1 and M2 microglia exist[J]?Nature neuroscience,2016,19(8):987.
[9]Gensel JC,Zhang B.Macrophage activation and its role in repair and pathology after spinal cord injury[J].Brain research,2015,1619:1.
