糖基化大豆分离蛋白对鲤鱼鱼糜凝胶和乳化特性的影响
2018-03-24
(三亚航空旅游职业学院,海南三亚572000)
鲤鱼,由于其养殖效益高、生长速度快、加工便利、营养价值丰富深受我国受广大消费者的喜爱。鱼蛋白营养丰富,脂肪含量少,口感细嫩,味道鲜美,含有多种人体必需氨基酸,且能制备合成某些功能特性的酶解蛋白,可一定程度上帮助提高人体的调节功能。但其溶解性和热稳定较差。近年来,采用糖基化反应对蛋白改性的研究较多,糖基化反应可以有效的改善鱼蛋白的功能特性。糖基化反应后蛋白的溶解性会发生显著的增加,会抑制相同条件下结构展开的蛋白质间的相互作用,能有效地提高蛋白质的热稳定性。
大豆分离蛋白(Soybean protein isolate,SPI)是以低温豆粕为原料分离提取的一种蛋白质含量在90%以上的高纯度蛋白质[1],不含胆固醇,其中氨基酸种类丰富,并含有人体必需氨基酸,其具有良好的功能性质和较高的营养价值,大豆分离蛋白缺乏良好的溶解性、乳化能力且具有致敏原,为了充分利用其营养价值使人体更好的吸收利用,往往对其进行改性处理。孔杭如等[2]研究表明优化牦牛肌原纤维蛋白(Myofibrillar protein,MP)和热改性 SPI形成混合凝胶,二者的不同比例对肉蛋白凝胶性质的影响不同,添加较低比例的热改性SPI能很好的提高蛋白凝胶的特性。王博等[3]研究发现在肉蛋白添加一定比例的糖基化SPI能显著提高蛋白乳化活性和乳化稳定性,改善凝胶硬度和弹性,增加溶解性,且较添加天然SPI有着显著提升。本研究主要对比添加不同比例的天然SPI和糖基化SPI对鱼糜蛋白功能性质的影响,以探究提高鱼糜类制品产量和品质的最优配比,为鱼类制品的品质改良和工艺优化提供有力的理论依据。
1 材料与方法
1.1 仪器与设备
AL-104型精密电子天平:常州万泰天平仪器有限公司;DK-8B型电热恒温水浴锅:西化仪科技有限公司;PHSJ-4F型实验pH计:上海仪电科学仪器股份有限公司;VORTEX-5漩涡混合器:海门市其林贝尔仪器制造有限公司;TG16-WS型高速离心机:常州市万合仪器制造有限公司;TU-1800紫外-可见光分光光度计:北京普析通用仪器有限责任公司;T18高速匀浆机:德国IKA公司;TA-XT Plus型质构分析仪:英国Stable Micro System公司;CS-10色差仪:杭州彩谱科技有限公司。
1.2 材料与方法
1.2.1 材料与试剂
新鲜活鲤鱼购于生鲜农贸市场,用加冰鱼桶运往实验室,宰杀去皮后,取背部白色肌肉切成小块,存放于4℃冰箱。
1.2.2 糖基化SPI的制备
参照王松等[4]的方法并略加修改,蛋白质量分数为8%,SPI和葡萄糖质量比1∶1溶解,置于70℃恒温水浴中反应4 h,取样冷冻干燥,测定蛋白含量,备用。
1.2.3 鲤鱼肌原纤维蛋白的提取
参考Xiong等[5]的方法进行鲤鱼肌原纤维蛋白的提取。鱼洗净,剔骨,将鱼肉搅碎,加入4倍体积10 mmol磷酸盐、0.1 mol NaCl、2 mmol MgCl2和1 mmolEGTA(pH7.0)配制成的蛋白提取液均质60s。得到的匀浆液在冷冻离心机内(4℃,3 500 r/min)离心15 min后,除去上清液,反复三次。再加入4倍体积的0.1 mol NaCl溶液匀浆,3 500 r/min下离心15 min,重复3次。最后一次均质后用4层纱布过滤,滤液用0.1 mol HCl调节pH至6.0,然后离心滤液取沉淀。提取需在4℃条件下进行,提取后的鱼糜蛋白放置在4℃的冰箱备用。
1.2.4 糖基化SPI与MP的混合
将SPI和糖基化SPI分别添加到鲤鱼肌原纤维蛋白中,按添加量10%、20%、30%、40%、50%进行混合,对混合蛋白进行各指标测定。
1.2.5 肌原纤维蛋白乳化活性和乳化稳定性的测定
根据Pearce等[6]的方法。肌原纤维蛋白匀浆液的乳化活性(Emulsifying activity,EAI)(m2/g)和乳化稳定性(Emulsification stability,ESI)(%),计算公式如下:
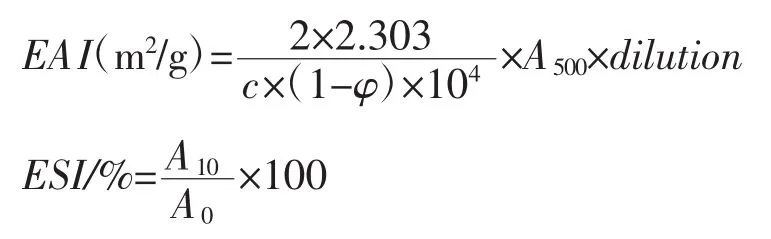
式中:A500为500 nm波长处的吸光度;φ为油相体积分数(φ=0.2%);A0、A10为乳状液在 0、10 min的吸光度;с为乳化形成前蛋白质水溶液中蛋白浓度,(g/mL);dilution为稀释倍数。
1.2.6 凝胶的制备
参照杨明等[7]的方法进行凝胶制备并略作修改。配制鲤鱼肌原纤维蛋白浓度为40 mg/mL,添加不同比例SPI和糖基化SPI,将溶液放入30 mm×50 mm密封的玻璃瓶中,75℃的水浴锅中加热20 min,放置于室温(24℃~26℃)下冷却,4℃冰箱过夜,再进行指标测定。
1.2.7 凝胶质构(Textureprofileanalyse,TPA)的测定
蛋白凝胶室温下放置30 min,将待测样品固定在测样台上,利用物性分析仪进行凝胶硬度和凝胶弹性的测定,采用质构剖面分析法(TPA)对凝胶质构进行检测。
1.2.8 混合蛋白表面疏水性的测定
根据Chelh等[8]的方法测定。其中,溴酚蓝空白样是用1 mL的pH 6.0的磷酸盐缓冲液加200 μL溴酚蓝,磷酸盐缓冲液作空白样(A空白)。表面疏水性以溴酚蓝结合量表示,公式如下。
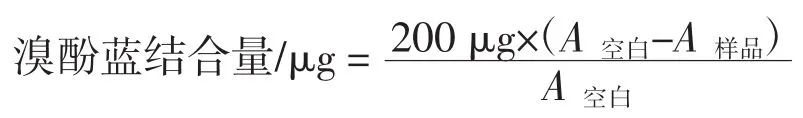
式中:A空白为对照组的吸光值;A样品为处理组的吸光值。
1.2.9 凝胶白度值的测定
使用CS-10色差计测定凝胶的色差,即L*值,a*值,b*值。试验过程中每个样品均进行3次平行试验,试验结果取平均值。并根据Park[9]的方法进行白度值计算(Whiteness):
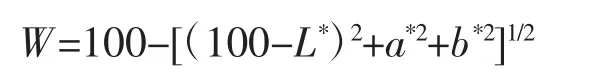
1.2.10 数据统计分析方法
本试验均做3次独立的重复试验。用Statistix 8.1软件包GeneralLinear Models程序进行数据分析,用SigmPlot 12.0软件进行作图。
2 结果与分析
2.1 糖基化SPI对凝胶硬度、弹性和黏结性的影响
图1为不同添加比例的SPI和糖基化SPI与肌原纤维蛋白复配对凝胶硬度、弹性和黏结性的影响(顺序分别为a,b和c)。
由图1可知:添加比例的SPI和糖基化SPI的处理组相较于仅含有肌原纤维蛋白的对照组来说,凝胶硬度、弹性和黏结性均呈现显著下降的趋势(P<0.05),且随着添加比例的增加,二者的凝胶品质特性下降更为显著,同时,在同一添加比例下,添加SPI也比糖基化SPI的凝胶硬度、弹性和黏结性下降更为显著(P<0.05),添加糖基化SPI较SPI能有效的减缓凝胶品质的劣变。硬度和弹性在凝胶形成中起重要的作用,也是评价凝胶品质的重要指标。随着SPI和糖基化SPI添加比例的增加,凝胶硬度和弹性显著降低,因为在相同质量分数情况下,混合蛋白体系中添加大豆分离蛋白越多,肌原纤维蛋白也被稀释,当添加比例的SPI和糖基化SPI与肌原纤维蛋白相同时,凝胶强度、弹性和黏结性最低,主要由于过多的添加其他蛋白会削减了肌原纤维蛋白间二硫键和疏水相互作用[3,10],导致形成的凝胶网络结构稳定性较差,凝胶强度和弹性也显著降低。可能由于SPI的分子空间位阻较强以及分子间二硫键较少,而糖基化SPI经过改性引出糖链,可与肌原纤维蛋白更好的结合[11]。
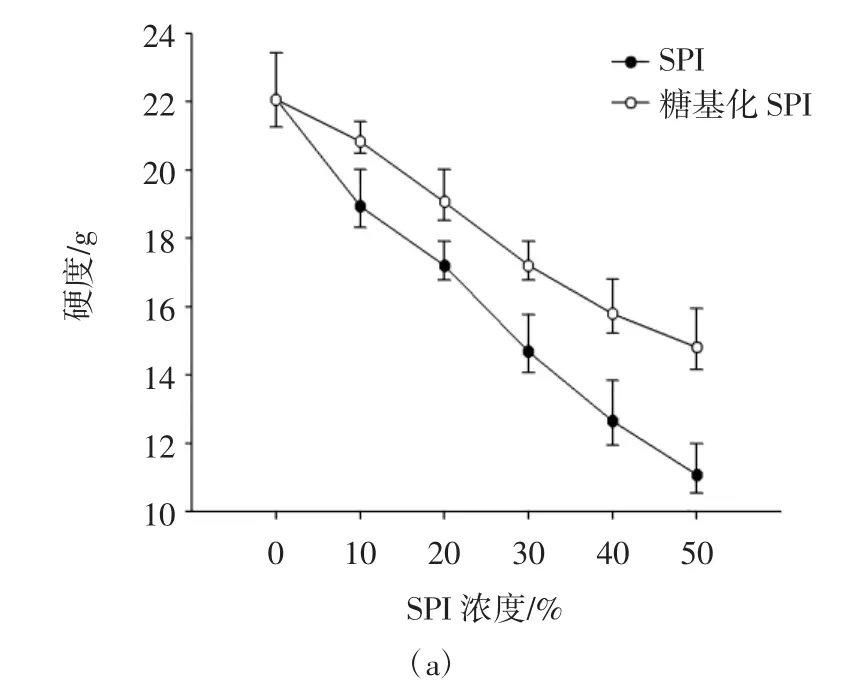
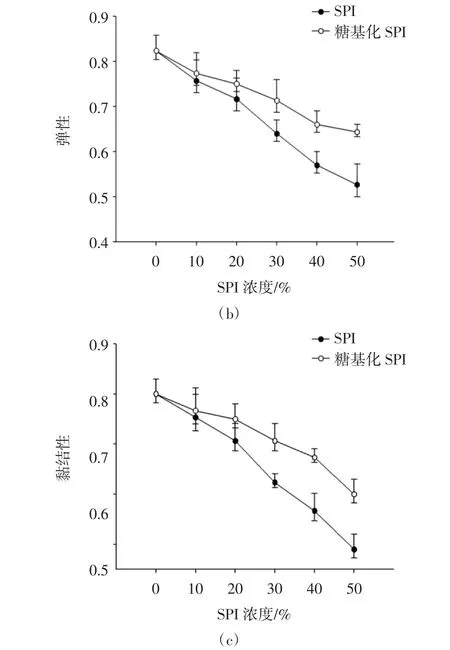
图1 糖基化SPI对MP凝胶质构的影响Fig.1 Effect of glycosylated SPI on the texture profile analysis of myofibrillar protein gels
2.2 糖基化SPI对肌原纤维蛋白乳化性能的影响
图2为添加不同比例的SPI、糖基化SPI和混合蛋白乳化活性(EAI,a)及乳化稳定性(ESI,b)的变化。
从图2可看出,添加SPI、糖基化SPI的混合蛋白乳化活性均高于纯肌原纤维蛋白,随着添加比例的增加呈现显著上升的趋势。且在同一添加比例条件下,糖基化SPI混合蛋白的乳化活性和乳化稳定性显著高于SPI混合蛋白(P<0.05)。SPI是一种优良的天然乳化剂,但由于其较差的溶解性限制了其乳化性能的发挥。SPI球蛋白可经加热后形成可溶性聚集束通过相互随机连接,这些聚集束最后通过疏水键形成了凝胶,具有独特的凝胶性、持水(油)性、乳化稳定性等一系列功能特性,在肉制品中应用较多;糖基化SPI经改性处理后引入了亲水羟基,添加到产品中,水分和油脂能够被有效地固定在凝胶网络结构中,其固定能力要显著优于添加SPI形成的凝胶[12]。蛋白质和糖类都有稳定的水包油乳化功能特性,乳化过程中蛋白质吸附在油水界面形成黏弹性的保护层,因此蛋白质-糖混合物应该具有很好的乳化特性。此外,鱼肌原纤维蛋白与多糖类的混合物具有良好的乳化活性及乳化稳定性[13]。研究表明,糖基化SPI改性后黏度增强,在混合蛋白体系中,增强蛋白吸附油脂的能力,从而提高体系的乳化稳定性。但当糖基化SPI比例过大时,混合蛋白的亲水性增强,会破坏油水界面上的稳定平衡,导致乳化稳定性下降[14]。
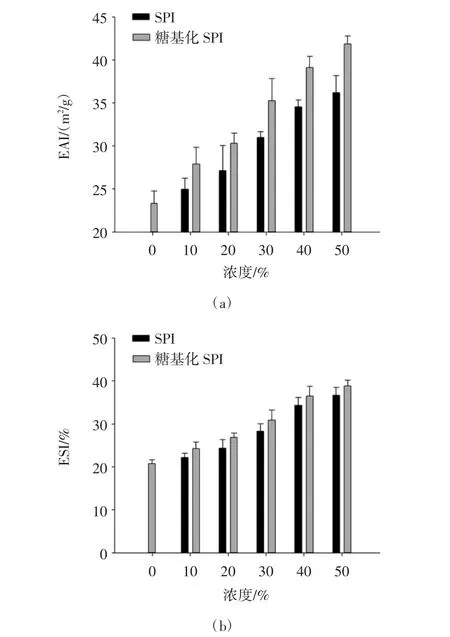
图2 糖基化SPI对MP乳化活性和乳化稳定性的影响Fig.2 Effect of glycosylated SPI on the emulsifying activity and emulsifying stability of myofibrillar protein
2.3 糖基化SPI对肌原纤维蛋白表面疏水性的影响
图3表示添加不同比例的SPI和糖基化SPI对混合蛋白表面疏水性的影响。
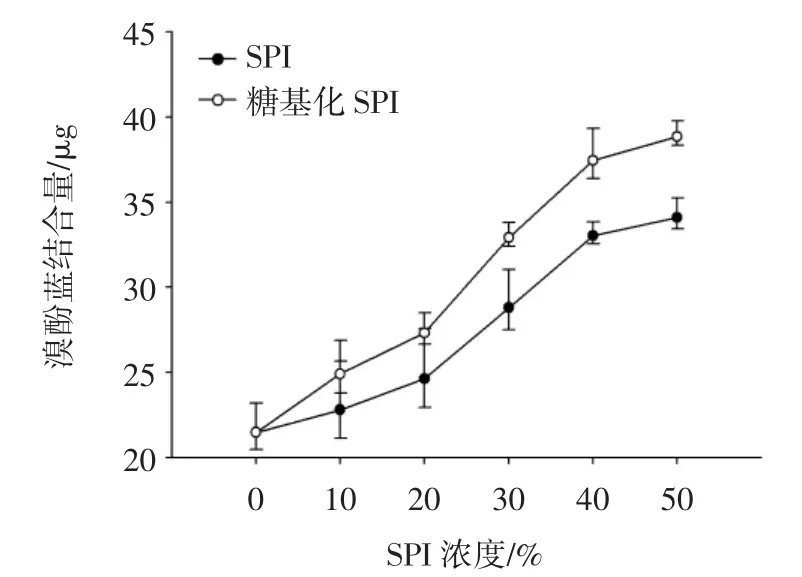
图3 糖基化SPI对肌原纤维蛋白表面疏水性的影响Fig.3 Effect of glycosylated SPI on the surface hydrophobicity of myofibrillar protein
添加SPI和糖基化SPI的混合蛋白的表面疏水性与对照组相比均显著提高(P<0.05),且随着二者所占比例的增加呈现显著上升的趋势(P<0.05)。在同一复配比例条件下,糖基化SPI混合蛋白的表面疏水性显著高于SPI混合蛋白(P<0.05)。当SPI和糖基化SPI的添加量为50%时,混合蛋白的表面疏水性分别为MP的1.7和2倍。由于未改性SPI复配具有紧密的四级和三级结构使得多数的疏水性基团积聚并埋藏在分子内部,导致其乳化性和溶解性较差[15]。而糖基化SPI改性后,蛋白分子结构展开使埋藏在内部的更多疏水基团暴露出来,发生糖基化反应后蛋白的溶解性显著的增加,可与肌原纤维蛋白进行相互作用,从而可以显著提高混合蛋白的表面疏水性[16]。
2.4 糖基化SPI对凝胶白度值的影响
图4为添加不同比例的SPI、糖基化SPI混合凝胶的白度值变化。
SPI和糖基化SPI混合凝胶的白度值均低于MP凝胶对照组,并且随着SPI和糖基化SPI添加比例的增大,混合凝胶的白度值呈显著降低的趋势(P<0.05)。因为SPI本身呈现淡黄色,向MP凝胶中添加SPI自然会使得其白度值降低[14],同时,SPI在糖基化改性过程中会形成褐色色素类物质,添加到肌原纤维蛋白中使得凝胶白度显著降低(P<0.05),但SPI、糖基化SPI添加量较小,其为10%时对凝胶白度影响不大。从图中可看出,SPI混合凝胶的白度值略高于糖基化SPI混合凝胶,但二者差异不显著(P>0.05)。由于糖基化SPI会对肉制品颜色有不利的影响,在生产加工应用时,应选择较适宜的添加比例。
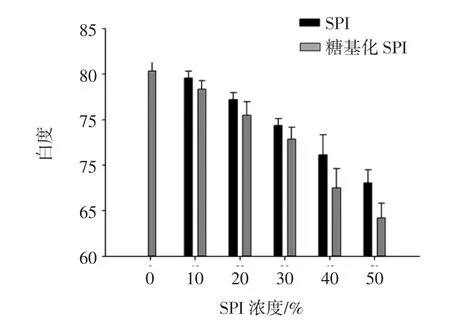
图4 糖基化SPI对MP凝胶白度值的影响Fig.4 Effect of glycosylated SPI on the whiteness of myofibrillar protein gels
3 结论
通过对混合蛋白凝胶质构特性、乳化性质、表面疏水性及白度值的测定,可得出添加糖基化SPI的混合凝胶的硬度、弹性和黏结性均显著优于添加SPI的混合凝胶(P<0.05);糖基化 SPI混合凝胶的乳化活性和乳化稳定性较SPI混合凝胶也有显著提升(P<0.05),且添加量越大乳化活性增强越显著;糖基化SPI混合凝胶和SPI混合凝胶的表面疏水性均显著高于纯肌原纤维蛋白(P<0.05),且添加量越大表面疏水性越好,糖基化SPI的表面疏水性显著优于SPI;此外,混合凝胶的白度值比纯肌原纤维蛋白凝胶有所降低,在SPI和糖基化SPI添加量为10%时,差异均不显著(P>0.05)。本研究得出,糖基化SPI比天然SPI溶解性和乳化性更好,可以显著提高鱼蛋白的凝胶和乳化特性,从而充分的利用鱼糜制品的营养价值。
[1]陈欣,周春霞,洪鹏志,等.糖基化改性对罗非鱼肉肌原纤维蛋白功能特性的影响[J].现代食品科技,2010,26(8):793-796
[2]孔杭如,孙莎,唐善虎,等.牦牛肌原纤维蛋白与热改性大豆分离蛋白共凝胶条件的优化[J].食品科学,2015,36(14):44-49
[3]王博,伊东,谢梦颖,等.糖基化大豆分离蛋白对肌原纤维蛋白功能特性的影响[J].食品科学,2017,38(7):63-69
[4]王松,夏秀芳,黄莉,等.湿法糖基化改性对大豆分离蛋白功能性质的影响[J].食品科学,2014,35(9):38-42
[5]Xiong Y L,Noel D C,Moody W G.Textural and sensory properties of low-fat beef sausages with added water and polysaccharides as affected by pH and salt[J].Journal of Food Science,2010,64(3):550-554
[6]Pearce K N,Kinsella J E.Emulsifying properties of proteins:Evaluation of a turbidimetric technique[J].Journal of Agricultural&Food Chemistry,1978,26(3):716-723
[7]杨明,孔保华,董和亮,等.马铃薯淀粉对鲤鱼肌原纤维蛋白功能特性的影响[J].食品工业科技,2013,34(14):169-172
[8]Chelh I,Gatellier P,SantéLhoutellier V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat Science,2006,74(4):681
[9]Park J W.Functional Protein Additives in Surimi Gels[J].Journal of Food Science,1994,59(3):525-527
[10]陈怡岑,彭宏刚,曹艳婷,等.TG和大豆分离蛋白对猪PSE肉丸保水性和硬度的影响[J].食品工业,2015(10):218-222
[11]李杨,梁婧,王中江,等.肌原纤维蛋白与大豆分离蛋白复合体系乳化性的研究[J].食品工业科技,2014,35(23):140-144
[12]Ventureira J,Martínez E N,Añón M C.Stability of oil:water emulsions of amaranth proteins.Effect of hydrolysis and pH[J].Food Hydrocolloids,2010,24(6/7):551-559
[13]Sato R,Sawabe T,Kishimura H,et al.Preparation of neoglycoprotein from carp myofibrillar protein and alginate oligosaccharide:improved solubility in low ionic strength medium[J].Journal of Agricultural&Food Chemistry,2000,48(1):17
[14]杨振.魔芋粉、转谷氨酰胺酶和大豆分离蛋白对鲤鱼肌原纤维蛋白凝胶特性的影响[D].哈尔滨:东北农业大学,2012
[15]郭凤仙,熊幼翎,何志勇,等.热处理对大豆分离蛋白功能特性的影响[J].食品与机械,2009,25(6):9-11
[16]夏秀芳,洪岩,郑环宇,等.湿法糖基化改性对大豆分离蛋白溶解性和乳化能力的影响[J].中国食品学报,2016,16(1):167-172
