不同提取方法对苦荞淀粉理化特性的影响
2018-03-24张伟丽白文明王鹏科杨清华任慧莉高金锋
张伟丽,白文明,王鹏科,杨清华,任慧莉,高金锋
(西北农林科技大学农学院/旱区作物逆境生物学国家重点实验室,陕西杨凌712100)
苦荞(Fagopyrum tataricum L.Gaertn)属于蓼科荞麦属,起源于中国西南部和喜马拉雅山[1]。我国是世界苦荞的主产区,栽培历史悠久,种植区主要集中在西南地区的四川、云南、贵州以及西北地区的山西、陕西、宁夏、甘肃、内蒙古等省区[2]。苦荞具有丰富的营养价值,是一种医食同源作物[3]。随着生活水平的不断提高,人们对苦荞的需求正日益增加[4]。淀粉是苦荞的主要组分,含量约为70%,其理化特性影响着苦荞麦制品的功能和营养特性[5-6]。
目前,提取淀粉的方法主要有碱提法、水提法、表面活性剂浸泡法、酶法、超声波法等。高粱、绿豆、扁豆淀粉的提取常采用水提法,水提法属于物理提取法,可最大程度地保留淀粉的原有品质,但是蛋白质残留率较高;大米、燕麦淀粉则采用碱提法提取,这种方法得到的淀粉糊化温度会有所降低,且易污染环境;小米淀粉则采用表面活性剂浸泡法提取,淀粉中蛋白质残留量低,糊化黏度较高,膨润力好;酶法环保,但成本高、生产周期长、效率较低[7]。碱液提取法是目前最常用的苦荞淀粉制备方法,但是碱处理可以不同程度改变淀粉颗粒的片晶结构、物理特性和消化性能等[8-10]。王琳等研究表明不同质量分数碱液处理会对荞麦淀粉物理特性造成显著影响,尤其是碱液质量分数超过0.24%的时候[11]。王颖等研究了不同提取工艺对糜子淀粉糊化特性的影响,发现与水提法相比,碱提法提取的糜子淀粉含量、白度、峰值黏度均有所提高,淀粉热糊稳定性、抗老化能力分别降低1.05%和25.1%,糊化温度降低8.05℃[12]。刘航等采用响应面分析法,优化淀粉制备过程中超声波辅助清除黄酮工艺[13];陈燕等研究并优化了酶法提取苦荞淀粉工艺[14]。目前,关于苦荞淀粉提取方法的研究较少,鲜有报道。因此,本试验通过碱提法、水提法、小苏打提取法等3种方法提取苦荞淀粉,比较其提取的苦荞淀粉颗粒形态、直链淀粉含量、透明度、凝沉特性、溶解度、糊化特性等基本理化特性差异,以期获得适宜的苦荞淀粉提取方法,旨在为苦荞淀粉提取工艺及加工利用提供技术参考。
1 材料与仪器
1.1 试验材料与试剂
试验材料所用苦荞品种为西农9940,由西北农林科技大学小宗粮豆课题组提供,为2015年收获籽粒。选取大小均匀一致,籽粒饱满,色泽正常的籽粒500 g,用于淀粉提取。
所用试剂均为分析纯。
1.2 仪器与设备
KQ-500DE型数控超声波清洗器:昆山市超声仪器有限公司;Blue Star B分光光度计:北京莱伯泰科仪器股份有限公司;DA7250近红外分析仪:波通瑞华科学仪器(北京)有限公司;RVA-4500快速黏度分析仪:波通瑞华科学仪器(北京)有限公司;SEM-6360LV扫描电镜:日本JEOL公司;SF-TDL-5A低速台式大容量离心机:上海菲恰尔分析仪器有限公司;FW-100D高速万能粉碎机:天津鑫博得仪器有限公司;DGX-9243B电热鼓风干燥箱:上海琅玕实验设备有限公司。
2 方法
2.1 碱提法
利用刘瑞[15]的方法,精选苦荞籽粒500 g,用高速万能粉碎机磨粉,过100目筛。按固液比1∶20(g/mL)添加体积分数80%的乙醇,50℃下,功率为500 W的超声波处理30 min对苦荞麦粉中的黄酮类物质进行清除。再以1∶10(g/mL)固液比加入0.3%NaOH溶液,在30℃下磁力搅拌15 min后,置25℃下浸泡22 h后,过200目筛除去粗纤维和其他杂质,得到淀粉粗浆。4 000 r/min离心15 min,去除上清液,再用0.3%的NaOH溶液洗涤淀粉沉淀,重复上述操作3次。蒸馏水水洗3遍去除蛋白质,用0.1 mol/L的盐酸调节pH至7.0,在40℃烘箱干燥得到苦荞淀粉,收集置于4℃冰箱中备用。
2.2 水提法
参考并改进李新华等[16]的方法,精选苦荞籽粒500 g,脱壳后用高速万能粉碎机磨粉,过200目筛得到苦荞面粉。按固液比1∶20(g/mL)添加体积分数80%的乙醇,50℃下,功率为500 W的超声波处理30 min对苦荞麦粉中的黄酮类物质进行清除。再以1∶10(g/mL)固液比加入蒸馏水,置30℃水浴锅下浸泡18 h除去蛋白质,静置几分钟,然后倒掉上部悬浊液,置于40℃烘箱干燥。用石油醚除去脂肪,后用乙醇洗去多余的石油醚,最后反复用水洗,置于离心机内,4 000 r/min离心10 min,去除上清液,刮去上层灰色物质,直至只剩下白色物质,将下部白色物质倒在培养皿或烧杯中,在40℃烘箱干燥24 h,即得到苦荞淀粉,收集后装袋置于4℃冰箱中备用。
2.3 小苏打提取法
参照水提法[15]和碱提法[16],精选苦荞籽粒500 g,用高速万能粉碎机磨粉,过200目筛。按固液比1∶20(g/mL)添加体积分数 80%的乙醇,50 ℃下,功率为500 W的超声波处理30 min对苦荞麦粉中的黄酮类物质进行清除。再以1∶10(g/mL)固液比加入0.3%NaHCO3溶液,置30℃水浴锅下浸泡18 h除去蛋白,静置几分钟,然后倒掉上部悬浊液,置于40℃烘箱干燥。用石油醚除去脂肪,后用乙醇洗去多余的石油醚,最后反复用水洗,置于离心机内,以4000r/min离心10 min,去除上清液,刮去上层灰色物质,直至只剩下白色物质,将下部白色物质倒在培养皿或烧杯中,在40℃烘箱干燥24 h,即得到苦荞淀粉,收集后装袋置于4℃冰箱中备用。
2.4 苦荞淀粉的颗粒形态
取少量淀粉均匀地洒在双面胶上并固定于载物台,真空条件下用离子溅射喷镀仪将其喷金,于真空干燥器中干燥保存。测样时,用JSM-6360LV高分辨扫描电镜观察淀粉粒形态与结构。电镜加速电压为10 kV,放大倍数为1 000倍[17]。
2.5 苦荞淀粉中直链淀粉含量
称取样品0.100 0 g,置于试管中,加0.5 mol/L KOH溶液10 mL,置于沸水浴充分搅拌10 min,以蒸馏水定容至50 mL静置。吸取样品液2.5 mL两份(即样品测定液和空白液),均加蒸馏水30 mL,以0.1 mol/L HCl溶液调至pH 3.5左右,样品中加入碘试剂0.5mL,空白液不加碘试剂,然后均定容至50mL。静置30 min,以样品空白液为对照,用l cm比色杯,分别测定480、550 nm时的吸光度。以标准直链淀粉按同样方法得标准曲线方程为y=5.295 9x-0.023 8,R=0.996 9,式中:y为两个波长下测得样品吸光度之差;x为样品中直链淀粉含量。通过标准曲线方程及测得的样品吸光度值计算淀粉样品中直链淀粉含量。
2.6 苦荞淀粉透明度测定
精确称取1.000g淀粉,配制质量浓度为1.0%的淀粉乳,置于沸水浴中加热15min,搅拌并使淀粉糊化完全后,冷却至25℃,以蒸馏水作为空白,在620 nm波长下,用分光光度计测定淀粉糊的透光率[18]。
2.7 苦荞淀粉糊的凝沉曲线
精确称取1.000 g淀粉,配制质量浓度为1.0%的淀粉乳20 mL,置于沸水浴中糊化15 min后冷却至室温,置于25.0 mL的具塞刻度试管中静置,每隔2小时记录上层清液体积,绘制上清液体积对时间的变化曲线,即为淀粉的凝沉曲线[19]。
2.8 苦荞淀粉的溶解度
准确称取0.500 g淀粉,放入50 mL已知质量带盖离心管中,加入25mL蒸馏水,配置浓度为2.0%淀粉乳,振荡摇匀后分别置于60、70、80、90℃水浴锅中水浴30 min,期间每隔5分钟振荡1次,从水浴锅中取出后冷却至室温,用大容量低速离心机以3 800 r/min离心20 min。倒出上清液至已知质量的容器中,105℃条件下烘干至恒重并称重,计算苦荞淀粉溶解度[5]。

式中:SA为苦荞淀粉溶解度,%;m1为上清液中溶出物质量,g。
2.9 苦荞淀粉黏度分析
室温下先利用近红外分析仪(DA7250)测定淀粉水分含量,然后根据快速黏度分析仪(RVA4500)计算需要的淀粉和水分重量,参数设定为:50℃下保温1 min,在3.7 min内升温至95℃,保持2.5 min,然后在3.8 min内冷却至50℃,保持2 min,前10 s内以960 r/min搅拌,之后的整个过程以160 r/min搅拌,整个过程历时13 min。结果由Thermal Cyclefor Windows配套软件分析起糊温度、峰值黏度、谷值黏度、破损值、最终黏度、回生值和峰值时间[20]。
2.10 数据统计与分析
各组试验数据均为3次重复的平行样品值。数据采用Excel2010、SPSS19.0进行统计分析,显著性差异检验采用LSD最小显著差异法(P<0.05)进行分析。
3 结果与讨论
3.1 苦荞淀粉颗粒形态
苦荞淀粉3种提取方法淀粉颗粒形态见图1。
由图1可看出,苦荞淀粉颗粒形态表现为不规则的球形和多角形。不同提取方法苦荞淀粉颗粒形态有一定差异,利用水提取法时苦荞淀粉颗粒形态表现为不规则的球形和多角形,多角形比例较球形高,但颗粒大小却小于球形。碱提取法获得苦荞淀粉颗粒形态多为不规则的多角形,偶见球形颗粒。利用小苏打提取的苦荞淀粉,颗粒之间彼此粘着,分散的淀粉颗粒很少,可能蛋白质未去除干净。通过电镜观察,不同提取方法淀粉颗粒表面塌陷程度为:碱提取法>小苏打提取法>水提取法。

图1 苦荞淀粉3种提取方法淀粉颗粒形态Fig.1 Tartary buckwheat starch's particle morphology of 3 kinds of extraction methods
3.2 苦荞直链淀粉含量
苦荞淀粉3种提取方法直链淀粉含量见图2。

图2 苦荞淀粉3种提取方法直链淀粉含量Fig.2 Tartary buckwheat starch's amylose content of 3 kinds of extraction methods
由图2可知,利用水提法提取的苦荞淀粉中直链淀粉含量显著高于利用后2种方法提取的苦荞淀粉中直链淀粉含量,而利用后2种方法提取的苦荞淀粉中直链淀粉含量之间没有显著差异。直链淀粉是植物淀粉的重要组成部分,也影响着淀粉理化性质,如溶解度、透明度及糊化特性等。
3.3 苦荞淀粉糊透明度
苦荞淀粉3种提取方法淀粉糊的透明度见图3。
淀粉糊的透明度是食品加工上很重要的因素,和其老化程度也有非常大的关系,一般透明度越差越易老化[21]。目前常用透光率来反映淀粉糊透明度的高低,透光率高则说明其透光度高。透光率主要受淀粉粒大小、膨胀性、直链淀粉含量、直链/支链淀粉比率及淀粉糊中膨胀淀粉与非膨胀淀粉颗粒残余数量等因素影响[22]。由图3可知,利用水提法和碱提法提取的苦荞淀粉糊透明度没有显著差异,但二者显著高于利用小苏打提取法提取的苦荞淀粉糊透明度。总体来看,3种方法提取的苦荞淀粉糊透明度较差,可能是由于苦荞淀粉颗粒结构紧密,糊化以后仍存在颗粒状淀粉未完全糊化,其分子重新排列并发生相互缔合程度较高。
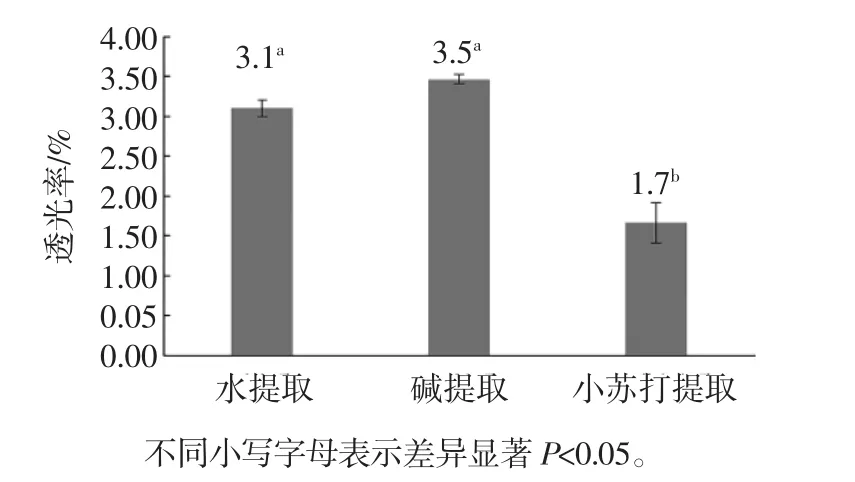
图3 苦荞淀粉3种提取方法淀粉糊的透明度Fig.3 Tartary buckwheat starch paste's transparency of 3 kinds of extraction methods
3.4 苦荞淀粉糊凝沉特性
苦荞淀粉3种提取方法淀粉凝沉曲线见图4。

图4 苦荞淀粉3种提取方法淀粉凝沉曲线Fig.4 Tartary buckwheat starch's sedimentation curve of 3 kinds of extraction methods
淀粉糊的沉降体积反映其形成凝胶的能力,沉降体积越小,形成凝胶的能力就越强[23]。由图4可知,3种不同提取方式下苦荞淀粉糊凝沉速度随着时间延长先增长后趋于稳定,3种提取方式苦荞淀粉糊凝沉速度不同。小苏打提取法下苦荞淀粉糊前期上清液体积增加明显,凝沉速度最快,在6 h时其凝沉体积比为16 mL/20 mL,至此凝沉基本停止;碱提法时苦荞淀粉糊凝沉速度次之,前12 h其淀粉糊凝沉速度较快,12 h时其凝沉体积比为14.5 mL/20 mL,之后上清液体积增加平缓,到22 h其凝沉体积比为15 mL/20 mL;水提法苦荞淀粉糊凝沉曲线与碱提法趋势基本一致,但在前26 h内上清液体积较前者略低,12 h时其凝沉体积比为9 mL/20 mL。淀粉在热水中分成两部分,其中溶解的是直链淀粉,直链淀粉含量高的淀粉生成凝胶的速度较快,从而凝沉性越强[24],这也与本试验中直链淀粉含量测定结果一致。
3.5 苦荞淀粉糊的溶解度
苦荞淀粉3种提取方法不同温度下淀粉的溶解度见图5。

图5 苦荞淀粉3种提取方法不同温度下淀粉的溶解度Fig.5 Tartary buckwheat starch's solubility of 3 kinds of extraction methods at different temperatures
淀粉的溶解主要是直链淀粉从膨胀的淀粉颗粒中逸出后分散在水中导致的结果。由图5可知,从60℃到90℃范围内,利用3种不同提取方式提取的苦荞淀粉溶解度都随着温度增加呈现增长趋势。在60℃时,利用水提法、碱提法、小苏打提取法提取的苦荞淀粉溶解度分别为8.70%、8.81%和5.07%;在90℃时,利用水提法、碱提法、小苏打提取法提取的苦荞淀粉溶解度分别为13.68%、10.91%和7.89%。其中利用水提法提取的苦荞淀粉在80℃~90℃范围内呈现剧烈增长的趋势。3种提取方法制得的苦荞淀粉溶解度均随温度升高而升高,这是随着温度不断升高,加剧了淀粉颗粒的结晶结构破坏程度,使得淀粉颗粒结晶区中氢键断裂数目增多,游离水更易于渗入淀粉颗粒内部,因此溶解度提高[24-25]。
3.6 苦荞淀粉的糊化特性
苦荞淀粉3种提取方法淀粉糊化性质见表1。
由表1可知,3种不同提取方法苦荞淀粉糊化特性存在较大差异。方差分析表明,3种不同提取方法下苦荞淀粉峰值黏度、终值黏度、破损值及回生值彼此间均表现出显著性差异;水提取法、碱提取法制得苦荞淀粉谷值黏度显著高于小苏打提取法;碱提取法苦荞淀粉的糊化温度显著高于水提法和小苏打法。碱提法制得苦荞淀粉的峰值黏度最大,显著高于其他2种方法;小苏打法提取的谷值黏度最小,显著低于其他2种方法提取的苦荞淀粉谷值黏度;碱提法提取的苦荞淀粉破损值最大,为2 480.5 CP,显著高于利用水提取法和小苏打提取法;小苏打提取方法制得苦荞淀粉终值黏度最大,为6 845 CP,显著高于其他2种方法,可能与小苏打的性质有关[12]。水提取法提取的苦荞淀粉回生值最小,显著小于其他2种方法制得苦荞淀粉回生值,回生值越大,越易老化,热稳定越差[26],说明用水提法制得苦荞抗老化能力较强、热稳定性较好;利用碱提取法提取的苦荞淀粉糊化温度最大,为73.55℃,显著高于利用水提取法和小苏打法提取的苦荞淀粉糊化温度。

表1 苦荞淀粉3种提取方法淀粉糊化性质比较Table 1 Comparison of tartary buckwheat starch's gelatinization properties of 3 kinds of extraction methods
4 结论
利用不同提取方法提取苦荞淀粉对苦荞淀粉理化性质结果有一定差异。水提取法和碱提取法制得的苦荞淀粉颗粒中球形颗粒所占比例明显较大且淀粉颗粒表面塌陷程度较低,而小苏打提取法下制得的苦荞淀粉中蛋白质残留较高,导致淀粉颗粒之间彼此粘着。水提取法和碱提取法制得的苦荞淀粉在透明度、谷值黏度上均无显著差异,在凝沉曲线上表现趋势基本一致,但和小苏打提取法制得苦荞淀粉有显著差异。水提法制得的苦荞淀粉中直链淀粉含量显著高于碱提法和小苏打法制得的苦荞淀粉中直链淀粉含量,与溶解度和凝沉曲线变化趋势一致。3种提取方法制得苦荞淀粉在峰值黏度、破损值、回生值均表现出显著性差异,碱提法制得苦荞淀粉的峰值黏度、破损值和糊化温度最高,显著高于其他2种方法;水提法制得苦荞淀粉的回生值最低,显著低于其他2种方法。综上所述,小苏打提取方法不适合用于苦荞淀粉的提取;碱提法制得的淀粉热糊稳定性好、黏度高,但抗老化能力差,同时会产生大量碱液,造成环境污染。而水提法制得的苦荞淀粉溶解性好、抗老化能力强、热糊稳定性好,且较少影响淀粉的品质。因此,水提法是苦荞淀粉提取最适宜的方法。
[1]张玲,高飞虎,高伦江,等.荞麦营养功能及其利用研究进展[J].南方农业,2011(6):74-77
[2]阎红.荞麦的应用研究及展望[J].食品工业科技,2011(1):363-365
[3]惠丽娟.荞麦及荞麦食品研究进展[J].粮食加工,2008(3):78-80
[4]刘航,国旭丹,马雨洁,等.苦荞淀粉制备工艺及其性质研究[J].中国食品学报,2013(4):43-49
[5]周小理,周一鸣,肖文艳.荞麦淀粉糊化特性研究[J].食品科学,2009(13):48-51
[6]杨政水.苦荞麦的功能特性及其开发利用[J].食品研究与开发,2005(1):100-103
[7]Bergthaller W,Themeier H,Lepa R.Extraction of starch and protein from pea mutant cotyledon breaks in a pilot plant by applying neutral media and enzyme technology[C]//towards the sustainable production of healthy food,feed and novel products.Cracow:Proceedings of the 4th European Conference on Grain Legumes,2001:386-387
[8]Cai J W,Yang Y,Man J M,et al.Structural and functional properties of alkali-treated high-amylose rice starch[J].Food Chemistry,2014,145(15):245-253
[9]Wang S,Copeland L.Effect of alkali treatment on structure and function of pea starch granules[J].Food Chemistry,2012,135(3):1635-1642
[10]Wang S,Luo H,Zhang J,et al.Alkali-induced changes in functional properties and in vitro digestibility of wheat starch:the role of surface proteins and lipids[J].Journal of Agricultural and Food Chemistry,2014,62(16):3636-3643
[11]王琳,许杨杨,朱轶群,等.碱液处理对荞麦淀粉物理性能和结构的影响[J].食品工业科技,2017(6):79-83
[12]王颖,晁桂梅,杨秋歌,等.不同提取工艺对糜子淀粉糊化特性的影响[J].西北农林科技大学学报(自然科学版),2013(11):153-159
[13]刘航,徐元元,马雨洁,等.不同品种苦荞麦淀粉的主要理化性质[J].食品与发酵工业,2012(5):47-51
[14]陈燕,米粱波,周怡梅,等.苦荞淀粉制备工艺及加工特性研究[J].粮食与油脂,2016(5):16-20
[15]刘瑞,冯佰利,晁桂梅,等.苦荞淀粉颗粒及淀粉糊性质研究[J].中国粮油学报,2014(12):31-36
[16]李新华,韩晓芳,于娜.荞麦淀粉的性质研究[J].食品科学,2009(11):104-108
[17]杨红丹,杜双奎,周丽卿,等.3种杂豆淀粉理化特性的比较[J].食品科学,2010(21):186-190
[18]韩春然,姚珊珊,许鑫.奶白花芸豆淀粉颗粒结构及理化特性研究[J].食品科学,2012(3):63-67
[19]高金锋,晁桂梅,杨秋歌,等.红花甜荞籽粒淀粉的理化特性[J].农业工程学报,2013(8):284-292
[20]付一帆,甘淑珍,赵思明.几种淀粉的糊化特性及力学稳定性[J].农业工程学报,2008(10):255-257
[21]单珊,周慧明,朱科学.紫薯淀粉理化性质的研究[J].粮食与饲料工业,2011(4):27-30
[22]Singh J,Mccarthy O J,Singh H,et al.Morphological,thermal and rheological characterization of starch isolated from New Zealand Kamo Kamo(Cucurbita pepo)fruit-A novel source[J].Carbohydrate Polymers,2007,67:233-244
[23]Zhou Y G,Li D.Effect of water content on thermal behaviors of common buckwheat flour and starch[J].Journal of Food Engineering,2009,93(2):242-248
[24]高金锋,刘瑞,晁桂梅,等.荞麦、糜子与玉米淀粉理化性质比较研究[J].中国粮油学报,2014(10):16-22
[25]吴桂玲,李文浩,刘立品,等.脂类和颗粒结合蛋白对小麦A、B淀粉理化性质的影响[J].中国粮油学报,2016(8):17-23
[26]汝远,王蕾,周君,等.干热处理对玉米淀粉性质的影响[J].食品工业科技,2015(16):138-141
