铜藻活性组分多糖的体外抗氧化性研究
2018-03-24张玉张绵松史亚萍赵佩佩王加祥刘昌衡
张玉,张绵松,史亚萍,赵佩佩,王加祥,刘昌衡
(齐鲁工业大学(山东省科学院),山东省科学院生物研究所,山东济南250103)
铜藻(Sargassum horneri)又称“丁香屋”,属于褐藻纲(Phaeophyceae),墨角藻目(Fulcales),马尾藻科(Sargassaceae),马尾藻属(Sargassum)[1]。铜藻资源主要分布于我国沿海地区,是我国浅海植被中的珍贵物种,含有多糖、蛋白质、褐藻酸、维生素、纤维素、甾醇类化合物等[2]。大量研究发现铜藻多糖具有抗氧化、抗肿瘤、调节机体免疫功能等作用[3]。顾丽霞等研究了铜水提法获得的铜藻粗多糖的抗氧化能力和免疫调节能力[4]。李伟则详细的研究了水提法得到的铜藻多糖及其组分的免疫调节作用[5]。分析目前的铜藻多糖的研究,大多数研究均使用水提法获取铜藻多糖,但是提取过程中褐藻酸、褐藻胶等的存在,导致获取的铜藻多糖组成复杂,极性相近,分子量分布较宽,使分离纯化铜藻多糖的难度加大,导致铜藻多糖抗氧化活性组分尚不明确,且目前关于铜藻多糖的分离组分的抗氧化活性的研究报道较少。
本研究采用2%CaCl2溶液提取铜藻多糖,经由DEAE-Sephrose-Fast-Flow分离纯化得到铜藻多糖的组分,并分别进行红外光谱分析和单糖结构解析,通过体外抗氧化实验,比较各个组分的抗氧化能力,从而获得铜藻多糖抗氧化活性的功效组分,为从铜藻活性多糖作为天然抗氧化剂及研发功能食品提供理论基础。
1 材料与仪器
1.1 材料
铜藻:温州海虎海藻养殖有限公司。
盐酸、氢氧化钠、乙醇、甲醇、硫酸、苯酚、三氯乙酸、氯化铁、水杨酸、过硫酸钾、铁氰化钾、三氯乙酸、氯化铁、硫酸亚铁、双氧水均为分析纯:国药集团化学试剂有限公司;乙腈(有机试剂):Fisher公司。
甘露糖、半乳糖、木糖、岩藻糖、半乳糖醛酸、葡萄糖、DPPH、Trolox、ABTS:Sigma 公司;葡萄糖胺、1-苯基-3-甲基-5-吡唑啉酮(PMP):Aladdin公司;葡萄糖醛酸:上海源叶生物科技有限公司;牛血清蛋白(ABSA):济南朋远生物技术有限公司;考马斯亮蓝G-250:Klontech公司;维生素C:北京索莱宝科技有限公司。
1.2 仪器
JSP-350A高压多功能粉碎机:浙江省永康市金穗机械制造厂;MODEL NO.XX8200230 6-600 RPM 0.1 HP美国组装超滤机:Thermo Fisher Scientific;Millipore超滤膜:深圳明盛九州实业有限公司;HITACHI高速冷冻离心机(CR22GIII):湘锐离心机有限公司;LG-1.5型真空冷冻干燥设备:沈阳航天新阳速冻设备制造有限公司;TECAN M200PRO多功能酶标仪:上海安景科技有限公司;TU-1810紫外可见分光光度计:北京普析通用仪器有限责任公司;METTLER TOLEDO ME104分析天平:海富来科技有限公司;DK-S26电热恒温浴锅:上海精宏实验设备有限公司和太仓精密仪器设备有限公司;DHG-9070A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;安捷伦1260高效液相色谱仪:上海山仪自动化仪表有限公司;红外光谱仪:费尔伯恩实业发展(上海)有限公司。
2 试验方法
2.1 铜藻粗多糖及其组分的制备
新鲜铜藻洗净,50℃烘干(水分含量7%以下),粉碎,过60目筛网。称取1 000 g藻粉,95%的乙醇浸泡过夜,过滤,加入5 L、2%的氯化钙溶液,60℃提取2h,重复一次,合并2次滤液,离心(6 000 r/min,20 min),上清液利用超滤的方式进行初步的纯化,选用100 kDa的滤膜超滤收集,合并大于100 kDa的组分,然后用5 kDa的滤膜进行超滤除盐浓缩,60%的乙醇沉淀,过滤,经冷冻干燥得铜藻的高分子多糖 (high molecular poymor,HMP),然后利用DEAE-Sephrose-Fast-Flow 柱纯化[6],以 0~2 mol/L氯化钠溶液进行梯度洗脱,获得各个分级组分。
2.2 硫酸苯酚法测多糖样品的总糖含量
采用硫酸苯酚法,以岩藻糖作为标准品测定样品的总糖含量[7]。铜藻多糖及其组分样品按上述步骤测定吸光度,根据标准曲线计算总糖含量。
2.3 考马斯亮蓝法测多糖样品的蛋白质含量
参考Bradford方法测定多糖样品中的蛋白质含量[8],以牛血清蛋白(ABSA)为标准品测定样品中的蛋白含量。
2.4 红外光谱分析
称取10mg以上获得的各组分多糖,利用傅里叶红外光谱仪,采用KBr压片法测定[9]。
(3)属性rid表示指代中的照应要素(或照应事件)的顺序编号,属性anaphor表示指代中的照应要素(事件指代标注没有这个属性).
2.5 液相色谱分析单糖组成
准确称取多糖样品100 mg于具塞试管中,加入10 mL 1 mol/L H2SO4,于烘箱中100℃水解8 h,水解结束后,水解液离心,取上清液4.5 mL用2 mol/L NaOH中和至中性,定容至10 mL,离心取上清衍生化。
采用1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)柱前衍生法测定单糖组成[10],100μL水解样品加入100μL 0.3 mol/LNaOH和 120 μL 0.5 mol/L PMP甲醇溶液,70℃水浴 1 h,加入100 μL 0.3 mol/L HCl终止反应。用 700 μL二氯甲烷萃取,取上层清液,重复萃取4次。上清过0.22 μm滤膜至液相上样瓶。配制浓度为10 mg/mL的单糖标准溶液,按等摩尔比混合。
液相色谱条件:色谱柱为ZORBAX SB-C18(5 μm,4.6×150 mm),流动相为乙腈 ∶磷酸盐缓冲液(17∶83体积比),进样量为 10 μL,流速为 1.0 mL/min,柱温35℃,紫外检测器波长245 nm。将样品图谱与单糖标准品图谱比较,根据各个峰的保留时间判断单糖种类,然后根据峰面积计算摩尔比。
2.6 体外抗氧化活性
2.6.1 DPPH自由基清除活性
DPPH自由基的测定参照文献方法[11],并在此基础上稍加改进。Trolox母液溶液的配制:准确称取0.008 g Trolox置于10 mL容量瓶中,先用3 mL乙醇助溶,再加入蒸馏水定容到10 mL。标准溶液的配制见表1。

表1 Trolox标准溶液的配制Table 1 Standard solutions of Trolox
DPPH自由基清除能力的测定:将10 μL的Trolox溶液、稀释到不同的样品溶液及空白(蒸馏水)加到96孔板中,再加入40 μL新鲜配制的DPPH甲醇溶液(1 mmol/L),混合均匀后加入190 μL的甲醇溶液,200 r/min振摇1 min;在室温条件下,避光孵育30 min。用酶标仪于517 nm波长下检测,每个样品重复3次。自由基清除率/%=(A0-AS)/A0×100,式中:AS样品溶液吸光度值;A0空白溶液吸光度值。根据标准曲线计算DPPH自由基清除能力IC50值。
2.6.2 ABTS+·清除活性
ABTS+·自由基的测定参照文献方法[12],并在此基础上稍加改进。Trolox标准溶液的配制同2.6.1;ABTS+·工作液的配制:将 ABTS+·母液(7 mmol/L)和过硫酸钾溶液(2.4 mmol/L)等体积混合,室温放置12 h~16 h。然后用甲醇稀释至吸光度值稳定在0.7±0.02为止,即制成ABTS+工作液。每次实验都需测定此吸光度值,如果不在此范围中,必须进行微调。
2.6.3 还原力测定
还原力的测定按照文献的方法[14],并稍作改进。
准确量取0.4 mL不同浓度样品溶液和空白溶液(蒸馏水),再加入 1 mL(0.2 mol/L,pH 6.6)磷酸缓冲液及 1 mL 1%铁氰化钾(K3[Fe(CN)6])溶液,混合均匀后,于50℃水浴孵育20 min;再加入0.5 mL 10%三氯乙酸溶液,室温孵育10 min。取上述溶液1 mL,加入1 mL蒸馏水和0.2 mL 0.1%氯化铁溶液,均匀混合,用分光光度计于700 nm处测定吸光度值。溶液的吸光度值越高,还原力越强,反之越弱。
2.6.4 超氧阴离子自由基清除能力
本试验方法参照文献方法[15],50 μL不同浓度的样品溶液以及空白溶液(甲醇),加入1mL 0.1mol/L的磷酸盐缓冲液(pH7.4)以及 150 μmol/L的 NBT、60 μmol/L的PMS和468 μmol/L的NADH。25℃反应8 min,560 nm处测定吸光度值。按照下式计算自由基清除率。自由基清除率/%=(A0-AS)/A0×100,式中:AS为样品溶液吸光度值;A0为空白溶液吸光度值。根据Trolox标准曲线,计算超氧阴离子自由基清除能力的IC50值。
3 结果与分析
3.1 铜藻多糖的纯化
铜藻多糖经过DEAE-Sephrose-Fast-Flow分离纯化后得到4个组分的氯化钠梯度洗脱液(如图1),分别命名为 SF1(0.46mol/L)、SF2(1.0mol/L)、SF3(1.5 mol/L)SF4(1.8 mol/L)。多次试验收集 4个组分的洗脱液,分别透析除盐,冷冻干燥后得到SF的四个组分,考马斯亮蓝法检测均无蛋白质,纯度达到95%。

图1 洗脱曲线Fig.1 The elution curves
3.2 铜藻多糖组分红外光谱分析
铜藻多糖的四种分级组分在4000cm-1~500cm-1进行扫描,得到图2:五种分级组分在3 460 cm-1、2 980 cm-1、1 650 cm-1、1 380 cm-1、1 070 cm-1左右处得到的特征吸收峰可能代表了多糖结构中-O-H的伸缩振动、-C-H的伸缩振动、-C=O的伸缩振动、-C-H的弯曲振动和C-O-C或C-O-H中的C-O键的弯曲振动;2 933 cm-1是C-H的伸缩振动吸收峰,1633cm-1可能是酰胺基中的C=O伸缩振动,754.6cm-1、842 cm-1处可能是α-吡喃环的特征吸收。1 090 cm-1~1 260 cm-1处是C-O-C和C-OH的振动峰。SF1、SF2、SF3、SF4在1 250 cm-1处的峰增强,可能是由于硫酸根S=O的对称伸缩振动[16-18]。
3.3 铜藻多糖组分的单糖分析
本文采用PMP柱前衍生高效液相色谱法分析4种铜藻多糖组分的单糖组成[19-20]。试验以甘露糖(Mannose,Man)、葡萄糖胺(Glucosamine,GlcN)、葡萄糖醛酸(Glucuronic acid,GlcA)、半乳糖醛酸(DGalacturonic acid,GalA)、葡萄糖(Glucose,Glc)、半乳糖(Galactose,Gal)、木糖(Xylose,Xyl)、岩藻糖(fucose,Fuc)组成的八糖标准品作为对照品。其中标准品HPLC色谱图如图3所示,对比样品与标准品的保留时间,并根据样品和标准品的峰面积计算各单糖的摩尔比,发现SF2、SF4中岩藻糖占优势,占总糖的二分之一以上;SF3中半乳糖占绝对优势,都在80%左右。具体的单糖组成及摩尔比见表2。
3.4 抗氧化活性分析
3.4.1 DPPH自由基清除活性
3.4.1.1 Trolox标准曲线绘制
Trolox标准曲线绘制见图4。
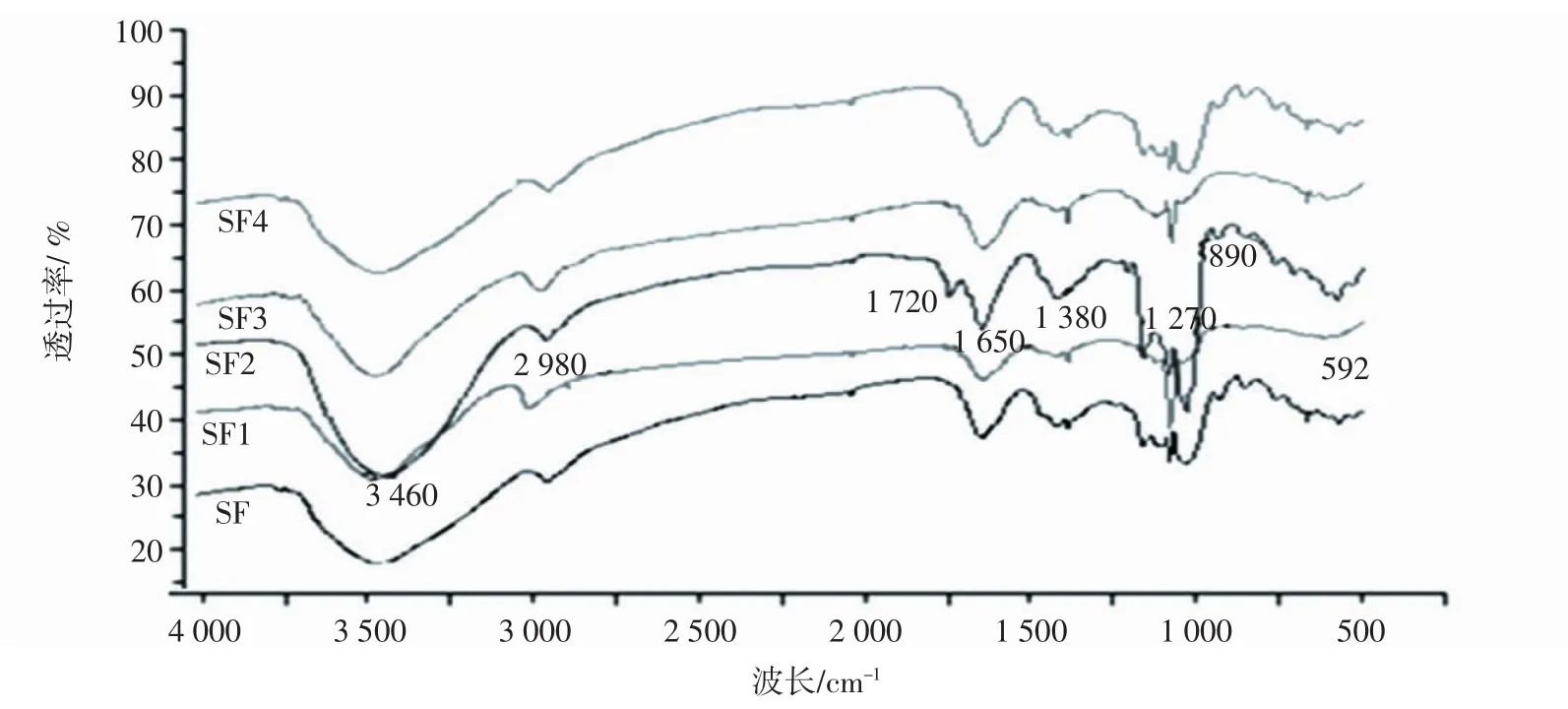
图2 铜藻多糖组分的红外光谱扫描光谱图Fig.2 IR spectrum of SF1,SF2,SF3,SF4

图3 单糖标准品的液相色谱图Fig.3 HPLC spectrum of standard monosaccharide

表2 铜藻多糖的四个组分单糖组成Table 2 Monosaccharide composition of SF1,SF2,SF3,SF4
3.4.1.2 铜藻多糖的DPPH自由基的清除活性比较
DPPH自由基在517nm处有最大吸收波长,并呈现稳定的紫色。当自由基清除剂存在时,DPPH自由基的单电子由于被配对,DPPH自由基浓度减小而使其颜色变浅,且颜色变化与配对电子数成化学计量关系[21]。通过吸光度得让变化,可以简便、快速的判断其清除活性,所以被广泛用于清除自由基物质性质的研究与天然抗氧化剂的筛选。图5反映了铜藻多糖及不同组分的DPPH自由基的清除活性,发现在SF2的效果最好,IC50值为0.499 μg。

图4 Trolox的标准曲线Fig.4 The standard curve of Trolox
3.4.2 铜藻多糖及组分的ABTS+·清除活性比较
不同浓度的铜藻多糖及组分的ABTS+·清除活性见图6。
ABTS+·为一稳定的有机自由基,试样抗氧化能力越强,其提供电子的能力也就越强,与该有机自由基反应量越大,反应速率也越快,通过测定反应液吸光度的变化,直接反应出样品抗氧化能力的大小[22]。如图6所示,随着浓度的变化,SF2的ABTS+清除活性也在增强,并在达到一定浓度后,表现出下降趋势,其 IC50值为 34.30 μg。

图5 不同浓度的铜藻多糖及组分的DPPH清除活性Fig.5 The scavenging effect of FS,FS1,FS2,FS3,FS4 with different concentration on DPPH
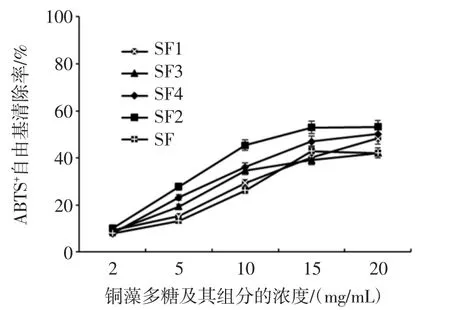
图6 不同浓度的铜藻多糖及组分的ABTS+自由基清除活性Fig.6 The scavenging effect of FS,FS1,FS2,FS3,FS4 with different concentration on ABTS+·
3.4.3 铜藻多糖及组分的还原力比较
不同浓度的铜藻多糖及组分的还原力见图7。通过图7还原力的比较,可以看出随浓度的增大,铜藻多糖及组分的还原力越来越强,在同一浓度下,SF2组分的还原力最强。

图7 不同浓度的铜藻多糖及组分的还原力Fig.7 The effect of FS,FS1,FS2,FS3,FS4 with different concentration on reducing power
3.4.4 铜藻多糖及组分的超氧阴离子自由基清除活性
不同浓度的铜藻多糖及组分对超氧阴离子自由基的清除作用见图8。

图8 不同浓度的铜藻多糖及组分对超氧阴离子自由基的清除作用Fig.8 The scavenging effect of FS,FS1,FS2,FS3,FS4 with different concentration on O2-
超氧阴离子自由基(O2·)是生物体内所有氧自由基中的第一个自由基,可以经过一系列反应生成其他的氧自由基,引起脂质过氧化,导致细胞膜结构和功能的改变[23]。利用PMS及NADH作用产生超氧阴离子,而超氧阴离子会进一步将NBT还原并在波长560 nm处具有强吸光度,根据吸光度值可以判定样品清除超氧阴离子的能力。图8可以看出在一定浓度下铜藻多糖及组分的超氧阴离子自由基清除活性明显增强,其IC50值为18.987 μg。
4 结论
在评价抗氧化能力的方法中,DPPH自由基清除能力、抗脂质过氧化能力、O2-自由基清除能力为判定多糖是否具有抗氧化能力的重要指标[24],试验结果表明该多糖在离体条件下具有较好的自由基清除能力、抗脂质过氧化能力和O2-自由基清除能力,并通过Trolox标准曲线,计算出IC50值。铜藻多糖及组分在体外对活性氧自由基均有清除作用,证明多糖能够清除体内产生的过多氧自由基,是通过阻断体内自由基反应链的发挥作用,通过纯化手段得到的铜藻多糖组分SF的体外抗氧化活性较未纯化前的效果更好。因此铜藻多糖组分有待于开发为一种抗氧化、防衰老的药品、食品或化妆品。
[1]彭雍博,汪秋宽,任丹丹,等.铜藻主要活性物质的提取及其功能[J].水产科学,2017,36(4):531-537
[2]张春红,黄建,霍军生.菊粉的特性及在特殊医学用途配方食品中的应用前景[J].中国酿造,2017(1):19-23
[3]陈晓晓.铜藻多糖的酶法修饰、活性及应用研究[D].杭州:浙江工业大学,2014
[4]顾丽霞,刘丽佳,何淑婷,等.铜藻多糖水提法工艺优化及其抗氧化活性研究[J].安徽农业科学,2014,42(29):10139-10141
[5]李伟.铜藻多糖的纯化、结构及免疫活性的研究[D].温州:温州大学,2015
[6]郑军,王英,钱俊杰,等.褐藻糖胶的提取纯化及其抗凝血活性的研究[J].分子科学学报,2002,18(2):109-112
[7]邵平,刘佳,王欧丽,等.铜藻多糖微波辅提工艺优化及其抗氧化活性研究[J].核农学报,2014,28(6):1062-1069
[8]冯瑞娟.半夏蛋白的提取分离、含量测定及对Hela细胞的作用研究[D].杭州:浙江理工大学,2012
[9]刘丽佳,何淑婷,姜露,等.铜藻粗多糖酶法提取工艺的优化及其抗氧化活性研究[J].浙江海洋学院学报(自然科学版),2013,32(6):503-507
[10]Michel.DuBois.Colorimetric Method for Determination of Sugars and Related Substances[J].Analytical Chemistry,1956,28(3):350-356
[11]PESCHEL W,SANCHEZ-RABANEDA F,DIEKMANN W,et al.An industrial approach in the search of natural antioxidants from vegetableand fruit wastes[J].Food Chemistry,2006,97(1):137-150
[12]GUPTA M,MAZUMDER U K,GOMATHI P.In vitro antioxidant and free radical scavenging activities of Galega purpurea root[J].Pharmacognosy Magazine,2007,3(12):219-223
[13]DU Guorong,LI Mingjun,MA Fengwang,et al.Antioxidant capacity and the relationship with polyphenol and vitamin C in Actinidia fruits[J].Food Chemistry,2009,113:557-562
[14]Kishk Y F M,Al-Sayed H M A.Free-radical scavenging and antioxidative activities of some polysaccharides in emulsions[J].LWT-Food Science and Technology,2007,40(2):270-277
[15]Lin H Y,Chou C C.Antioxidative activities of water soluble disaccharide chitosan derivatives[J].Food Research International,2004,37(9):883-889
[16]董振兴,彭代银,宣自华,等.牡丹籽油降血脂、降血糖作用的实验研究[J].安徽医药,2013,17(8):1286-1289
[17]王亚恩.南极磷虾油降血脂、抗氧化力及其改善记忆力功能实验研究[D].青岛:中国海洋大学,2011
[18]Ji Y B,Ji C F,Wang C.Study on S180 tumor mice erythrocyte membrance function of Sargassum Fusiform polysaccharide[C].Springer-Verlag Berlin Heidelberg.7th Asian-Pacific Conference on Medical and Biological Engineering.Berlin:Springer,2008:531-533
[19]孙艳波,颜敏茹,徐亚麦.菊粉的生理功能及其在乳制品中的应用[J].中国乳品工业,2005(8):43-44
[20]邵平,陈蒙,裴亚萍,等.径向流色谱分离纯化海藻多糖及其抗氧化活性比较分析[J].核农学报,2013(5):635-640
[21]PRIETO P,PINEDA M,AGUILAR M.Spectrophotometric quantitation of antioxidant capacity through the formation of a phosphomoly bdenum complex:specific application to the determination of vitamin E1[J].Analytical Biochemistry,1999,269:337-341
[22]周宁,赵晓璐,屈潇毅,等.超声辅助提取甘蔗叶总黄酮与还原力的测定[J].应用化工,2016(10):1883-1886,1890
[23]汤杰,赵力超,陈洪璋,等.桉叶提取物与常用抗氧化剂活性比较研究[J].食品科技,2013(8):247-251
[24]李莉,顾欣,崔洁,等.板栗壳棕色素抗氧化性研究与红外光谱分析[J].食品与发酵工业,2011(3):41-45
