Nano DSC法测定ILPR G-四链体的热力学性质
2018-03-21张又右史全王思雨谭志诚王韶旭
张又右,史全,王思雨,谭志诚,王韶旭
(1.大连交通大学 环境与化学工程学院,辽宁 大连116028;2.中国科学院大连化学物理研究所 热化学实验室,辽宁 大连 116023)
0 引言
端粒结构存在于染色体末端,是一种富含鸟嘌呤(Guanine)的非编码重复序列.端粒DNA的四个鸟嘌呤G在一价金属阳离子(如K+、Na+)的诱导下[1]可以通过碱基间Hoogsteen氢键作用形成环状的芳香平面结构——G-四分体(G-quartets),平面通过π-π相互作用进一步形成四链体结构.已有文献报道,当DNA序列形成稳定的G-四链体时,端粒酶活性降低,相关基因的转录和表达被明显抑制[2].在生物体内,G-四链体的不同碱基类型、空间构象、沟槽种类等决定了G-四链体具有多态性和特异性,使得G-四链体能够作为药物选择性识别的靶点.因而近年来G-四链体在小分子抗病毒[3]和抗肿瘤[4]药物合成方面得到了广泛的关注.
ILPR(insulin linkage polymorohism region)是位于染色体胰岛素基因近侧启动子365 bp处的一个基因片段[5],其碱基序列为5′-ACAG4TGTG4-3′.Kennedy等[6]证实了ILPR序列能调节转录因子的活性,且能够在胰岛β细胞之间传递转录信号,该序列的增多会导致病毒基因具有高传染性,因此ILPR序列是Ⅰ型糖尿病这一多基因遗传病的关键.Schonhoft等[7]提出当ILPR序列折叠形成稳定的G-四链体结构时,转录水平降低,病毒基因表达被抑制,从而达到靶向治疗的目的.
近年来国内外学者对ILPR G-四链体进行了一系列结构和性质研究.Schonhoft等[7]使用荧光淬灭法研究了ILPR G-四链体与胰岛素溶液的结合常数.Jennifer等[8]利用圆二色光谱法测定了ILPR G-四链体与胰岛素结合后的结构变化并设计了相应的电化学传感器.Xiao等[9]在其工作中使用等离子共振技术研究了ILPR G-四链体和胰岛素样生长因子-2(IGF-2)的解离常数.Christine等[10]研究了ILPR G-四链体与胰岛素的作用机制且证明了ILPR能在钾离子溶液中形成稳定的G-四链体结构.这些研究在一定程度上探究了G-四链体的性质,揭示了ILPR序列和胰岛素的结合作用,然而对ILPR G-四链体的热力学性质如比热研究等涉及较少.
差示扫描微量热仪技术(Nano DSC)能够准确地测定微瓦级别的热效应,具有高灵敏性和稳定的控温能力,这一量热技术能从能量角度提供光谱法等其他方法无法直接得到的热力学基础参数,在测定G-四链体等小分子时能准确获取体系中相互作用的能量信息.
本研究主要利用TA Nano DSC在40~100℃温区测量了ILPR G-四链体在K+溶液中的熔融温度Tm、融化焓ΔH和等压比热Cp,并通过两态模型对实验数据进行了拟合,将热力学行为与微观结构变化结合起来,为当前进一步研究ILPR G-四联体提供新思路.
1 实验方法
1.1 试剂与仪器
ILPR序列的DNA片段由上海生工生物工程有限公司合成和纯化, DNA序列通过质谱检测,分子量误差<0.1%;氯化钾、磷酸二氢钾、磷酸氢二钾,分析纯,购自天津阿法埃莎(Alfa Aesar)化学有限公司;0.1 mol/L甘氨酸溶液(pH为2.4)和0.925 mg/mL溶菌酶溶液由TA Instruments提供;实验用水为高纯水.
1.2 DNA样品预处理
将50 OD DNA片段溶于高纯水中,于4℃低温静置保存12 h,配置成储存液.配置PBS缓冲液: 10 mmol/L的K2HPO4溶液和KH2PO4溶液中加入 100 mmol/L的KCl缓冲溶液(调节pH为7.4).储存液中加入5 mL PBS缓冲液混合,留作退火处理.
1.3 Nano DSC实验
1.3.1 误差校准
使用随配的脱气装置,在20 inches Hg的真空度下将待测甘氨酸与溶菌酶标准试剂脱气15 min,消除气泡对后续实验的干扰.基线实验在3 atm压力下以1℃/min的升温速率预扫描甘氨酸溶液至85℃,后续从25℃升温至85℃,重复两遍.标准样品实验在3 atm压力下扫描溶菌酶溶液至85℃.误差校准实验重复3遍.
1.3.2 预扫描
为了避免溶液与仪器器壁之间的热量交换对热流信号产生影响,实验前12 h将适量PBS溶液进样至Nano DSC中,以1℃/min的升降温速率进行循环实验.
1.3.3 DNA退火
混合液在Nano DSC中以1.5℃/min的速率从室温升至90℃,于90℃恒温10 min,以确保序列处于单链无序状态,再以0.1℃/min的速率缓慢降至4℃.
1.3.4 G-四链体测定
缓冲液扫描在3 atm 压力下于40~110℃温度范围内,以0.5℃/min的速率升温PBS缓冲溶液,重复测定2次.样品扫描在3 atm 压力下于40~110℃温度范围内,以0.5℃/min的速率升温退火后的G-四链体溶液.
1.3.5 UV-vis测定
以PBS缓冲液做参比溶液,在1 cm石英比色皿中加入一定浓度的退火后的G-四链体溶液,在波长190~350 nm之间以0.5 nm为间隔测定其吸光度.
2 实验结果与讨论
2.1 Nano DSC误差校准结果
在40~75℃温区范围内校准0.1 mol/L甘氨酸缓冲液热流基线后,0.925 mg/mL溶菌酶的摩尔比热随温度变化的曲线Cp,m-T如图1所示.其中圆点、方块与三角形分别代表了第一次、第二次与第三次的实验结果.如图1所示,溶菌酶的摩尔比热随着温度升高呈现对称的吸热峰,在57℃左右有一个吸热峰值,峰顶温度即为熔融中点温度Tm.

图1 溶菌酶DSC热谱图
用Nano DSC标准积分软件计算出的溶菌酶熔融中点温度和融化焓列于表1.
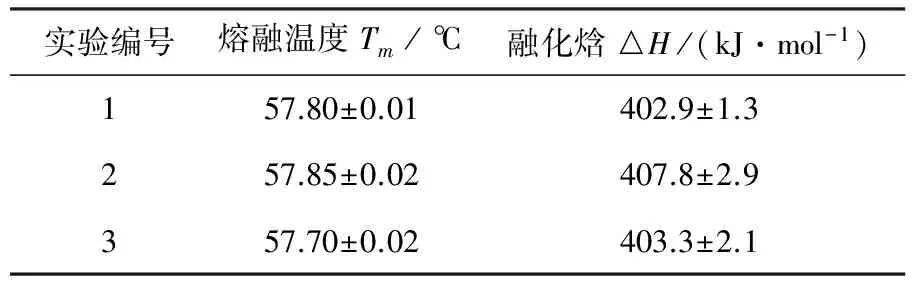
表1 重复实验下溶菌酶的熔融中点温度和融化焓
根据ASTM E 2603-08[11],溶菌酶的热力学标准参数列于表2.且由实验结果可以看出三次校准实验重复性较好.对比实验结果和标准值可以认为误差校准后测量精度已达到标准.

表2 溶菌酶标准热力学数据
2.2 ILPR G-四链体试验结果
图2所示为ILPR G-四链体在40~110℃温区范围的DSC热谱图曲线.如图所示,ILPR G-四链体的熔融转变分别在67.63℃和96.2℃,这表明ILPR G-四链体的去折叠熔融过程不是一个简单的两态转变过程.在低熔融温度下,第一次构象转变融程长且温区跨度大.在高熔融温度下,第二次构象转变峰形变窄,转变迅速.
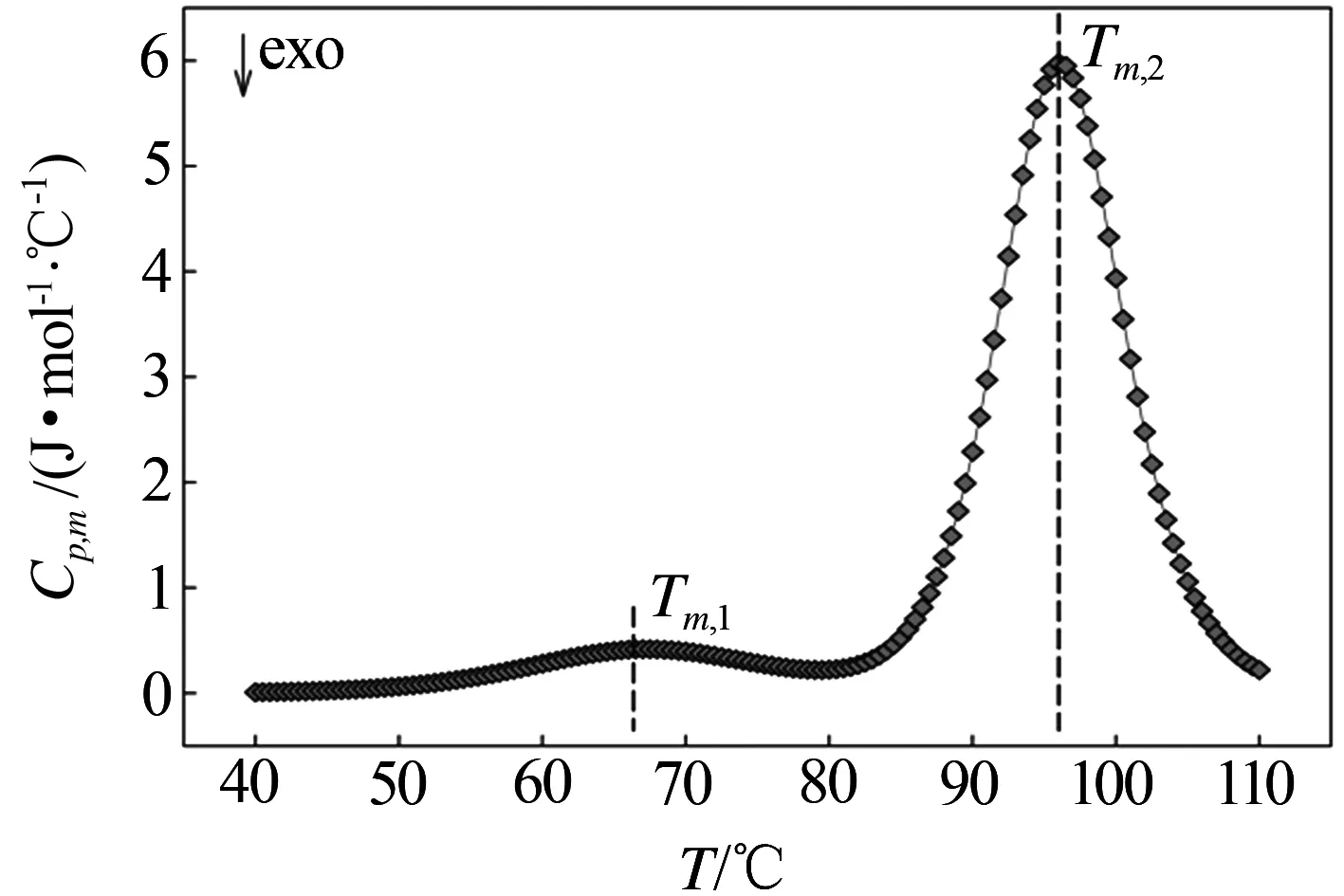
图2 ILPR G-四链体DSC热谱图
已有研究从光谱的角度分析了ILPR G-四链体的构象.Paramasivan S[12]和Kypr J[13]曾利用圆二色光谱法对G-四链体的特征结构CD谱图作出总结,研究认为G-四链体的平行构象在260~265 nm处出现正Cotton效应、240 nm处出现负Cotton效应;而反平行构象则在295nm处出现正Cotton效应、260 nm处出现Cotton效应.对ILPR G-四链体,Dhakal S[14]、Christine M[10]、Schonhoft J D[7]等人经CD熔融实验表明该G-四链体在265、295 nm出现明显正Cotton效应,如图3所示.这说明了ILPR G-四链体可能是平行构象和反平行构象的混合.

图3 ILPR G-四链体 CD光谱图
在本研究中,可以从比热的角度分析G-四链体可能的结构微观变化.Liphardt J[15]研究表明,在反平行构象中,G四分体之间鸟嘌呤G形成的环形相连的连续结构十分稳定,反平行构象解链的破裂力高.在图2中,在较低熔融温度下,第一次构象转变峰值处比热为0.465 J/mol·℃.在较高熔融温度下,第二次构象转变峰值处比热为6.054 J/mol·℃.这说明第二次构象转变吸热更多,且需要在温区跨度为86~105℃的较高温度下进行,相比较第一次构象转变处平缓的吸热解链情况,推断这是由于反平行构象稳定、解链所需能量大导致.高温熔融源自于反平行构象转变,低温熔融对应平行构象转变.两个熔融峰分离十分明显,说明这两种构象转变过程可能是相对独立的.
在图4中,通过TA Analysis软件模拟,基线校正后的G-四链体摩尔比热随温度变化曲线的去卷积处理可以很好地把原始实验曲线处理成两个分立组分的叠加,以此来分离这两个相对独立的构象转变过程.

图4 DSC热谱图去卷积模拟
为了准确表达比热数据,计算每个转变过程中的熔融焓,研究中采用了高斯函数对比热实验数据进行拟合:
(1)
式(1)中的各拟合参数没有物理意义,仅作比热实验数据拟合.所有的拟合参数(A0、A1、A2、A3)和拟合数据与实验数据的均方根偏差(RMS)列于表3.
由此计算出来G-四链体熔融温度和融化焓列于表4.
所有ILPR G-四链体在40~110℃的摩尔比热实验值(以0.5℃为间隔)列于表5.
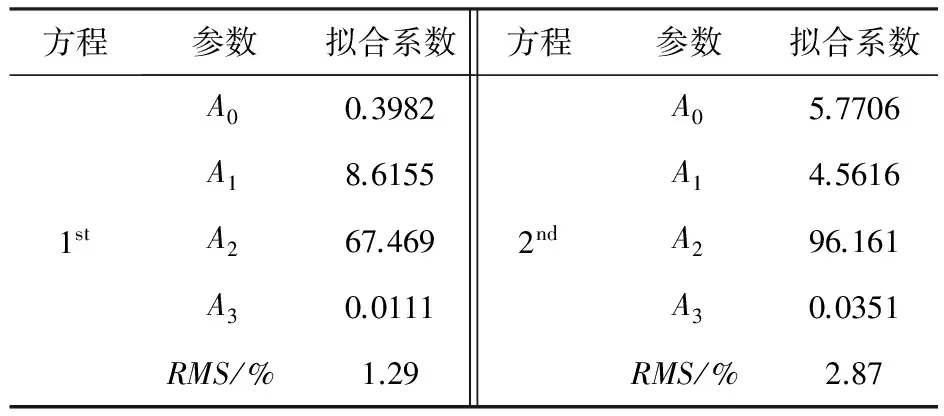
表3 比热拟合系数

表4 ILPR G-四链体熔融温度和融化焓

表5 ILPR G-四链体摩尔比热
2.3 紫外可见吸收光谱实验结果
对ILPR序列,其摩尔吸光系数ε=283 900 L/(mol·cm),分子量为8.911 8 kD.吸光度A在波长190~350 nm之间的变化曲线如图5所示.在260 nm 处G-四链体溶液吸光度为4.068.由朗伯-比耳定律得:
A=εbc
其中,A为吸光度;ε为摩尔吸光系数;b为液池厚度;c为溶液浓度.
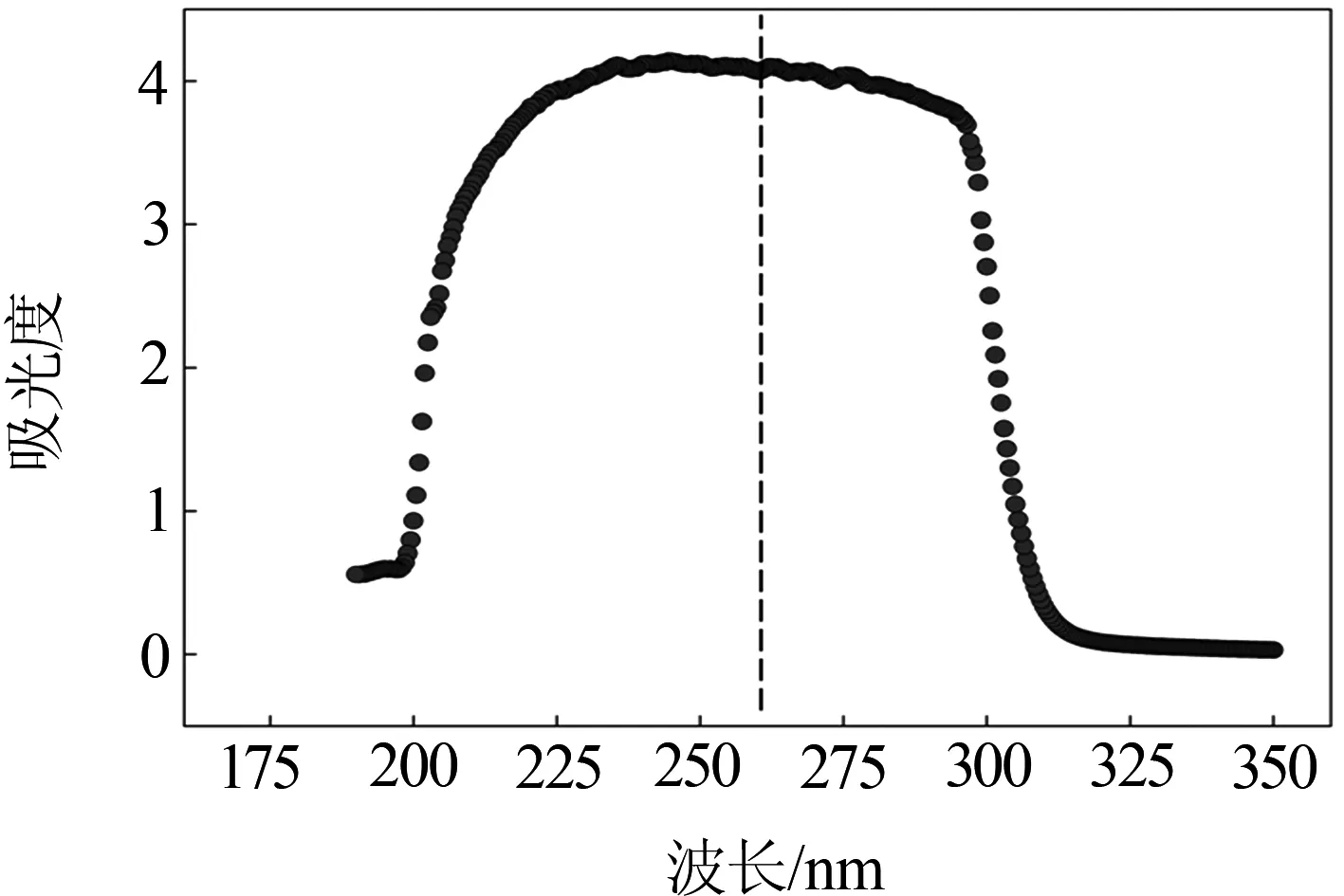
图5 ILPR G-四链体紫外可见吸收光谱图
由此计算得退火后的G-四链体溶液浓度为14.33 μmol/L.
3 结论
通过Nano DSC法进行ILPR序列退火处理,并通过紫外光谱测试得到退火后的ILPR G-四链体浓度.在3 atm压力下,40~110℃温区准确测量了ILPR G-四链体在K+溶液中的等压比热,并通过去卷积拟合数据分离两个结构的变化过程,分别得到熔融中点温度为(67.63±0.16)℃和(96.2±0.01)℃;融化焓为(170.9±2.1)kJ/mol 主(392.0±1.6)kJ/mol.
[1]CHANTOT J F, GUSCHLBAUER W. Physicochemical properties of nucleosides 3. Gel formation by 8-bromoguanosine [J]. FEBS Lett.,1969,4(3): 173-176.
[2]ZHANG JING NAN, YU QIAN QIAN. A ruthenium(II) complex capable of inducing and stabilizing bcl-2 G-quadruplex formation as a potential cancer inhibitor [J]. Journal of Inorganic Biochemistry, 2013,134:1- 11.
[3]VIRGILIO A, ESPOSITO V . Structural Investigations on the Anti-HIV G-Quadruplex-Forming Oligonucleotide TGGGAG and Its Analogues: Evidence for the Presence of an A-Tetrad [J]. Chem. Bio. Chem., 2012,13(15): 2219- 2224.
[4]PAULA J, DAMIAN Al. Discovery and Development of the G-Rich Oligonucleotide AS1411 as a Novel Treatment for Cancer [J]. Exp. Mol. Path., 2009,86(3): 151- 164.
[5]CONNOR A C, FREDERICK K A. Insulin Capature by an Insulin-Linked Polymorphic Region G-Quadruplex DNA Oligonucleotide[J]. J. Am. Chem. Soc., 2006,128(15): 4986- 4991.
[6]KENNEDY G C, GERMAN M S . The Minisatellite in the Diabetes Susceptibility Locus Iddm2 Regulates Insulin Transcription [J]. Nat. Genet., 1995,9(3): 293- 298.
[7]SCHONHOFT J D, DAS A. ILPR Repeats Adopt Diverse G-quadruplex Conformations That Determine Insulin Binding [J]. Biopolymers., 2010,93(1): 21- 31.
[8]GERASIMOV J Y, SCHAEFER C S, YANG W, et al. Development of an Electrochemical Insulin Sensor Based on the Insulin-Linked Polymorphic Region [J]. Biosens. Bioelectron., 2013,42: 62- 68.
[9]XIAO J, CARTER J A. A Genome-Inspired DNA Ligand for the Affinity Capture of Insulin and Insulin-Like Growth Factor-2[J]. J. Sep. Sci.,2009,32(10):1654- 1664.
[10]CHRISTINE M T, NICOLEL Ml. An Isothermal Titration and Differential Scanning Calorimetry Study of the G-Quadruplex DNA-Insulin Interaction[J]. J. Phys. Chem. B., 2014,118: 1784- 1790.
[11]美国材料实验协会. ASTM Standards[EB/OL]. https://www.astm.org/DATABASE.CART/HISTORICAL/E2603- 08.htm.
[12]PARAMASIVAN S, RUJAN I, PHILIP H. Circular dichroism of quadruplex DNAs: Applications to structure, cation effects and ligand binding[J]. Methods.,2007,43: 324- 331.
[13]KYPR J, KEJNOVSKA I, RENCIUK D, et al. Circular dichroism and conformational polymorphism of DNA[J]. Nucleic Acids Res., 2009,37(6): 1713- 1725.
[14]DHAKAL S, SCHONHOFT J D. ILPR G-quadruplex Formed in Seconds Demonstrate High Mechanical Stabilities [J]. J. Am. Chem. Soc., 2009,131(5): 1876- 1882.
[15]LIPHARDT J, DUMONT S, SMITH S B, et al. Equilibrium Information from Nonequilibrium Measurements in an Experimental Test of Jarzynski′s Equality [J].Science,2002,296: 1832- 1835.
