罗非鱼头长链碱的分离纯化及抗肿瘤活性
2018-03-20于曼曼夏光华申铉日
于曼曼,夏光华,李 川,申铉日,*
(1.海南大学食品学院,海南 海口 570228;2.海南大学 热带生物资源教育部重点实验室,海南 海口 570228)
罗非鱼,又称非洲鲫鱼,由于其生长迅速、肉质鲜嫩,富含蛋白质和多种不饱和脂肪酸,成为世界上水产业重点培养的淡水养殖鱼类[1-2]。我国是罗非鱼生产大国,生产的成品多为冷冻罗非鱼片,其加工过程中产生大量的鱼头废弃物。因此本研究以罗非鱼头为原料进行罗非鱼头长链碱(tilapia head long chain bases,TH-LCB)的制备,不仅可以增加罗非鱼废弃物的附加值,还可以减少废弃物对环境的污染。
长链碱又称鞘氨醇碱基、鞘氨基醇,为长链多羟基脂肪胺,是鞘脂类的特征性结构[3]。1876年首次在大脑中发现了脑苷脂,并且发现它含有一个脂肪链的碱基,即“sphingosines”,但鞘氨醇类化合物的作用机理至今仍是一个难解的谜。长链碱的结构随着生物进化,在不同物种之间存在较大的差异,这些差异主要包括长链碱的碳骨架长短、支链位置和双键数目及位置。天然存在的长链碱链长为12~22 个碳,以18 个碳居多。植物和真菌的长链碱以t18∶0为主要成分,主要以植物鞘氨醇(phytosphingosine)为主;哺乳动物以d18∶1和d18∶0为主要成分,哺乳动物体内最常见的长链碱是神经鞘氨醇(sphingosine,d18∶1),又称鞘氨醇[4];而水产类的长链碱组成比植物、真菌和哺乳动物复杂,主要成分是双不饱和的d18∶2长链碱[4,8],还发现有特殊的多不饱和d18∶3和d19∶3长链碱。长链碱的相对分子质量范围为238.4~320.5[5]。长链碱属于强效的生长抑制剂,外源性长链碱可诱导多种肿瘤细胞系周期阻滞和凋亡,如人白血病HL-60细胞[6]、人大肠癌HT-29细胞和HCT-116细胞[7-8]、人肝癌HepG2细胞[9]等。长链碱还可以使细胞内溶酶体快速破裂,释放出组织蛋白酶D、B和L,激活Caspases酶系,诱导细胞凋亡[10]。这一过程可能伴随着线粒体释放细胞色素c,激活Caspase-3、Caspase-8、Caspase-9、Caspase-7等,以及抑制AKT激酶通路和丝氨酸/苏氨酸激酶通路等抗凋亡途径[11]。
本研究以罗非鱼头为原料,制备纯化的TH-LCB,以人白血病K562细胞为细胞模型,初步探讨了不同质量浓度TH-LCB对K562细胞的增殖活性、细胞周期、细胞凋亡率及Caspse-3蛋白表达量的影响,为开发靶向治疗白血病的天然抗肿瘤药物提供理论依据。
1 材料与方法
1.1 材料与试剂
人慢性髓源白血病癌细胞系K562细胞株 中国科学院上海细胞生物学研究所细胞库。
罗非鱼头 海南泉溢食品有限公司;胎牛血清、青霉素、链霉素、磷酸盐缓冲液(phosphate buffered saline,PBS)和RPMI1640培养基 美国Gibco公司;四甲基偶氮唑盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)、二甲基亚砜和盐酸阿霉素 美国Sigma公司;细胞培养皿 美国Thermo Scientif i c公司;细胞周期试剂盒、Annexin V细胞凋亡试剂盒 德国Merck Millipore公司;Caspase-3抗体美国Cell Signaling公司;BCA蛋白浓度测定试剂盒碧云天生物技术研究所;GAPDH抗体 杭州贤至科技公司;其余试剂均为国产分析纯。
1.2 仪器与设备
旋转蒸发器 上海亚荣生化仪器厂;MuseTM细胞分析仪 德国Merck Millipore公司;多功能酶标仪、细胞计数器、电泳仪、转膜仪 美国伯乐公司;低温离心机 美国Sigma公司;CO2恒温培养箱 美国Thermo Scientif i c公司。
1.3 方法
1.3.1 TH-LCB的分离纯化
1.3.1.1 罗非鱼头总脂的提取
罗非鱼头用组织捣碎机打浆,真空冻干。称取100 g干燥样品,剪碎加入1 000 mL无水乙醇超声提取1.5 h,重复提取3 次,超滤取滤液,真空旋转蒸发浓缩至浸膏状(45 ℃);以氯仿-甲醇-水(8∶4∶3,V/V)混悬,涡旋混合1 min,25 ℃、4 000 r/min离心10 min,弃上清液,收集下层有机相;有机相中加入20%体积的质量分数0.9% NaCl溶液,涡旋混合1 min,离心(条件同上)弃上清液,将下层有机相真空旋转蒸发至干[12-13]。
1.3.1.2 罗非鱼头总脂的硅胶柱层析分离
罗非鱼头脂质经中压纯化与制备系统硅胶柱层析进行分离。总脂溶解于少量氯仿,连接到中压纯化与制备系统硅胶柱,用不同极性的有机溶剂进行洗脱,得到不同极性的洗脱组分。洗脱条件:进样量2 mL,进样质量浓度20~30 mg/mL,流速10 mL/min,检测波长205 nm,监测波长210 nm。分别用氯仿、丙酮和甲醇进行洗脱,得到氯仿(组分1)、丙酮(组分2)和甲醇洗脱物(组分3),真空旋转蒸发浓缩至干。
1.3.1.3 罗非鱼头不同极性脂质的薄层层析
罗非鱼头脂质的分布:展开系统:正己烷、乙醚、甲醇、乙酸混合液(90∶20∶5∶2,V/V);显色剂:碘蒸气。将1.3.1.2节洗脱得到的氯仿洗脱物、丙酮洗脱物、甲醇洗脱物和罗非鱼头总脂分别进行展开。将样品点样在薄层硅胶板上,点样量约10 μL,将薄层板放入密闭的展开系统中,待溶剂迁移至硅胶板距上边沿1 cm处,取出硅胶板挥干溶剂,放入碘蒸气中显色数秒,取出拍照。
丙酮洗脱物的检识:展开系统:氯仿、甲醇、乙酸混合液(65∶15∶2,V/V);显色剂:莫氏试剂(15%α-萘酚、乙醇、硫酸、乙醇、水混合液,10.5∶6.5∶40.5∶4,V/V)。具体操作同上,丙酮洗脱物在展开溶剂中展开后,将薄层板浸没在莫氏试剂中数秒,110 ℃烘箱中加热显色5 min,观察显色情况[14-15]。
1.3.2 TH-LCB的制备
1.3.2.1 糖脂的皂化
将浓缩的糖脂粗提物溶解于100 mL 0.4 mol/L KOH-CH3OH溶液,37 ℃水浴2 h;冷却后加入100 mL水,在冰浴中用1 mol/L HCl溶液将pH值调至6。然后用100 mL氯仿萃取3 次,收集下层有机相。合并有机相减压浓缩至干。
1.3.2.2 糖脂的水解
皂化后的糖脂中加入100 mL 10% HCl-CH3OH溶液,密封置于70 ℃水浴反应18 h;用100 mL正己烷萃取3 次,收集下层甲醇相,用氨水将pH值调至7,减压浓缩至干;用100 mL蒸馏水混悬,并用100 mL乙酸乙酯萃取3 次,将乙酸乙酯相减压浓缩至干即得TH-LCB粗品(淡黄色粉末)。
1.3.3 TH-LCB的纯化
1.3.3.1 HP-20大孔树脂吸附
将大孔树脂装入层析柱(1.8 cm×30 cm)中,制备的TH-LCB粗品溶解于1 mL甲醇,湿法上样;首先用甲醇(1 mL/min)洗脱2 个柱体积;接着用丙酮洗脱,以除去色素和未水解的脂质;收集丙酮洗脱液,减压浓缩至干。
1.3.3.2 TH-LCB的硅胶柱层析
将吸附后的甲醇洗脱物溶解于少量氯仿,用氯仿和甲醇以一定体积比进行线性洗脱。洗脱条件:流速10 mL/min,检测波长210 nm,检测波长230 nm,使用氯仿-甲醇(体积比由22∶1变为18∶1)进行线性洗脱,根据紫外检测器下的洗脱峰进行收集[16]。
1.3.4 TH-LCB的薄层层析
展开系统:氯仿、甲醇、氨水混合液(40∶10∶1,V/V);显色剂:2%茚三酮-乙醇溶液(0.1 g茚三酮溶解于50 mL乙醇)。当溶剂迁移到硅胶板9 cm处时,取出薄层板,待溶剂挥干,浸没入显色剂中数秒,110℃烘箱中显色5 min,观察显色情况[17]。
1.3.5 TH-LCB对K562细胞增殖的影响
收集对数生长期的K562细胞,吸取10 μL细胞悬液加入细胞检测板,用细胞计数器计数,调整细胞浓度至6×104个/mL,接种于96 孔板,每孔90 μL,培养24 h;实验设置对照组、TH-LCB组和盐酸阿霉素对照组,每孔给相应质量浓度的药物10 μL,使TH-LCB终质量浓度为25、50、100、200 μg/mL,每个浓度设置6 个重复。分别培养24、48 h后,每孔加入20 μL 5 mg/mL MTT溶液,于培养箱中培养4 h,每孔加入三联溶解液100 μL,于37 ℃恒温培养箱培养过夜,在酶标仪上于570 nm波长处测定各孔的吸光度A570nm。按照下式计算细胞存活率。同时TH-LCB对K562细胞增殖抑制作用也可用半数抑制浓度(half maximal inhibitory concentration,IC50)表示。TH-LCB的IC50通过SPSS 20.0软件计算。

式中:A实验组、A对照组分别表示给药组、对照组的吸光度。
1.3.6 TH-LCB对K562细胞凋亡率的影响
对数生长期的K562细胞经过不同浓度的TH-LCB处理后,冰上收集细胞,4℃、1 000 r/min离心5 min弃去培养液,用PBS洗涤2 遍,离心,加培养基重悬,使细胞浓度达到5×105个/mL;在新的EP管中加100 μL细胞悬液,再加100 μL细胞凋亡试剂,在室温下培养20 min;涡旋振荡,用MuseTM细胞分析仪进行检测,重复3 次。
1.3.7 TH-LCB对K562细胞周期的影响
将900 μL细胞悬液(6×104个/mL)接种于24 孔板,培养24 h后,用不同质量浓度TH-LCB处理细胞24 h,每孔100 μL,TH-LCB的终质量浓度为25、50、100、200 μg/mL。根据细胞周期试剂盒的说明书,冰上收集TH-LCB处理后的细胞,4℃、1 000 r/min离心5 min,吸弃培养液;用预冷的PBS洗涤2 遍,离心去上清液;分别加入冰的70%乙醇混悬细胞,使细胞浓度达到5×105个/mL;在-20 ℃下固定至少3 h,在1.5 mL EP管中加入200 μL固定的细胞,离心后去上清液,用预冷的PBS洗涤2 遍,离心;每个EP管中加入200 μL细胞周期试剂,在室温下黑暗培养30 min,用MuseTM细胞分析仪进行检测,重复3 次。
1.3.8 TH-LCB对K562细胞内Caspase-3蛋白表达量的影响
对数生长期的K562细胞经不同质量浓度的TH-LCB处理后,冰上收集细胞;用RIPA裂解液提取细胞总蛋白,通过BCA试剂盒测定各组的蛋白质量浓度,将细胞浓度调整一致;蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,将蛋白转移到聚偏氟乙烯膜上,然后用含5%的脱脂乳粉的TBST溶液封闭1 h,一抗4℃孵育过夜,TBST溶液漂洗3 遍,每次15 min,二抗37 ℃孵育1 h,TBST溶液漂洗3 遍,用显色剂ECL试剂盒显色。以GAPDH为内参计算Caspase-3蛋白的表达量。
1.4 数据统计分析
采用SPSS 20.0软件对实验数据进行统计学分析,数据以的形式表示。各处理组间比较采用单因素方差分析,P<0.01,两两比较采用t检验。
2 结果与分析
2.1 罗非鱼头不同极性脂质的分离及薄层检识结果
罗非鱼头经无水乙醇超声提取后,通过萃取和盐析去除水溶性组分和蛋白质。由于不同脂质在固定相和流动相上吸附与解吸附能力不同,将罗非鱼头总脂进行硅胶柱分离,以硅胶为吸附介质,用不同极性的溶剂洗脱,得到不同极性的脂质。如图1A所示,根据紫外检测器下的洗脱峰进行收集,氯仿洗脱出现第1个洗脱峰,收集得到极性最小的组分1;丙酮洗脱出现第2个洗脱峰,收集得到极性较大的组分2;甲醇洗脱出现第3个洗脱峰,收集得到组分3。
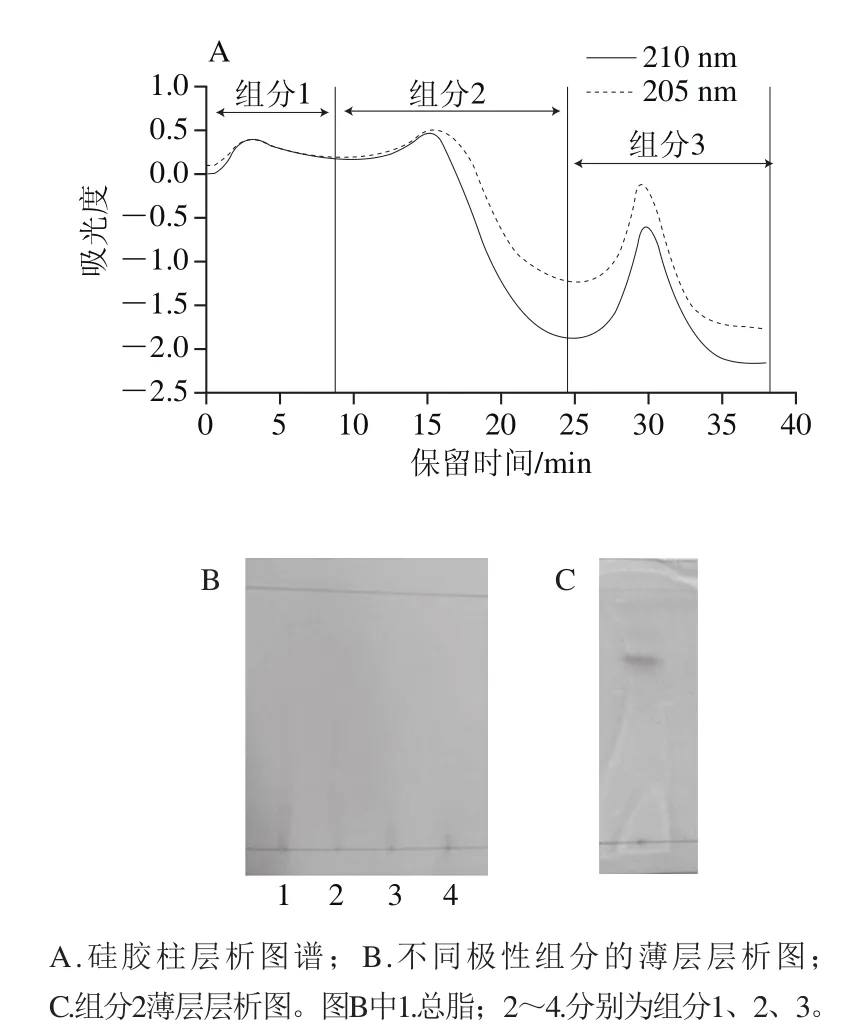
图1 罗非鱼头总脂的硅胶柱层析图谱和不同组分的薄层层析图Fig.1 Silica gel column chromatography of total lipids from tilapia head and TLC analysis of lipid fractions
在同一展开系统下,不同极性脂质在薄层板上的展开距离不同。极性较小的脂质,硅胶对其吸附能力弱,展开距离较短。罗非鱼头不同极性脂质在碘蒸气下显色的结果如图1B所示。沿着薄层板,极性大的组分3保留在原点,极性较大的组分2靠近原点,极性小或无极性的组分1迁移距离相对较大。从图1B可以看出,经过硅胶柱层析,不同极性的罗非鱼头脂质分离效果较好。组分2的检识结果如图1C所示,组分2在莫氏试剂显色下呈红紫色斑点。因为糖基在浓硫酸作用下,脱水生成糠醛及糠醛衍生物,后者能与α-萘酚(莫氏试剂)生成紫红色物质。因此可以判断组分2是糖脂,可以用于后续的研究。
2.2 TH-LCB的硅胶柱层析及薄层色谱检识结果
糖脂的水解方式主要有酸水解和碱水解,二者的水解产物有较大差别,碱水解的水解程度较低,所得的长链碱含量少,但其他非长链碱杂质含量少;酸水解对糖脂的水解比较完全,所得含量较高,组成复杂,为了保证TH-LCB的得率,使用10% HCl-CH3OH溶液对罗非鱼头糖脂进行酸水解,从而得到TH-LCB;TH-LCB经过大孔树脂吸附,去除色素等杂质;然后将TH-LCB经过硅胶柱层析进行纯化。硅胶柱层析图谱(图2A)表明,洗脱时间为10 min,出峰时间为1.0~4.5 min。收集紫外检测器下的洗脱峰即脱除部分杂质的TH-LCB组分。洗脱的杂质可能是脑苷脂水解不完全而产生的神经酰胺以及TH-LCB与糖结合产生的产物。
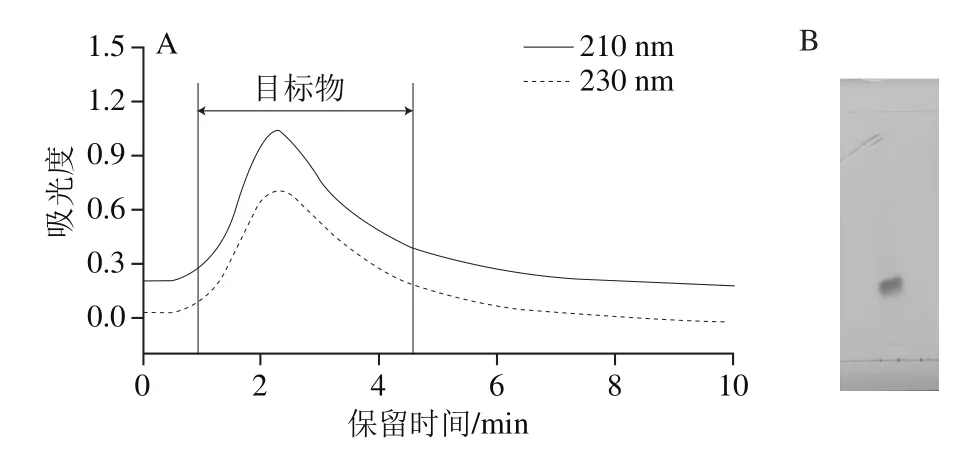
图2 TH-LCB的硅胶柱层析谱图(A)及薄层层析图(B)Fig.2 Silica gel column chromatography (A) and TLC (B)analysis of TH-LCB
如图2B所示,TH-LCB采用薄层层析检识,显色结果为紫红色斑点,其比移值为0.32。特征显色结果表明TH-LCB为鞘氨醇类化合物。这一结果与冯婷玉[17]的结果相似,可初步判断皂化水解得到的组分是TH-LCB。另外,茚三酮显色结果表明,紫红色斑点清晰,无其他斑点,说明制备TH-LCB纯度较高,杂质较少,糖脂水解完全。
2.3 TH-LCB对K562细胞形态的影响
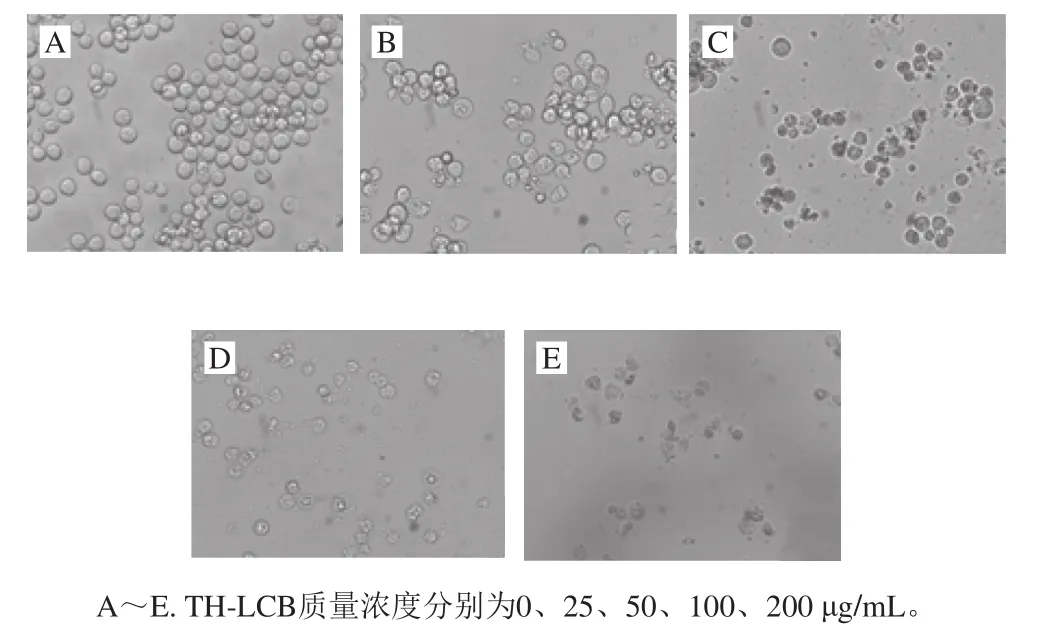
图3 TH-LCB对K562细胞形态的影响(200×)Fig.3 Morphological change of K562 cells after treatment with different concentrations of TH-LCB (200 ×)
如图3所示,正常对照组K562细胞生长状态良好,边缘光滑清晰,细胞透明、大小均一,细胞核完整均匀;细胞经不同质量浓度TH-LCB作用24 h后,K562的生长增殖受到抑制,细胞密度明显减少,细胞形态大小不一,发生了明显的形态改变,细胞碎片增多,碎片呈小片状。当TH-LCB的质量浓度为50 μg/mL时,细胞生长增殖被显著抑制,细胞形态发生明显的变化。Sugawara等[7,18]的研究表明,小麦粉长链碱和海参长链碱可使细胞核凝聚,染色质碎片化,从而引起人结肠癌DLD-1细胞形态的变化。
2.4 TH-LCB对K562细胞增殖的抑制作用
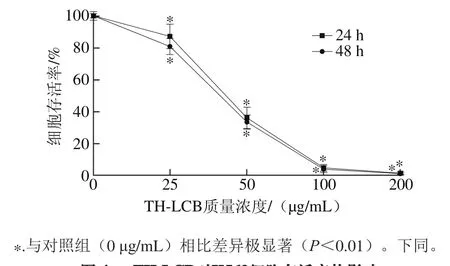
图4 TH-LCB对K562细胞存活率的影响Fig.4 Viability of K562 cells after treatment with various concentrations of TH-LCB
由图4可知,随着TH-LCB质量浓度的增加,细胞增殖受到显著抑制,呈明显的剂量依赖效应。TH-LCB作用于K562细胞24 h和48 h后的IC50分别为42.207、39.494 μg/mL。MTT测定结果表明,TH-LCB显著地抑制细胞增殖活性。杜磊[19]发现了海参和海星长链碱显著抑制S180、HepG2、Caco-2和HGC-27等肿瘤细胞的增殖活性,呈明显的剂量依赖性。Sugawara等[7]发现花刺参长链碱可以显著抑制人结肠癌细胞系DLD-1、WiDr和Caco-2的生长增殖,且呈明显的剂量依赖效应。还有研究证明海绵长链碱可以显著抑制胶质瘤细胞(U87)和人神经母细胞瘤细胞(SH-SY5Y)的增殖活性[20]。
2.5 TH-LCB诱导K562细胞凋亡
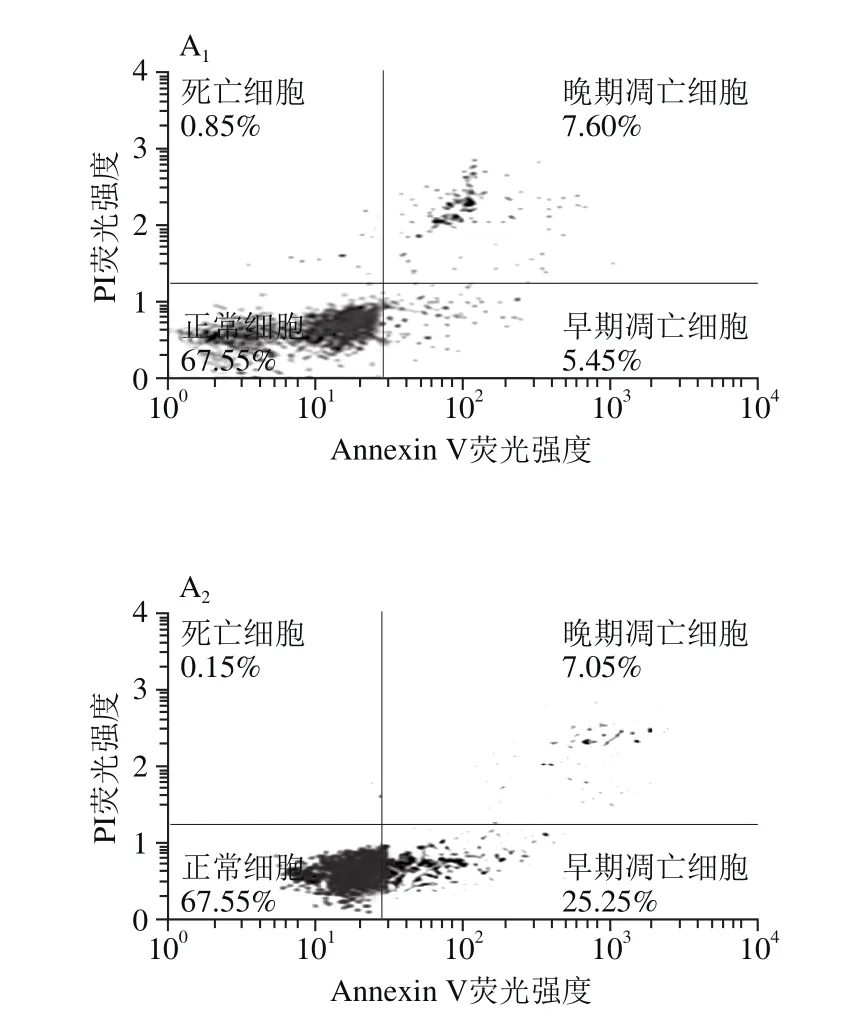
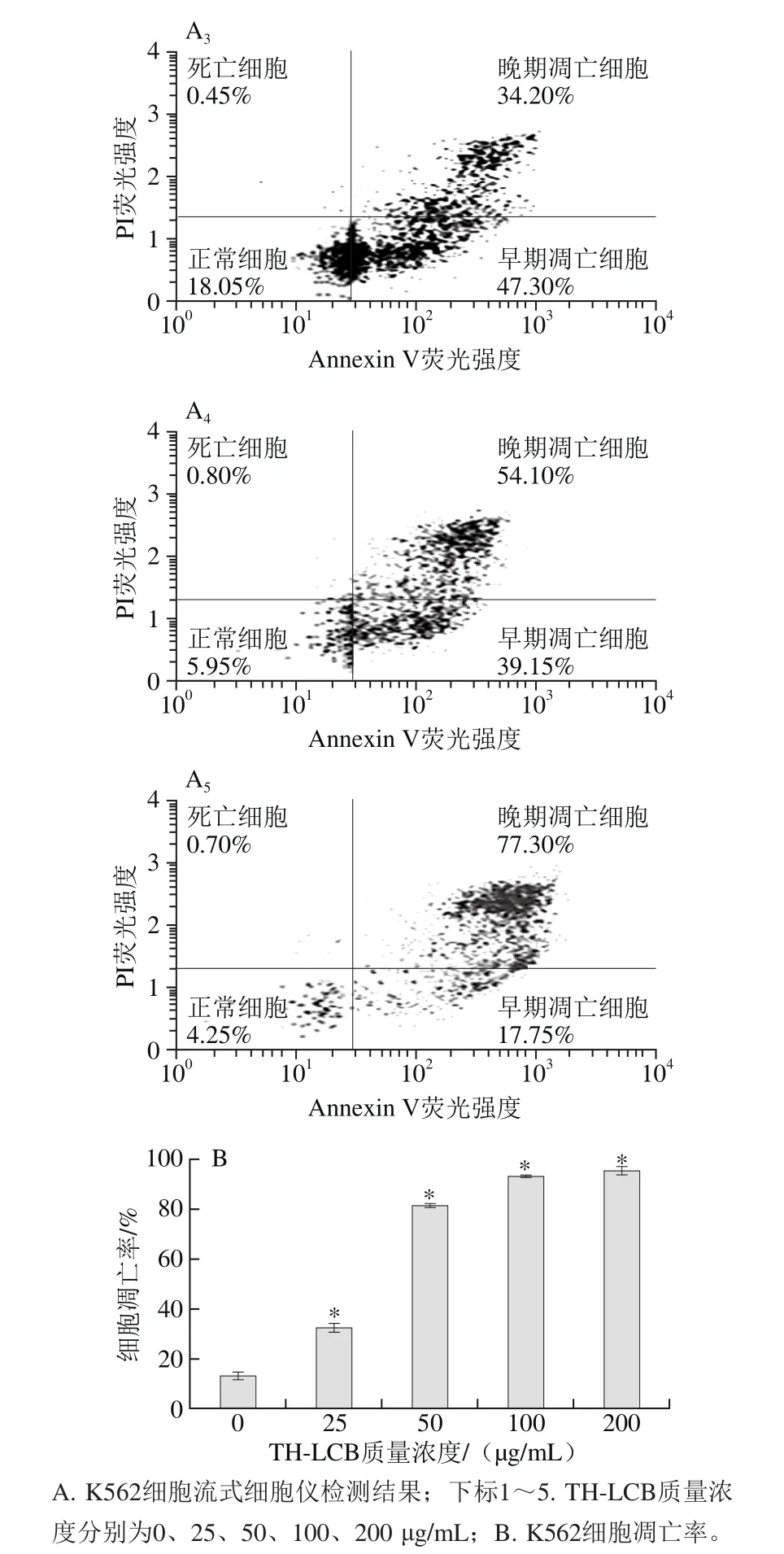
图5 TH-LCB对K562细胞凋亡率的影响Fig.5 Apoptosis rates of K562 cells after treatment with various concentrations of TH-LCB
由图5可知,早期凋亡细胞指Annexin-PE(+)和Dead Cell Marker(-)的细胞群;晚期凋亡细胞是指Annexin-PE(+)和Dead Cell Marker(+)的细胞群;总凋亡率为早期凋亡率与晚期凋亡率的总和。结果表明,TH-LCB显著增加K562细胞的凋亡率,呈剂量依赖效应。当TH-LCB为25 μg/mL时,细胞凋亡主要是早期凋亡,随着TH-LCB质量浓度的增加,晚期凋亡的细胞群也逐渐增加,总凋亡率也逐渐增加。当TH-LCB质量浓度达到100 μg/mL时,细胞几乎全部凋亡。流式细胞仪的结果表明:TH-LCB抑制K562细胞的增殖是通过诱导细胞凋亡实现的。另外,当TH-LCB质量浓度高时,K562细胞存活率较低,细胞碎片化程度高,会影响流式细胞仪的检测结果。Aida等[8]的研究表明,植物和真菌长链碱能诱导人类结肠癌细胞Caco-2细胞凋亡。Hossain等[9]发现从海参中提取的长链碱可以通过提高DR5和降低p-AKT的蛋白表达,来诱导人肝癌细胞HepG2的凋亡。Hung等[21]研究了鞘氨醇和其他长链碱通过激活Caspases来诱导人肝癌Hep3B细胞凋亡。本研究进一步证明了TH-LCB能通过诱导肿瘤细胞凋亡来抑制细胞的增殖活性。
2.6 TH-LCB对K562细胞周期的影响
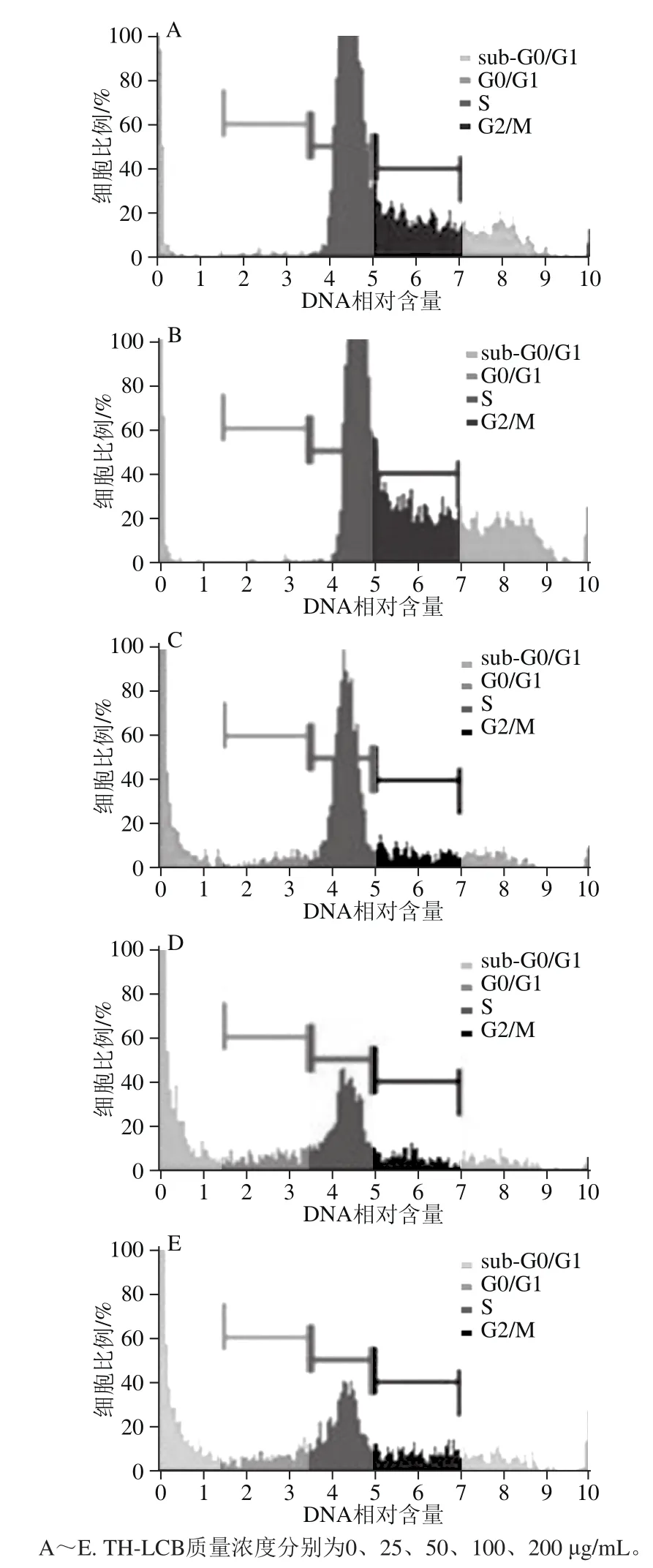
图6 不同质量浓度TH-LCB对K562细胞周期影响的流式细胞仪检测结果Fig.6 Flow cytometric cell cycle analysis of K562 cells after treatment with various concentrations of TH-LCB

表1 不同质量浓度TH-LCB对K562细胞周期的影响Table1 Effect of TH-LCB on cell cycle of K562 cells
细胞周期的调控在细胞增殖和凋亡过程中起着重要的作用。细胞周期可分为G0/G1、S、G2/M 3 个阶段,其中G0/G1期是细胞进行大量物质合成的时期,为DNA的合成做准备,在S期细胞完成DNA的复制及合成组蛋白,G2/M期是指DNA复制结束和开始有丝分裂的间隙[22-23]。在正常G0/G1期前出现一个DNA低染细胞群,称为“sub-G0/G1”,即凋亡峰,该凋亡峰的大小代表凋亡细胞的多少。K562细胞经不同质量浓度TH-LCB处理24 h后,检测结果如图6和表1所示,随着TH-LCB质量浓度的增加,sub-G0/G1(凋亡峰)呈上升趋势,且S期的细胞群逐渐减少。细胞周期结果表明TH-LCB可以诱导K562细胞的凋亡。Ahn等[24]通过流式细胞仪测定鞘氨醇碱作用结肠癌细胞后,sub-G0/G1期的细胞群逐渐增多,且将细胞周期阻滞在G2/M期。
2.7 TH-LCB对Caspase-3蛋白表达量的影响

图7 TH-LCB对K562细胞内Caspase-3蛋白表达的影响Fig.7 Effect of TH-LCB on expression of caspase-3 in K562 cells
Western blot实验结果(图7)表明,0、25、50、100、200 μg/mL TH-LCB处理K562细胞24 h后,细胞内促凋亡蛋白Caspase-3的表达量极显著升高(P<0.01),呈剂量依赖性。进一步证明TH-LCB对K562细胞具有凋亡诱导作用。Caspase-3是细胞凋亡蛋白酶级联反应的关键酶和执行者,处于细胞凋亡的下游[25]。经典凋亡通路主要有:Bcl-2家族成员介导的线粒体凋亡通路和死亡受体通路,两者都是通过激活下游的Caspase-3促进细胞凋亡。在死亡受体通路中,死亡信号的传导依赖于靶细胞表面的死亡配体与携带凋亡信号的受体的专一性结合,并迅速将凋亡信号转导到细胞内,激活下游的Caspase-3,从而诱导细胞凋亡[26-27]。在线粒体途径中,细胞受到凋亡刺激后,线粒体膜通透性增加,细胞色素c迅速从线粒体释放到胞浆,细胞色素c、Apaf-1、dATP和Caspase-9酶原结合形成凋亡多聚复合物[28],激活Caspase-9,接着激活下游的Caspase-3,引起细胞凋亡[29-30]。但TH-LCB对K562细胞的凋亡诱导是通过死亡受体通路还是通过线粒体凋亡通路?还有待于进一步的研究。
3 结 论
本实验采用有机溶剂提取法,从罗非鱼头中提取总脂,除杂后经硅胶柱分离得到糖脂;接着进行糖脂的皂化、酸水解,得到TH-LCB;最终经过硅胶柱线性洗脱和大孔树脂脱色,得到纯化后的TH-LCB。纯化后的TH-LCB经薄层层析检识,得到清晰单一的红紫色斑点。细胞实验研究了TH-LCB对K562细胞的形态、增殖活性、细胞周期、细胞凋亡率、Caspase-3蛋白表达量的影响。结果发现,当TH-LCB质量浓度为50 μg/mL时细胞形态已发生明显的变化;TH-LCB作用于K562细胞24 h和48 h后的IC50分别为42.207、39.494 μg/mL;经流式细胞仪分析的结果显示,随着TH-LCB质量浓度的升高,K562细胞凋亡率逐渐上升,其sub-G0/G1(凋亡峰)也逐渐升高;Western blot结果显示,TH-LCB处理K562细胞后细胞内Caspase-3的蛋白表达量上升,呈剂量依赖效应。
[1] 何其, 王晶, 曹雪涛, 等. 基于质构变化的罗非鱼片冻藏保质期预测[J].食品科学, 2014, 35(10): 241-245. DOI:10.7506/spkx1002-6630-201410045.
[2] 陈伟华, 许长华, 樊玉霞, 等. 近红外光谱技术快速无损评价罗非鱼片新鲜度[J]. 食品科学, 2014, 35(24): 164-168. DOI:10.7506/spkx1002-6630-201424031.
[3] KARLSSON K A. Sphingolipid long chain bases[J]. Lipids, 1970,5(11): 878-891. DOI:10.1007/BF02531119.
[4] PRUETT S T, BUSHNEV A, HAGEDORN K, et al. Biodiversity of sphingoid bases (“sphingosines”) and related amino alcohols[J].Journal of Lipid Research, 2008, 49(8): 1621-1639.
[5] 徐杰. 海参脑苷脂的分离纯化、结构分析及其生物活性的初步研究[D]. 青岛: 中国海洋大学, 2011: 28-80. DOI:10.7666/d.y1928287.
[6] OHTA H, SWEENEY E A, MASAMUNE A, et al. Induction of apoptosis by sphingosine in human leukemic HL-60 cells: a possible endogenous modulator of apoptotic DNA fragmentation occurring during phorbol ester-induced differentiation[J]. Cancer Research,1995, 55(3): 691-697.
[7] SUGAWARA T, ZAIMA N, YAMAMOTO A, et al. Isolation of sphingoid bases of sea cucumber cerebrosides and their cytotoxicity against human colon cancer cells[J]. Bioscience, Biotechnology, and Biochemistry, 2006, 70(12): 2906-2912. DOI:10.1271/bbb.60318.
[8] AIDA K, KINOSHITA M, SUGAWARA T, et al. Apoptosis inducement by plant and fungus sphingoid bases in human colon cancer cells[J]. Journal of Oleo Science, 2004, 53(10): 503-510.DOI:10.5650/jos.53.503.
[9] HOSSAIN Z, SUGAWARA T, HIRATA T. Sphingoid bases from sea cucumber induce apoptosis in human hepatoma HepG2 cells through p-AKT and DR5[J]. Oncology Reports, 2013, 29(3): 1201-1207.DOI:10.3892/or.2013.2223.
[10] KAGEDAL K, ZHAO M, SVENSSON I, et al. Sphingosine-induced apoptosis is dependent on lysosomal proteases[J]. Biochemical Journal, 2001, 359(2): 335-343. DOI:10.1042/bj3590335.
[11] CHANG H C, HSU C, HSU H K, et al. Functional role of caspases in sphingosine-induced apoptosis in human hepatoma cells[J]. IUBMB Life, 2003, 55(7): 403-407.
[12] CHEN L P, SHEN X R, CHEN G H, et al. Effect of three-spot seahorse petroleum ether extract on lipopolysaccharide induced macrophage RAW264.7 inflammatory cytokine nitric oxide and composition analysis[J]. Journal of Oleo Science, 2015, 64(9): 933-942. DOI:10.5650/jos.ess15092.
[13] CHEN L P, SHEN X R, CHEN G H, et al. A comparative study of the effects upon LPS induced macrophage RAW264.7 inf l ammation in vitro of the lipids of hippocampus trimaculatus leach[J]. Journal of Oleo Science, 2015, 64(12): 1-9. DOI:10.5650/jos.ess15190.
[14] 盖立学, 宋考平. 基于糖显色法测定鼠李糖脂的比例、含量[J]. 生物技术, 2010, 20(2): 33-37.
[15] ARINO S, MARCHAL R, VANDECASTEELE J P. Identification and production of a rhamnolipidic biosurfactant by a Pseudomonas species[J]. Applied Microbiology and Biotechnology, 1996, 45(1):162-168. DOI:10.1007/s002530050665.
[16] SOLFRIZZO M, AVANTAGGIATO G, VISCONTI A. Rapid method to determine sphinganine/sphingosine in human and animal urine as a biomarker for fumonisin exposure[J]. Journal of Chromatography B Biomedical Sciences & Applications, 1997, 692(1): 87-93.DOI:10.1016/S0378-4347(96)00502-6.
[17] 冯婷玉. 海地瓜(Acaudina molpadioides)活性脂质的制备研究及抗肿瘤活性初探[D]. 青岛: 中国海洋大学, 2011: 37-39. DOI:10.7666/d.y1927898.
[18] SUGAWARA T, KINOSHITA M, OHNISHI M, et al. Apoptosis induction by wheat-flour sphingoid bases in DLD-1 human colon cancer cells[J]. Bioscience Biotechnology & Biochemistry, 2002,66(10): 2228-2231. DOI:10.1271/bbb.66.2228.
[19] 杜磊. 海参和海星脑苷脂抗肿瘤及改善癌症恶病质作用的研究[D].青岛: 中国海洋大学, 2012: 17-21. DOI:10.7666/d.y2157869.
[20] BIEGELMEYER R, SCHRODER R, RAMBO D F, et al. Sphingosines derived from marine sponge as potential multi-target drug related to disorders in cancer development[J]. Marine Drugs, 2015, 13: 5552-5563. DOI:10.3390/md13095552.
[21] HUNG W C, CHANG H C, CHUANG L Y. Activation of caspase-3-like proteases in apoptosis induced by sphingosine and other longchain bases in Hep3B hepatoma cells[J]. The Biochemical Journal,1999, 338: 161-166. DOI:10.1042/bj3380161.
[22] 刘嘉锋, 张一鸣, 易传勋, 等. 性激素受体在瘢痕中的表达及与细胞周期调控蛋白相互关系的研究[J]. 中华整形外科杂志, 2004, 20(4):265-267. DOI:10.3760/j.issn:1009-4598.2004.04.007.
[23] 詹启敏, 陈杰. 细胞周期与肿瘤转化医学[J]. 中国肿瘤临床, 2014,41(1): 1-7. DOI:10.3969/j.issn.1000-8179.20132205.
[24] AHN E H, SCHROEDER J J. Induction of apoptosis by sphingosine,sphinganine, and C2-ceramide in human colon cancer cells, but not by C2-dihydroceramide[J]. Anticancer Research, 2010, 30(7): 2881-2884.
[25] HENGARTNER M O. The biochemistry of apoptosis[J]. Nature,2000, 407: 770-776.
[26] KINNALLY K W, ANTONSSON B. A tale of two mitochondrial channels, MAC and PTP, in apoptosis[J]. Apoptosis, 2007, 12(5): 857-868. DOI:10.1007/s10495-007-0722-z.
[27] WYLLIE A H. “Where, o death, is thy sting?” a brief review of apoptosis biology[J]. Molecular Neurobiology, 2010, 42(1): 4-9.DOI:10.1007/s12035-010-8125-5.
[28] 王海燕, 王来栓, 归绥琪. 细胞凋亡通路研究进展[J]. 国外医学(生理、病理科学与临床分册), 2003, 23(5): 490-492. DOI:10.3969/j.issn.1673-2588.2003.05.018.
[29] FESIK S W. Promoting apoptosis as a strategy for cancer drug discovery[J]. Nature Reviews Cancer, 2005, 5(11): 876-885.DOI:10.1038/nrc1736.
[30] BUDIHARDJO I, OLIVER H, LUTTER M, et al. Biochemical pathways of caspase activation during apoptosis[J]. Annual Review of Cell & Developmental Biology, 1999, 15(1): 269-290. DOI:10.1146/annurev.cellbio.15.1.269.
