两亲性胆酸化壳聚糖微胶囊包埋VA
2018-03-20宋丽洁黄晶晶胡梦欣
宋丽洁,郭 谦,李 想,黄晶晶,胡梦欣*
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
随着生活水平的不断提高,人们日益重视和追求绿色天然、营养健康的功能性食品。食品功能性成分VA是人体必需脂溶性维生素之一,具有维持人体正常视觉,提高机体免疫力,促进人体生长发育,解毒抗癌等多项重要的生理功能[1-3]。缺乏VA可引起夜盲症、毛囊上皮角质化,并导致骨骼发育迟缓、免疫力低下[4]。由于人体不能合成VA,所以必须由摄入食物来满足人体所需[5]。但VA具有令人不悦的气味,在空气中稳定性差,对光、热敏感,极易发生氧化分解而破坏其生物活性[6]。因此,提高VA的稳定性和加工性在实际的应用中显得尤为重要。微胶囊技术就是实现这一目标的重要方法之一[7]。
微胶囊技术是一种利用天然或合成高分子材料,将固体、液体甚至是气体物质包埋起来,形成具有半透性或密封囊膜的微型胶囊技术。其中,被包覆的物质称为微胶囊的芯材,用来包覆的物质称为壁材[8-9]。壁材对芯材起到隔离和保护的作用,减轻外界环境,如紫外线、氧气、光等对敏感芯材的影响,提高芯材的稳定性,并延长其贮存期。同时,壁材还具有遮蔽作用,可以掩盖芯材的不良气味和色泽等。再者,壁材具有缓释功能,能够控制包埋组分的释放,实现功能成分在消化系统中的精准吸收。因此,包埋功能成分的微胶囊在食品、医药、生物技术等领域具有广泛的应用前景[10-15]。
壳聚糖是甲壳素脱乙酰基后的产物。壳聚糖是自然界中存在的唯一碱性多糖,广泛存在于虾、蟹、藻类、真菌等动植物和微生物中。壳聚糖含量极其丰富,自然界每年产量约100亿 t,是仅次于纤维素的天然高分子材料[16]。由于壳聚糖无毒,同时具有良好的生物相容性、安全性和生物可降解性[17-19],被广泛用于医药、食品和日化等领域,已成为21世纪重点开发的生物新材料。在医药学领域,壳聚糖微胶囊用于药物缓释放,有效提高了药物疗效[20-25]。在保健品领域,由于壳聚糖具有强化免疫机能、延缓衰老、预防疾病和调节人体生理机能等多重作用,被誉为继蛋白质、脂肪、糖类、维生素、无机盐之后的第六生命要素[26]。以壳聚糖为壁材,在微胶囊包埋VC、VE、姜黄油、蛋白质和肉桂精油等方面已取得一定成效[27-32],其被视为微胶囊的理想壁材。
但是,由于壳聚糖是一种具有氨基和羟基的聚电解质,分子间和分子内存在较强的氢键作用力,因此,壳聚糖不溶于水,只溶于醋酸、苯甲酸等弱酸溶液中,大大限制了壳聚糖的应用。基于壳聚糖分子中氨基和羟基的高反应活性,通过对壳聚糖分子进行化学改性,引入其他化学基团,既可解决壳聚糖水溶性差的不足,还可赋予壳聚糖分子新的功能,进一步拓宽壳聚糖的应用领域。
胆酸(cholic acid,CA)是存在于人和动物体内的天然分子,由胆固醇在肝脏中合成,在化学结构上具有亲水的一面和憎水的一面。将胆酸分子化学键合到高分子链上,可赋予高分子两亲性,进而在溶液中自组装形成纳米微胶囊[33-34]。两亲性胆酸化高分子自组装形成的纳米微胶囊在溶液中十分稳定,可用于包埋难溶的组分[35-36]。
本研究旨在合成两亲性的胆酸化壳聚糖衍生物,通过在水溶液中自组装形成纳米微胶囊,包埋VA,制备可均匀分散在水体系中的VA纳米微胶囊,保护VA不被氧化,延长VA的货架期,拓宽其在医药和食品领域的应用。
1 材料与方法
1.1 材料与试剂
壳聚糖(中黏度200~400 MPa·s,脱乙酰度>90%)、胆酸(无水胆酸,98%)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺(1-ethyl-3-(3-dimethylaminopropyl)-carbodiimide hydrochloride,EDC)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS) 阿拉丁试剂有限公司;芘(纯度≥99.0%) 美国Sigma-Aldrich公司;2-氯乙醇(纯度99%) 西亚试剂有限公司;甲醇、乙醇上海凌峰化学试剂有限公司。上述试剂均为分析纯。
1.2 仪器与设备
Vector22傅里叶变换红外(Fourier transform infrared,FT-IR)光谱仪、核磁共振(nuclear magnetic resonance,NMR)仪 德国BRUKER公司;动态光散射仪 德国ALV公司;荧光分光光度仪 日本JASCO公司;离心机 美国Beckman Coulter公司;数控超声仪 昆山市超声仪器有限公司;电子天平 梅特勒-托利多仪器(上海)有限公司;集热式恒温加热磁力搅拌器杭州大力科教仪器有限公司;旋转蒸发器 上海亚荣生化仪器厂;真空冷冻干燥机 德国Christ公司。
1.3 方法
1.3.1 两亲性胆酸化壳聚糖的合成

图1 两亲性胆酸化壳聚糖的合成示意图Fig.1 Schematic diagram for the synthesis of amphiphilic CA-modif i ed chitosan
两亲性胆酸化壳聚糖的合成路线主要包括两步,如图1所示。第一步是水溶性羟乙基壳聚糖的合成。称取1 g壳聚糖加入到20 mL 50%的氢氧化钠溶液中,于0~5 ℃碱化48 h,然后向碱化后的壳聚糖溶液中加入12 mL异丙醇,并缓慢滴加一定量的2-氯乙醇,于60 ℃搅拌反应24 h,得到淡黄色黏稠状产物。反应液冷却后,20 ℃、8 000 r/min离心20 min,得到淡黄色沉淀产物。向沉淀中加入20 mL去离子水室温溶解,得到淡黄色溶液和少量不溶物,滴加5%盐酸将溶液pH值调整到7.0,并放入透析袋(截留分子质量为8 000~14 000 Da)中,用去离子水透析48 h,每3~4 h换一次水。将透析后的产物进行冷冻干燥,即可得到水溶性的羟乙基壳聚糖。
第二步是两亲性胆酸化壳聚糖的合成。按文献[37]方法,略有改动。称取一定质量的水溶性羟乙基壳聚糖,加入去离子水将其溶解,另称取一定量的胆酸(胆酸与壳聚糖葡萄糖胺残基的摩尔比为0.012∶1~0.340∶1)用适量甲醇溶解,同时称取等量的EDC和NHS用甲醇溶解;然后,分别将胆酸、EDC与NHS溶液加入到溶解后的羟乙基壳聚糖溶液中,室温下搅拌反应24 h。将反应产物先后用80%甲醇水溶液、50%甲醇水溶液和去离子水各透析(截留分子质量8 000~14 000 Da)24 h;最后,将透析液冷冻干燥,得到两亲性的胆酸化壳聚糖。
1.3.2 壳聚糖衍生物的化学结构表征
采用FT-IR光谱和1H NMR对壳聚糖衍生物进行化学结构表征。采用溴化钾压片法,通过FT-IR光谱对壳聚糖及其衍生物的化学结构进行分析,设置扫描精度2 cm-1、扫描次数32 次,对样品进行扫描,得到壳聚糖及其衍生物的红外光谱图。采用D2O为溶剂,通过NMR仪进一步对壳聚糖衍生物的化学结构进行定性和定量分析,并计算胆酸化壳聚糖分子上的胆酸取代度。取代度是指两亲性胆酸化壳聚糖分子中每100 个壳聚糖结构单元中所含胆酸基团的数目。
1.3.3 两亲性壳聚糖纳米微胶囊
1.3.3.1 两亲性壳聚糖纳米微胶囊的制备
称取25 mg两亲性胆酸化壳聚糖,加入15 mL pH 7.4磷酸盐缓冲液(phosphate buffered saline,PBS)中,在45 ℃恒温水浴中磁力搅拌48 h,然后用超声仪(功率30 W)超声处理,每工作5 s停歇1 s,每次2 min,超声3 次,即得透明均相的纳米胶束溶液,定容备用。
1.3.3.2 两亲性胆酸化壳聚糖的自组装行为研究
采用芘荧光探针法测定两亲性胆酸化壳聚糖在水溶液的自组装行为,计算其临界聚集浓度(critical aggregation concentration,CAC)。具体实验如下:准确称取2 mg芘,用5 mL甲醇溶解,在10 mL容量瓶中定容,制得浓度为1.0×10-3mol/L芘的甲醇溶液。用移液枪移取5 μL芘的甲醇溶液到一系列10 mL容量瓶中,通氮气将瓶中的甲醇吹干。将1.3.3.1节中制备的纳米微胶囊溶液按一定体积分别移入含有芘的10 mL容量瓶中,用pH 7.4 PBS定容,得到0.000 1~1.000 0 mg/mL之间不同质量浓度的含芘纳米微胶囊溶液。将其置于45 ℃水浴中静置24 h,期间超声4~5 次,每次2~3 min。测定荧光光谱,激发光波长为335 nm,发射光波长为390 nm,扫描范围为350~500 nm,激发和发射狭缝均为3 nm。读取372 nm和383 nm波长处的峰强度值I372nm和I383nm。
1.3.4 两亲性壳聚糖自组装纳米微胶囊包埋VA
1.3.4.1 包埋方法
搅拌法:称取1 0 m g两亲性胆酸化壳聚糖与2 mg VA,加入10 mL超纯水和适量1%的醋酸溶液,完全溶解,搅拌30 min。20 ℃、9 000 r/min离心25 min,取上清液,用孔径为0.8 μm的滤膜过滤,收集滤液并进行冷冻干燥处理。
超声法:称取1 0 m g两亲性胆酸化壳聚糖与2 mg VA,加入10 mL超纯水和适量1%的醋酸溶液,完全溶解,在90 W功率下超声,每工作5 s停歇1 s,每次2 min,超声3 次。然后20 ℃、9 000 r/min离心25 min,取上清液,用孔径为0.8 μm的滤膜过滤,收集滤液并进行冷冻干燥处理。
溶剂法:称取10 mg两亲性胆酸化壳聚糖溶解在1 mL超纯水中,称取2 mg VA溶解在1 mL乙醇中,两种溶液混匀后,60 ℃旋蒸10 min后加10 mL超纯水溶解,并用孔径为0.8 μm的滤膜过滤,收集滤液并进行冷冻干燥处理。
1.3.4.2 包埋VA的纳米微胶囊的表征
采用动态光散射仪对溶液中的纳米微胶囊进行分析,测量纳米微胶囊在水溶液中的粒径大小和尺寸分布。使用氦离子激光系统执行动态光散射实验,该实验在激发波长633 nm、(25.0±0.1)℃条件下进行。在测定前,所有样品均用孔径0.45 μm的微滤膜进行前处理。自聚体的质量浓度恒定为1 mg/mL。
此外,采用扫描电子显微镜观察纳米微胶囊的冻干样品的形貌。
1.3.4.3 包埋VA的纳米微胶囊的释放行为
在胃肠液中的释放:模拟胃液的配制:2.0 g NaCl和7 mL 36%的HCl溶液溶解于900 mL去离子水中,调节pH值至1.2,加入3.2 g胃蛋白酶,定容至1 000 mL,4 ℃贮存备用。模拟肠液的配制:6.8 g磷酸二氢钾溶于900 mL去离子水中,振荡完全溶解后,加入NaOH溶液,调节pH值至6.8,加入10.0 g胰蛋白酶,定容至1 000 mL,4 ℃贮存备用。称取80 mg样品,置于50 mL锥形瓶中,加入10 mL模拟胃液(pH 1.2),37 ℃、100 r/min振荡,分别在0.5、1.0、1.5、2.0 h时从溶液中取出1 mL样品,同时再向溶液中补加1 mL新鲜的胃液。2 h后调节pH值至中性,并加入10 mL模拟肠液(pH 6.8),分别在2.5、3.0、3.5、4.0、5.0 h时从溶液中取出1 mL样品,同时再向溶液中补加1 mL新鲜的肠液。从模拟胃液和肠液中取出的1 mL样品中加入4 mL正己烷以萃取VA,在325 nm波长处测定萃取液的吸光度。
在PBS中的释放:称取80 mg样品,置于50 mL锥形瓶中,加入20 mL pH 7.4 PBS,37 ℃、100 r/min振荡,分别在0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、5.0 h时从溶液中取出1 mL样品,同时再向溶液中补加1 mL新鲜PBS,取出的1 mL样品中加入4 mL正己烷萃取VA,在325 nm波长处测定吸光度。
1.4 数据处理
实验所得数据采用Origin 7.5进行绘图。
2 结果与分析
2.1 壳聚糖衍生物的结构表征
2.1.1 FT-IR光谱
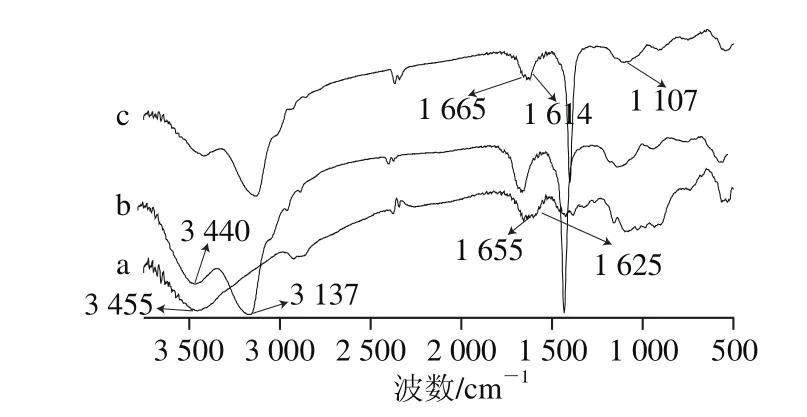
图2 壳聚糖(a)、羟乙基壳聚糖(b)和胆酸化壳聚糖(c)的FT-IR光谱Fig.2 FT-IR spectra of chitosan (a), hydroxyethyl chitosan (b), and CA-modi fi ed chitosan (c)
采用红外光谱对壳聚糖及其衍生物的化学结构进行分析,结果如图2所示。图2a为壳聚糖的红外光谱,可以看到光谱中有明显的壳聚糖特征谱带,3 456 cm-1为O—H伸缩振动峰,3 137 cm-1为N—H伸缩振动峰,2 928 cm-1为—CH2—CH2—伸缩振动峰,1 655 cm-1和1 625 cm-1处,分别对应于酰胺Ⅰ带C=O的伸缩振动峰和酰胺Ⅱ带(—NH2)的弯曲振动峰。出现在1 107 cm-1的吸收带是C—O—C桥键的非对称性伸展,1 075、1 033 cm-1的是涉及C—O伸展的骨架振动,这些都是含糖结构的特性。由图2b可见,壳聚糖经过羟乙基化后,与壳聚糖相比,在3 440 cm-1处的O—H伸缩振动峰峰值强度增加,这就意味着一部分羟乙基被引进到壳聚糖的6—OH上。由图2c可见,当胆酸化学键合到羟乙基壳聚糖分子上后,胆酸化壳聚糖的红外光谱中1 625 cm-1处—NH2的弯曲振动减小,而在1 614 cm-1出现显著的酰胺Ⅱ带特征吸收峰,这是由于胆酸的—COOH与壳聚糖的—NH2发生酰胺反应,胆酸通过酰胺基化学键合到羟乙基壳聚糖分子上。
2.1.21H NMR分析

图3 羟乙基壳聚糖(a)和两亲性胆酸化壳聚糖(b)的1H NMR图谱Fig.3 1H NMR spectra of (a) hydroxyethyl chitosan and (b)amphiphilic chitosan
采用1H NMR对壳聚糖衍生物的化学结构进行分析,结果如图3所示。图3a中在3.56×10-6和3.68×10-6出现的2 个特征峰分别是羟乙基壳聚糖的羟乙基上两种H原子的化学位移。壳聚糖的特征峰4.79×10-6(糖环H-1)、2.96×10-6(糖环H-2)、3.36×10-6~3.93×10-6(糖环H-3、H-4、H-5、H-6)、2.01×10-6(—COCH3)。而(0.6×10-6~2.1×10-6)的多重峰为胆酸的核磁共振峰,表明在化合物中有胆酸基团存在(图3b)。

表1 胆酸化壳聚糖上的胆酸取代度Table1 Degree of substitution of CA in CA-modified chitosan
实验通过改变反应体系中胆酸的质量浓度,发现胆酸化壳聚糖中的胆酸取代度随胆酸质量浓度的提高而增加,胆酸取代度最高可以达到8.92(表1)。
2.2 两亲性胆酸化壳聚糖纳米微胶囊的自组装
芘作为探针常被用来研究两亲性物质在水溶液中的胶束化行为。本实验采用芘荧光探针法测定两亲性胆酸化壳聚糖在水溶液中自组装行为。芘是一种典型的疏水化合物,由于溶解度的原因,加之自身猝灭作用,在极性环境中的荧光极弱,而在非极性环境中的荧光很强。因此,当极性溶剂(如水)中有胶束或疏水结构域生成时,芘分子自发由极性环境向非极性环境中转移,造成荧光强度的显著增加[38]。荧光光谱中第一发射峰与第三发射峰强度比值(I372nm/I383nm)随芘分子所处环境的极性增大而增大。在聚合物质量浓度低于CAC时,芘分散在极性强的水中;当胶束形成时,疏水的芘则聚集于胶束内核中,其所处环境由极性变为非极性,此时I372nm/I383nm会发生突变,因此胶束的表观CAC可由I372nm/I383nm对质量浓度作图得到,斜率的突变点即为自聚集的CAC[39]。

图4 两亲性胆酸化壳聚糖在PBS中的荧光探针光谱Fig.4 Fluorescence spectra of amphiphilic chitosan at different concentrations in PBS
芘在两亲性胆酸化壳聚糖的pH 7.4 PBS中的荧光发射光谱如图4所示,可看出随着两亲性胆酸化壳聚糖质量浓度的增大,芘的荧光发射强度呈明显增加的趋势,其中I372nm比I383nm的强度增加更为显著,这充分说明两亲性胆酸化壳聚糖在水溶液中自组装形成微胶囊,荧光探针芘从水中向微胶囊内的疏水微区转移,导致发射光谱发生相应的改变。

图5 两亲性胆酸化壳聚糖质量浓度对磷酸缓冲液中芘荧光发射光谱中I372nm/I383nm比值的影响Fig.5 Plot of intensity ratio (I372nm/I383nm) from pyrene emission spectra as a function of the concentration of amphiphilic CA-modif i ed chitosan in PBS
图5 显示了两亲性胆酸化壳聚糖在溶液中的质量浓度对芘的荧光发射光谱中I372nm/I383nm的影响。图中显示,当溶液中胆酸化壳聚糖质量浓度小于0.2 mg/mL时,I372nm/I383nm的值接近1.5,基本不随壳聚糖质量浓度的变化而变化,说明芘所处的环境极性几乎不变,此时两亲性胆酸化壳聚糖以单分子链的形式溶解并分散在水中,并没有形成胶束,芘也分散在水中。当胆酸化壳聚糖质量浓度高于0.2 mg/mL时,I372nm/I383nm的值随着质量浓度的增加而直线下降,说明两亲性胆酸化壳聚糖在溶液中自组装形成微胶囊,导致荧光探针分子芘逐渐从水中向微胶囊内的疏水微区转移,导致荧光发射光谱发生明显变化。I372nm/I383nm比值变化的转折点,亦即是图中两条直线的交点所对应的质量浓度即为两亲性胆酸化壳聚糖的临界胶束质量浓度,该质量浓度为0.36 mg/mL。
2.3 两亲性胆酸化壳聚糖微胶囊包埋VA

图6 3 种方法制备对包埋VA的两亲性胆酸化壳聚糖微胶囊粒径的影响Fig.6 Effect of loading methods on the size of amphiphilic CA-modif i ed chitosan microcapsules loading vitamin A
本实验采用3 种方法制备两亲性胆酸化壳聚糖微胶囊并包埋VA,其微胶囊的粒径采用动态光散射仪测定,结果如图6所示。空的未包埋VA的微胶囊平均粒径为68 nm。分别采用搅拌法、超声法和溶剂法包埋VA。实验表明,包埋VA后,微胶囊的粒径明显增大。搅拌法制备的壳聚糖微胶囊平均粒径为140 nm,超声法制备的壳聚糖微胶囊平均粒径241 nm,溶剂法制备的壳聚糖微胶囊平均粒径为148 nm。其中,超声法包埋VA的效率最高。
2.4 两亲性胆酸化壳聚糖微胶囊的形态

图7 包埋VA的两亲性胆酸化壳聚糖微胶囊扫描电子显微镜图Fig.7 Scanning electron micrograph of amphiphilic CA-modif i ed chitosan microcapsules loading vitamin A
此外,采用扫描电子显微镜直接对制备的两亲性胆酸化壳聚糖微胶囊进行观察,结果如图7所示。两亲性胆酸化壳聚糖微胶囊呈球形或类球形,大小较均一,平均粒径约200 nm。
2.5 两亲性胆酸化壳聚糖微胶囊的释放行为
从图8中可以看到,在pH 1.2的模拟胃液中,VA从两亲性胆酸化壳聚糖微胶囊中缓慢释放,在胃液中停留2 h,总的释放率为26%;在胃液中2 h后,溶液转换成模拟肠液,VA从两亲性胆酸化壳聚糖微胶囊中释放出来的速率加快,在肠液中停留3 h后,VA的累积释放率从26%增加到86%。这一结果表明,两亲性胆酸化壳聚糖微胶囊包埋的VA更倾向于在肠液中释放。VA在胃液中缓慢、部分释放主要归因于水溶性壳聚糖在酸性条件下的溶解度增大,克服了壳聚糖分子链上胆酸基团间疏水作用的束缚,导致微胶囊的部分溶胀或破坏,使得少量包埋的VA从微胶囊中释放出来。在胃肠液中的释放行为表明,两亲性胆酸化壳聚糖微胶囊可用于包埋VA,利于VA在肠道的集中释放和吸收。

图8 包埋VA的两亲性胆酸化壳聚糖微胶囊在模拟胃液和模拟肠液中的释放行为Fig.8 Releasing behavior of amphiphilic CA-modif i ed chitosan microcapsules loading vitamin A in simulated gastric fl uid and intestinal fl uid

图9 包埋VA的两亲性胆酸化壳聚糖微胶囊在PBS(pH 7.4)中的释放行为Fig.9 Releasing behavior of amphiphilic CA-modif i ed chitosan microcapsules loading vitamin A in PBS (pH 7.4)
此外,实验还考察了包埋VA的两亲性胆酸化壳聚糖微胶囊在PBS(pH 7.4)中的释放行为,其结果如图9所示。包埋VA的壳聚糖微胶囊在PBS中的释放行为为缓释放行为。在PBS中静置的5 h内,微胶囊释放的VA从0.5 h时的24%近乎线性增加到5 h时的85%。这一缓释行为说明两亲性胆酸化壳聚糖微胶囊可用于VA的包埋及缓释放。
3 结 论
以异丙醇为溶剂,将碱化的壳聚糖与2-氯乙醇反应制备水溶性羟乙基壳聚糖;再以EDC为催化剂,通过胆酸上的羧基与羟乙基壳聚糖分子上的氨基反应,将胆酸化学键合到羟乙基壳聚糖主链上,得到两亲性的胆酸化壳聚糖。两亲性的胆酸化壳聚糖在水溶液中通过自组装形成纳米微胶囊。分别采用搅拌法、超声法和溶剂法制备包埋VA的壳聚糖微胶囊。其中,超声法的包埋效率最佳。以两亲性壳聚糖为壁材包埋VA,方法简便易行,包埋速度快。包埋VA的壳聚糖微胶囊主要在肠液中释放VA,利于VA在肠道的集中释放和吸收;而包埋VA的壳聚糖微胶囊在PBS(pH 7.4)中为缓释放行为,说明该微胶囊可用于食品、医药领域。
[1] BLOMHOFF R, BLOMHOFF H K. Overview of retinoid metabolism and function[J]. Journal of Neurobiology, 2006, 66: 606-630.DOI:10.1002/NEU.20242.
[2] BLUMENTRATH J, NEYE H, VERSPOHL E J. Effects of retinoids and thiazolidinediones on proliferation, insulin release, insulin mRNA, GLUT 2 transporer protein and mRNA of INS-1 cells[J]. Cell Biochemistry and Function, 2001, 19: 159-169. DOI:10.1002/cbf.907.
[3] MORA J R, IWATA M, VONANDRIAN U H. Vitamin effects on the immune system: vitamins A and D take center stage[J]. Nature Reviews Immunology, 2008, 8: 685-698. DOI:10.1038/nri2378.
[4] 韩军花, 李晓瑜, 李艳平. 我国食物维生素A强化水平的风险评估[J].中华预防医学杂志, 2012, 46(4): 294-298. DOI:10.3760/cma.j.issn0253-9624.2012.04.002.
[5] 彭容, 魏小平, 梁小华, 等. 重庆市巴南区学龄前儿童膳食维生素A摄入量与血浆维生素A的关系[J]. 北京大学学报(医学版), 2014,46(3): 366-372. DOI:10.3969/j.issn.1671-167X.2014.03.006.
[6] 王华. 维生素A微胶囊制备与性能的研究[D]. 合肥: 合肥工业大学,2007: 6-9.
[7] 孙兰萍, 许晖, 张斌, 等. 食品成分微胶囊制备技术及发展趋势展望[J]. 农产品加工(学刊), 2008(5): 12-17. DOI:10.3969/j.issn.1671-9646-B.2008.05.003.
[8] QUINTANILLA-CARVAJAL M X, CAMACHO-DIAZ B H,MERAZ-TORRES L S, et al. Nanoencapsulation: a new trend in food engineering processing[J]. Food Engineering Reviews, 2010, 2(1): 39-50. DOI:10.1007/s12393-009-9012-6.
[9] 范青生, 肖小年, 胡伟. 保健食品研制与开发技术[M]. 北京: 化学化工出版社, 2005: 304-307.
[10] 黄晶, 申莉莉, 白友菊, 等. 层层自组装法制备百里香精油微胶囊条件优化[J]. 食品科学, 2016, 37(2): 51-57. DOI:10.7506/spkx1002-6630-201602009.
[11] 韩爱芝, 蒋卉, 贾清华, 等. 响应面试验优化黑果枸杞花色苷微胶囊制备工艺及其稳定性分析[J]. 食品科学, 2016, 37(10): 82-87.DOI:10.7506/spkx1002-6630-201610014.
[12] 徐晶, 刘欢, 夏光辉, 等. β-环糊精包埋柠檬醛微胶囊工艺优化及其缓释性能[J]. 食品科学, 2014, 35(14): 82-86. DOI:10.7506/spkx1002-6630-201602009.
[13] LIAO K C, LU F S, LIU C P, et al. Preparation and research of butylene fi pronil microencapsulation by layer-by-layer polyelectrolyte self-assembly[J]. Journal of Macromolecular Science, 2015, 52(5):374-380. DOI:10.1080/10601325.2015.1018808.
[14] 王璐怡, 李云飞, 刘临洁, 等. 牛初乳免疫球蛋白IgG微胶囊的制备及其释放性能[J]. 食品科学, 2013, 34(11): 152-156. DOI:10.7506/spkx1002-6630-201311034.
[15] 马嫄, 段显萍, 刘芸, 等. 双层包埋制备嗜酸乳杆菌微胶囊及其应用[J].食品科学, 2013, 34(4): 99-103.
[16] 董英, 徐自明, 徐斌. 壳聚糖制备技术的研究进展[J]. 食品研究与开发, 2005, 26(5): 23-26. DOI:10.3969/j.issn.1005-6521.2005.05.007.
[17] MUZZARELLI R A A. Chitins and chitosans for the repair of wounded skin, nerve, cartilage and bone[J]. Carbohydrate Polymers,2009, 76(2): 167-182. DOI:10.1016/j.carbpol.2008.11.002.
[18] MUZZARELLI R A A. Chitins and chitosans as immunoadjuvants and non-allergenic drug carriers[J]. Marine Drugs, 2010, 8(2): 292-312.
[19] MUZZARELLI R A A, BOUDRANT J, MEYER D, et al. Current views on fungal chitin/chitosan, human chitinases, food preservation,glucans, pectins and inulin: a tribute to Henri Braconnot, precursor of the carbohydrate polymers science, on the chitin bicentennial[J].Carbohydrate Polymers, 2012, 87(2): 995-1012. DOI:10.1016/j.carbpol.2011.09.063.
[20] YANG Y, WANG S P, WANG Y T, et al. Advances in self-assembled chitosan nanomaterials for drug delivery[J]. Biotechnology Advances,2014, 32(7): 1301-1316. DOI:10.1016/j.biotechadv.2014.07.007.
[21] 赵依妮, 李怡, 胡鲲, 等. 诺氟沙星壳聚糖微胶囊缓释作用研究[J].水生生物学报, 2014, 38(4): 675-680. DOI:10.7541/2014.96.
[22] CHAUDHURY A, DAS S. Recent advancement of chitosanbased nanoparticles for oral controlled delivery of insulin and other therapeutic agents[J]. AAPS Pharm SciTech, 2011, 12(1): 10-20.DOI:10.1208/s12249-010-9561-2.
[23] MUKHOPADHYAY P, SARKAR K, CHAKRABORTY M, et al.Oral insulin delivery by self-assembled chitosan nanoparticles: in vitro and in vivo studies in diabetic animal model[J]. Materials Science and Engineering C, 2013, 33: 376-382. DOI:10.1016/j.msec.2012.09.001.
[24] 冯淑莹, 李国明, 侯琼, 等. 金雀异黄素/壳聚糖微球的制备及其释药性能[J]. 华南师范大学学报(自然科学版), 2013, 45(5): 64-67.DOI:10.6054/j.jscnun.2013.07.015.
[25] DING Y G, SHEN S Z, SUN H D, et al. Design and construction of polymerized-chitosan coated Fe3O4magnetic nanoparticles and its application for hydrophobic drug delivery[J]. Materials Science and Engineering C, 2015, 48: 487-498. DOI:10.1016/j.msec.2014.12.036.
[26] MUZZARELLI R A A, EUGENI C E, TANFANI F. Atomic absorption determination of chromlntun, manganese, iron, copper and zine in human,cow, sand powered milks[J]. Carbohydrate Polymer, 1983, 38(8): 453-457.
[27] GE W J, CHEN D L, WANG M W, et al. Characterization and antioxidant activity of β-carotene loaded chitosan-graft-poly(lactide)nanomicelles[J]. Carbohydrate Polymers, 2015, 117: 169-176.DOI:10.1016/j.carbpol.2014.09.056.
[28] 黄秋燕, 张宏亮, 王捷, 等. 壳聚糖苦丁茶纳米粒的制备及理化性质考察[J]. 中国实验方剂学杂志, 2015, 21(6): 10-13. DOI:10.13422/j.enki.syfjx.2015060010.
[29] 邓靖, 谭兴和, 刘婷婷, 等. 肉桂精油-β-环糊精微胶囊的制备[J]. 中国粮油学报, 2011, 26(2): 89-91; 97.
[30] 钱俊青, 吴宏君. 植物油与水的两相溶剂体系中壳聚糖微粒的制备及抑菌性能研究[J]. 高校化学工程学报, 2014, 28(5): 1059-1064.DOI:10.3969/J.ISSN.1003-9015.2014.05.019.
[31] 潘高峰, 刘文波. 含壳聚糖-VE微胶囊化妆品中VE的稳定性[J]. 化学与黏合, 2015, 37(6): 415-418.
[32] 谢海伟, 方远见, 吴礼珠, 等. 鲎素肽微胶囊的制备工艺及性能研究[J]. 食品工业科技, 2016, 37(9): 112-116; 122. DOI:10.13386/jissn1002-0306.2016.09.014.
[33] PARK J H, KWON S, NAM J O, et al. Self-assembled nanoparticles based on glycol chitosan bearing 5β-cholanic acid for RGD peptide delivery[J]. Journal of Controlled Release, 2004, 95: 579-588.DOI:10.1016/j.jconrel.2003.12.020.
[34] DU H L, YANG X Y, PANG X, et al. The synthesis, self-assembling,and biocompatibility of a novel O-carboxymethyl chitosan cholate decorated with glycyrrhetinic acid[J]. Carbohydrate Polymers, 2014,111: 753-761. DOI:10.1016/j.carbpol.2014.04.095.
[35] PAN Z, GAO Y L, HENG L S, et al. Amphiphilic N-(2,3-dihydroxyproxypropyl)-chitosan-cholic acid micelles for paclitazel delivery[J]. Carbohydrate Polymers, 2013, 94: 394-399. DOI:10.1016/j.carbpol.2013.01.013.
[36] XIONG Y B, QI J N, YAO P. Amphiphilic cholic-acid-modified dextran sulfate and its application for the controlled delivery of superoxide dismutase[J]. Macromolecular Bioscience, 2012, 12(4):515-524. DOI:10.1002/mabi.201100367.
[37] LEE K Y, JO W H, KWON I C, et al. Physicochemical characteristics of self-aggregates of hydrophobically modif i ed chitosans[J]. Langmuir,1998, 14: 2329-2332.
[38] ANANTHAPADMANABHAN K P, GODDARD E D, TURRO N J, et al. Fluorescence probes for critical micelle concentration[J].Langmuir, 1985, 1(3): 352-355. DOI:10.1021/la00063a015.
[39] 过嫣丹. 麸质阿拉伯木聚糖的改性及应用[D]. 无锡: 江南大学,2012: 25-46.
