免疫原性HER2突变体蛋白对小鼠T细胞亚群分化的影响
2018-03-20宁宏宇姚文兵
宁宏宇,江 涛,张 瑞,何 羽,姚文兵,田 浤*
(中国药科大学 1江苏省生物药物成药性研究重点实验室;2生命科学与技术学院,南京 210009)
免疫原性氨基酸是指能提高蛋白质免疫原性的一类氨基酸,如硝基酪氨酸、对硝基苯丙氨酸等。在自体蛋白中引入免疫原性氨基酸能诱使机体突破免疫耐受,产生针对自体蛋白的特异性抗体[1]。Hardy等[2]用化学合成的方法将抗原表位肽中的酪氨酸置换成硝基酪氨酸,证实了仅在一个位点引入免疫原性氨基酸即可明显影响MHC I类限制性抗原表位的识别。另有文献报道,将对硝基苯丙氨酸定点引入至小鼠的肿瘤坏死因子(TNF-α)中,免疫小鼠后产生了能够与原TNF-α发生交叉反应的中和抗体。利用此方法,对小鼠进行LPS过度刺激,突变蛋白免疫后的小鼠能够存活,证明抗体的存在能够有效地控制小鼠体内TNF-α的含量[1,3-4]。
尽管免疫原性氨基酸突破自身免疫耐受的作用已被研究证实,但其诱导机体产生抗体的作用机制尚不完全清楚。前期研究已证实,免疫原性氨基酸并非通过形成新的B细胞表位诱导抗体产生,其诱导机体产生的抗体能与未引入非天然氨基酸的原型蛋白产生广泛的交叉反应[5-7]。因此推测,免疫原性氨基酸可能是通过影响T细胞而诱导机体产生自身抗体。
本课题组前期以人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)为模型分子,制备了一系列含对硝基苯丙氨酸的HER2突变体[8-10]。本研究利用含对硝基苯丙氨酸的HER2突变体免疫小鼠后,对小鼠CD4+T细胞的不同亚群比例及Bcl-6、FOXP3等主要转录因子进行了分析,以探讨对硝基苯丙氨酸在蛋白质中的定点引入对T细胞亚群分化的影响。
1 材 料
1.1 试 剂
异丙基硫代半乳糖苷(IPTG),HRP偶联山羊抗鼠IgG(南京鼎国公司);邻苯二胺(OPD),小鼠脾脏淋巴细胞、分离液(天津市灏洋公司);RPMI1640培养基,胎牛血清(美国Gibco公司);铝佐剂、PMA和离子霉素(美国Sigma公司);BFA,Staining buffer,流式固定破膜液以及流式抗体等(美国BD公司);RNA提取试剂盒、cDNA第一条链合成试剂盒、qPCR试剂盒(北京全式金公司);引物合成(南京金斯瑞公司);小鼠IL-21 ELISA试剂盒(美国eBioscience公司);其他试剂均为市售分析纯。
1.2 仪 器
ELISA酶标条,细胞培养板(美国Corning公司);全波长酶标仪(美国Thermo公司);FACS Calibur 流式细胞仪(美国BD公司);LightCycler96实时荧光定量PCR仪(瑞士罗氏公司)。
1.3 动 物
BALB/c小鼠,6~8周龄,购自扬州大学比较医学中心,合格证号:No.201713517。所有动物实验均符合动物伦理委员会标准。
2 方 法
2.1 HER2突变体的表达与纯化
实验室前期分别将编码HER2蛋白的5号,26号和79号位氨基酸的密码子突变为琥珀密码子TAG,并将3种突变体基因引入质粒pET28a,命名为pET28a-5TAG-HER2质粒,pET28a-26TAG-HER2质粒,pET28a-79TAG-HER2质粒,将3种质粒分别转化至感受态细胞,构建为3种重组菌,将3种重组菌分别培养8 h后,加入IPTG(终浓度1 mmol/L)进行诱导,同时加入对硝基苯丙氨酸(终浓度100 mmol/L),37 ℃,220 r/min继续培养18 h,离心收取菌体沉淀。将菌体按10 mL/g的比例加入0.10 mol/L NaCl缓冲液中重悬,超声破碎,离心收集包涵体沉淀。每克包涵体沉淀加入含20 mmol/L咪唑的包涵体变性液10 mL,重悬并在4 ℃变性过夜,完全溶解后将变性液过Ni亲和色谱柱,用浓度梯度为20~500 mmol/L的咪唑缓冲液梯度洗脱,检测合并含目的蛋白的洗脱液,按体积比1∶4的比例加入复性缓冲液,用PBS(pH 8.0)缓冲液透析,超滤浓缩,加入等体积甘油混合均匀,分别命名为5-HER2,26-HER2和79-HER2,保存于-20 ℃备用。
2.2 HER2突变体免疫原性分析
将6~8周龄C57BL/6雌性小鼠随机分为8组,每组6只,分别为PBS组、佐剂组、WT-HER2(原型HER2)组、WT-HER2加佐剂组、5-HER2组、26-HER2组、79-HER2组、79-HER2加佐剂组。分别于实验的第1天和第8天。PBS组注射PBS溶液150 μL,WT-HER2、5-HER2、26-HER2、79-HER2组分别注射WT-HER2、5-HER2、26-HER2和79-HER2;WT-HER2加佐剂组和79-HER2加佐剂组分别注射WT-HER2和79-HER2与铝佐剂按体积比1∶1混合的混合溶液,蛋白剂量均为1 μg/g。免疫后每周取血,分离血清,共取5周。利用间接ELISA法检测小鼠血清中抗HER2抗体含量,用WT-HER2蛋白包被酶标条,加入各组小鼠血清孵育2 h,PBST清洗后加入HRP偶联羊抗鼠IgG孵育1 h,清洗后加入反应底物,反应30 min 后加入终止液,用酶标仪在492 nm处测定吸收度。
2.3 免疫后小鼠淋巴结Th细胞亚群分析
2.3.1 小鼠淋巴结淋巴细胞的分离 取免疫后小鼠的淋巴结,分别研磨过70 μm筛网,用PBS冲洗收集至15 mL离心管中,离心收集细胞,用PBS 1 mL重悬,在新的15 mL离心管中加入小鼠脾脏淋巴细胞分离液3 mL,倾斜离心管,沿离心管壁缓慢加入细胞悬液,保持液面清晰,2 000 r/min室温离心20 min,用巴斯德吸管吸取乳白色云雾状的淋巴细胞层至一个新的15 mL离心管中,加入10倍体积的PBS洗涤细胞2次,用PBS 1 mL重悬淋巴细胞,计数。
2.3.2 Th细胞亚群检测 Th1细胞用CD4/IFN-γ标记,Th2细胞用CD4/IL-4标记,Tfh细胞用CD4/CXCR5/ICOS标记,Treg细胞用CD4/FOXP3标记。
用于标记Th1/Th2的细胞预先用RPMI1640培养基(10%FBS)重悬,铺于6孔板中,加入20 ng/mL PMA,1 μg/mL离子霉素以及1 μL/mL GolgiStop(均用终浓度表示)孵育6 h,收集离心,计数。
染色方法如下:取1×106个淋巴细胞至2 mL EP管中,2 000 r/min离心弃上清液,加入anti-CD4(Th1/Th2/Treg)或anti-CD4/anti-CXCR5/anti-ICOS(Tfh)染色工作液20 μL,4 ℃避光孵育30 min,用PBS清洗2次,Th1/Th2/Treg细胞另加入Cytofix/Cytoperm缓冲液250 μL重悬细胞沉淀,4 ℃避光孵育20 min,Perm/Wash缓冲液洗涤细胞2次,加入anti-IFN-γ(Th1)/anti-IL-4(Th2)/anti-FOXP3(Treg)染色工作液20 μL,4 ℃暗处孵育30 min,Perm/Wash缓冲液清洗2次。上流式细胞仪检测。
2.4 小鼠淋巴结转录因子mRNA水平分析
用实时荧光定量PCR法检测小鼠淋巴结中Bcl-6和FOXP3的表达。按照试剂盒说明,提取淋巴结总RNA,以随机引物合成cDNA的第一条链,-20 ℃保存备用。以cDNA为模板,以SYB GREEN标记荧光定量,检测β-actin,Bcl-6及FOXP3基因表达情况。PCR引物序列如下:β-actin上游引物5′-GAGACCTTCAACACCCCAGC-3′,β-actin下游引物5′-ATGTCACGCACGATTTCCC-3′;Bcl-6上游引物5′-CACACCCGTCCATCATTGAA-3′,Bcl-6下游引物5′-TGTCCTCACGGTGCCTTTTT-3′;FOXP3上游引物5′-CTATGCCACCCTTATCCGA-3′,FOXP3下游引物5′-TCCTCTTCTTGCGAAACTCA-3′。
反应程序为:95 ℃预变性20 s,95 ℃变性3 s,60 ℃退火延伸30 s(荧光检测),40个循环。PCR反应及数据采集于LightCycler96系统上进行,记录其循环阈值(Ct)。采用ΔΔCt法,以β-actin为内参,相对定量各实验组样品内目的基因的表达水平。
2.5 免疫后小鼠血清中IL-21含量分析
根据试剂盒说明书,采用双抗夹心ELISA法检测各组小鼠血清中IL-21的含量。
2.6 统计学分析

3 结 果
3.1 含对硝基苯丙氨酸的HER2蛋白的表达与纯化
以79-HER2工程菌为例,工程菌培养8 h后,加入IPTG与对硝基苯丙氨酸进行诱导表达,采样进行全菌电泳,如实验结果(图1-A)所示,诱导后在14 kD附近出现了目的条带,与理论相对分子质量相符。经超声破碎、变性、Ni柱纯化、透析、超滤等步骤,获得了电泳纯的目的蛋白(图1-B)。
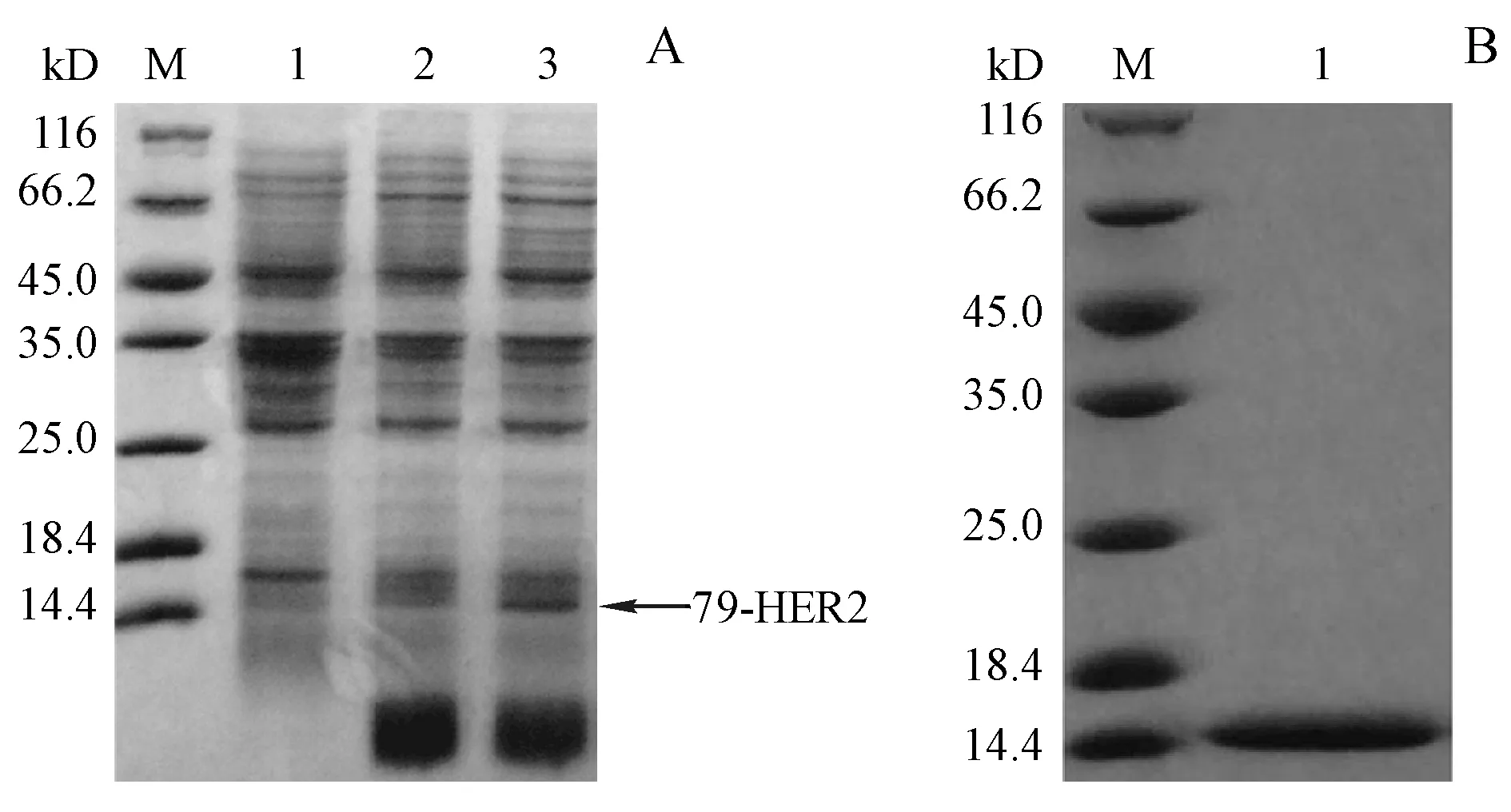
Figure1 SDS-PAGE analysis of protein expression of the bacteria containing pET28a-79TAG-HER2 plasmid
(A) M:Protein marker;1:Total cell proteins of the reorganized strains before induction with pNO2Phe;2:Total cell proteins of the reorganized strains after induction without pNO2Phe;3:Total cell proteins of the reorganized strains after induction with pNO2Phe.
(B) M:Protein marker;1:Purified 79-pNO2Phe-HER2
3.2 含对硝基苯丙氨酸的HER2突变体的免疫原性分析
对小鼠采取眼眶取血,离心后收集上层血清,用间接ELISA法检测小鼠血清中抗WT-HER2抗体的效价,免疫后持续检测5周(图2)。免疫后,3种突变体HER2免疫的小鼠血清中抗HER2抗体滴度均随着时间而增加,而WT-HER2,PBS和佐剂免疫的小鼠血清中则没有检测到抗HER2抗体的分泌。在第5周时,WT-HER2免疫的小鼠血清中抗体效价仍维持在较低水平,与PBS组不存在显著性差异(P>0.05)。而5-HER2,26-HER2和79-HER2均能不同程度刺激小鼠产生抗HER2抗体,均与PBS组有极显著差异(P<0.001)。
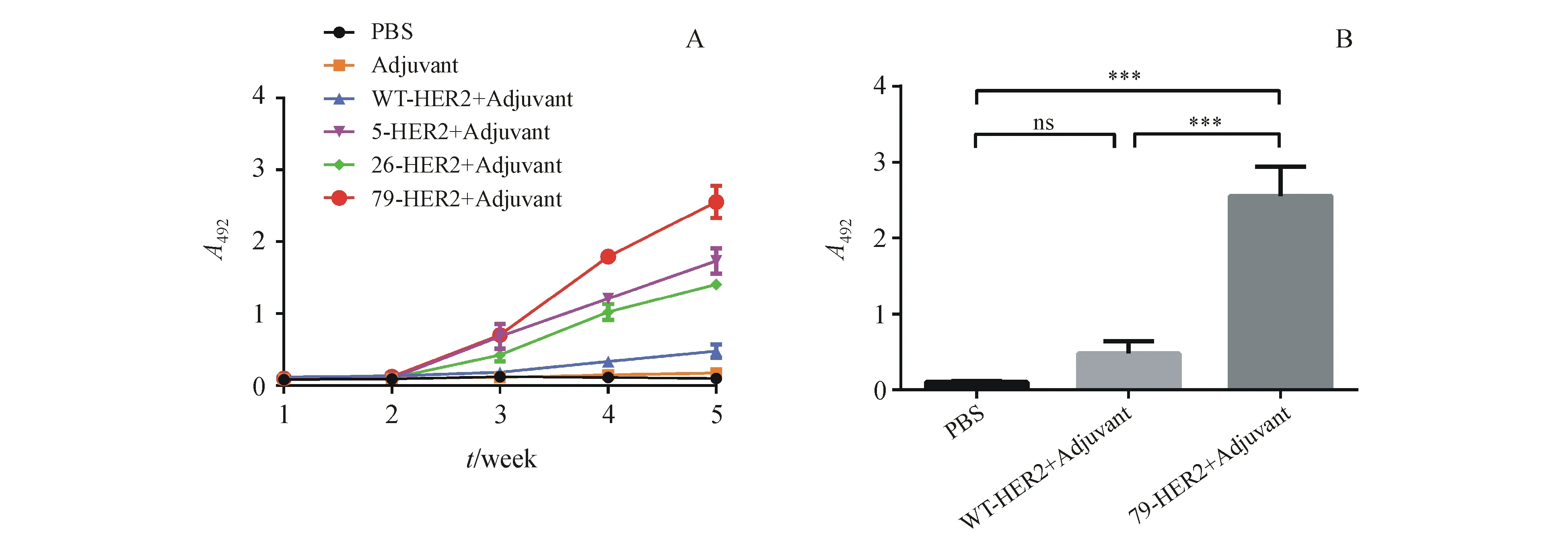

A:Serum titer of anti-WT-HER2 antibody from week 1-5;B:Serum titer of anti-WT-HER2 antibody of mice vaccinated with PBS,WT-HER2 and 79-HER2 on week 5
***P<0.001;ns:P>0.05
3.3 免疫后小鼠Th细胞亚群比例的分析
从小鼠淋巴结中采用密度梯度离心法分离淋巴细胞,流式染色后检测Th细胞亚群的比例。实验结果(图3)表明,WT-HER2和79-HER2免疫小鼠后,均不能使小鼠淋巴结中Th1和Th2的比例发生变化(P>0.05),而79-HER2免疫后,能使小鼠淋巴结中的Tfh细胞比例(8.74±1.99)%明显上升,与PBS组(4.60±0.772)%和原型组(3.79±0.68)%均存在极显著差异(P<0.001)。79-HER2免疫后,能使小鼠淋巴结中Treg细胞比例(1.11±0.67)%下降,与PBS组(4.89±1.33)%存在显著性差异(P<0.05),而WT-HER2免疫小鼠后,淋巴结Treg细胞的比例(2.88±0.86)%与PBS组不存在显著性差异(P>0.05)。
3.4 免疫后小鼠T细胞中Bcl-6和FOXP3转录水平的变化
提取各实验组总RNA后,用随机引物逆转录为cDNA后以此为模板,采用实时荧光定量PCR法,进一步考察了小鼠淋巴结中Tfh细胞和Treg细胞的关键转录因子Bcl-6和FOXP3的基因表达水平变化。研究表明(图4),79-HER2免疫小鼠后,小鼠淋巴结Bcl-6 mRNA水平相对PBS组和WT-HER2组均有显著升高(P<0.001),而WT-HER2免疫小鼠后Bcl-6 mRNA水平相对PBS组则没有显著改变(P>0.05)。且79-HER2免疫后,能使小鼠淋巴结中FOXP3 mRNA表达相对PBS组(P<0.01)和WT-HER2组(P<0.05)均有显著下降,而WT-HER2免疫小鼠则不能使FOXP3表达相对PBS组发生变化(P>0.05),实验结果与流式结果基本一致。
3.5 免疫后小鼠血清中IL-21含量的变化
Tfh细胞是生发中心形成和B细胞成熟过程中的关键辅助性T细胞,而IL-21是Tfh细胞的主要效应细胞因子。免疫5周后,检测各组小鼠血清中的IL-21含量,结果如图5所示,与PBS组[(2.76±1.84) pg/mL]和WT-HER2组[(4.58±2.33) pg/mL]相比,79-HER2免疫小鼠后,小鼠血清中的IL-21 含量[(28.49±14.54) pg/mL]有显著升高(P<0.05)。
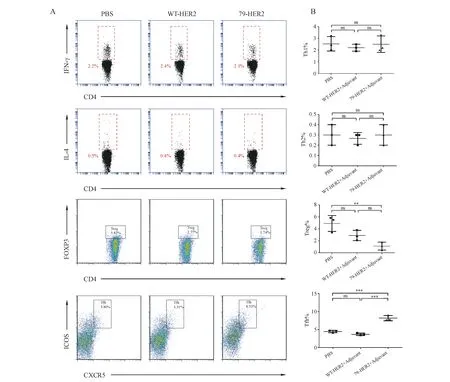
Figure3 79-HER2 induce the differentiation of T lymphocyte

**P<0.01;***P<0.001;ns:P>0.05

Figure4 mRNA abundance of Bcl-6 and FOXP3

**P<0.01;***P<0.001;*P<0.05; ns:P>0.05
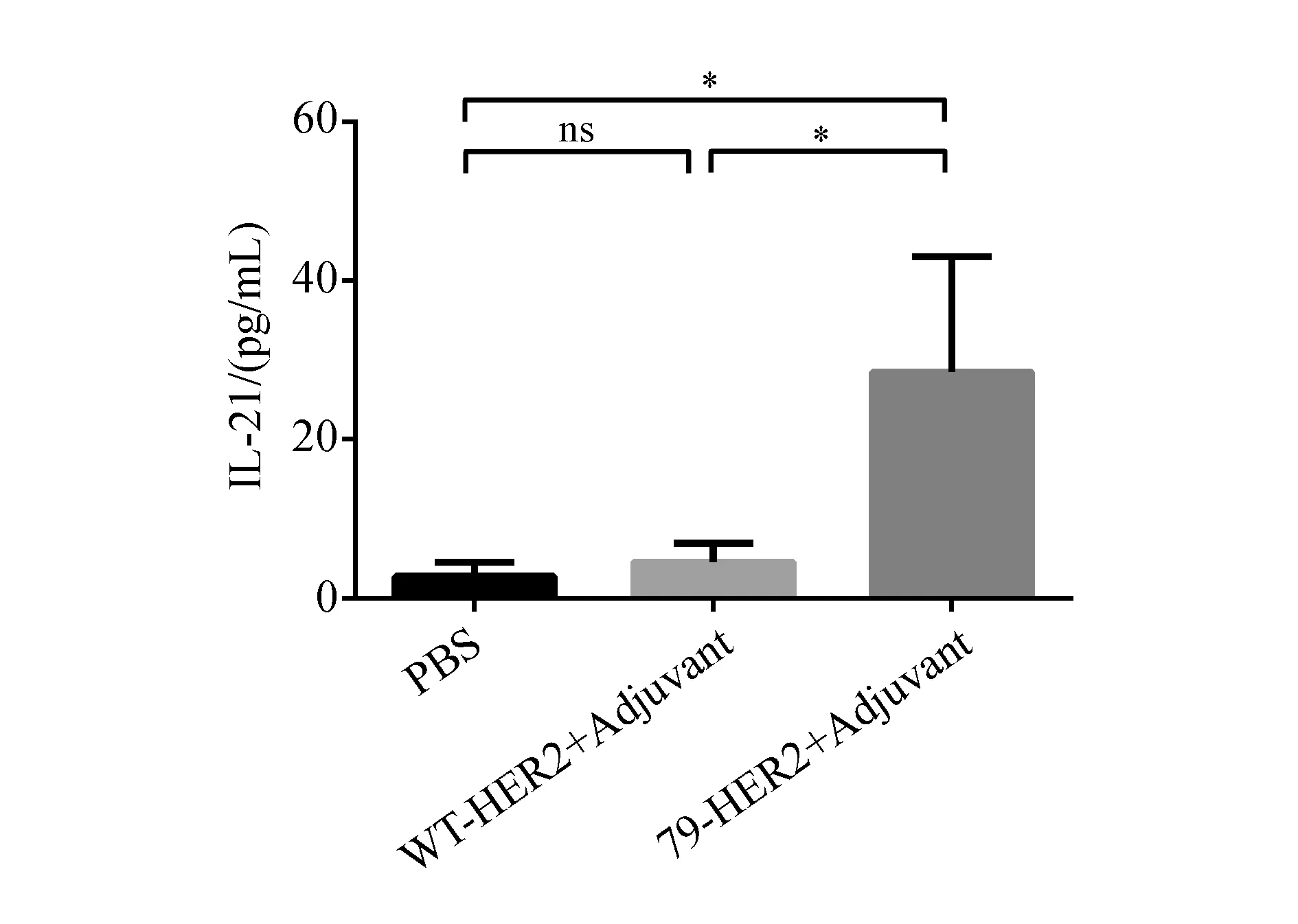
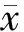
*P<0.05;ns:P>0.05
4 讨 论
免疫原性氨基酸的引入能显著提高蛋白质的免疫原性,使机体产生特异性抗体,但其诱导特异性抗体的机制及其对机体T细胞亚群分化的影响尚不明确。本研究表达了定点引入对硝基苯丙氨酸的HER2突变体。用含对硝基苯丙氨酸的HER2突变体免疫小鼠,分析其对小鼠T细胞亚群分化的影响。结果表明突变体HER2免疫能提高小鼠淋巴结中Tfh细胞的比例,同时使Treg细胞的比例下降,而对Th1和Th2细胞比例无明显影响。
Tfh细胞是生发中心的形成与其发挥功能的过程中的关键辅助细胞,以高表达CXC趋化因子受体5(CXCR5)为特征,CXCR5能引导Tfh细胞向滤泡中高表达CXCL13的B细胞区迁移[11-12],Tfh同时共表达ICOS,PD-1,细胞因子IL-21和Bcl-6[13-16]。Tfh细胞在B细胞成熟和其类型转换和特异性成熟过程中起着关键作用,Tfh细胞选择性的向能分泌高亲和力、高特异性抗体的B细胞提供存活,增殖或分化信号[17],并使其发生体细胞突变,为BCR的突变多样性提供了基础。由抗原接触活化的B细胞在Tfh细胞的辅助下由趋化因子和趋化因子样介质引导,迁移通过次级淋巴组织的多个区室,进入生发中心,在其中发生体细胞突变与亲和力成熟,最终分化为能分泌高亲和力与特异性抗体的浆细胞[18-19]。
本研究检测了CD4+CXCR5+ICOS+的Tfh细胞在淋巴结T细胞中的比例变化,结果显示突变体HER2免疫后Tfh细胞比例显著上升,且ICOS+细胞的比例无明显变化,而CXCR5+细胞的比例有所上升。由于CXCR5通过识别CXCL13,将T、B细胞引导至B细胞滤泡,并使T细胞激活B细胞,而ICOS作为B7家族的共刺激分子,通过与其配体ICOSL结合,能刺激T细胞的活化和增殖,因此对硝基苯丙氨酸可能通过上调CXCR5的表达,从而增加归巢至滤泡的Tfh细胞数量,从而促进浆细胞的分化,最终使机体分泌抗HER2抗体。
本研究验证了对硝基苯丙氨酸增加蛋白质免疫原性的作用,证实了含对硝基苯丙氨酸的HER2蛋白免疫能使小鼠淋巴结Tfh细胞比例上调,并使Treg细胞比例下降,但由于Tfh细胞在抗原刺激下分泌的IL-21,IL-4,CXCL13和CD40L等标志物在非特异性刺激下也会发生表达的提高,抗原特异性Tfh细胞的测定是十分困难的[20],因此,这些上调的Tfh细胞是否为HER2特异性Tfh细胞仍需进一步研究。
[1] Gruenewald J,Tsao ML,Perera R,etal.Immunochemical termination of self-tolerance[J].ProcNatlAcadSciUSA,2008,105(32):11276-11280.
[2] Hardy LL,Wick DA,Webb JR.Conversion of tyrosine to the inflammation-associated analog 3′-nitrotyrosine at either TCR-or MHC-contact positions can profoundly affect recognition of the MHC class I-restricted epitope of lymphocytic choriomeningitis virus glycoprotein 33 by CD8 T cells[J].JImmunol,2008,180(9):5956-5962.
[3] Xie J,Schultz PG.An expanding genetic code[J].Methods,2005,36(3):227-238.
[4] Kessel C,Nandakumar KS,Peters FB,etal.A single functional group substitution in C5a breaks B cell and T cell tolerance and protects against experimental arthritis[J].ArthritisRheumatol,2014,66(3):610-621.
[5] Hallam TJ,Wold E,Wahl A,etal.Antibody conjugates with unnatural amino acids[J].MolPharm,2015,12(6):1848-1862.
[6] Grunewald J,Hunt GS,Dong L,etal.Mechanistic studies of the immunochemical termination of self-tolerance with unnatural amino acids[J].ProcNatlAcadSciUSA,2009,106(11):4337-4342.
[7] Gauba V,Grunewald J,Gorney V,etal.Loss of CD4 T-cell-dependent tolerance to proteins with modified amino acids[J].ProcNatlAcadSciUSA,2011,108(31):12821-12826.
[8] Zhang TJ,Tian H,Gao XD.Advances in research on antitumor activities of HER2-based peptide vaccines[J].ProgPharmSci(药学进展),2013,37(10):516-521.
[9] Zhang R,Tian H,Gao XD,etal.Application of next generation genome editing technology in gene therapy and biopharmaceuticals[J].JChinaPharmUniv(中国药科大学学报),2014,45(4):504-510.
[10] Yao DN,Xu XW,Yu HB,etal.Screening system for amber suppressor tRNA based on inducible high-copynumber plasmid[J].JChinaPharmUniv(中国药科大学学报),2013,44(2):174-178.
[11] Chen X,Ma W,Zhang T,etal.Phenotypic Tfh development promoted by CXCR5-controlled re-localization and IL-6 from radiation-resistant cells[J].ProteinCell,2015,6(11):825-832.
[12] Moser B.CXCR5,the defining marker for follicular B helper T (T-FH) cells[J].FrontImmunol,2015,6:296.
[13] Mcguire HM,Vogelzang A,Warren J,etal.IL-21 and IL-4 collaborate to shape T-dependent antibody responses[J].JImmunol,2015,195(11):5123-5135.
[14] Choi YS,Yang JA,Yusuf I,etal.Bcl6 expressing follicular helper CD4 T cells are fate committed early and have the capacity to form memory[J].JImmunol,2013,190(8):4014-4026.
[15] Liu X,Yan X,Zhong B,etal.Bcl6 expression specifies the T follicular helper cell programinvivo[J].JExpMed,2012,209(10):1841-1852.
[16] Ozaki K,Spolski R,Ettinger R,etal.Regulation of B cell differentiation and plasma cell generation by IL-21,a novel inducer of Blimp-1 and Bcl-61[J].JImmunol,2004,173(9):5361-5371.
[17] Crotty S.A brief history of T cell help to B cells[J].NatRevImmunol,2015,15(3):185-189.
[18] Toellner KM.Cognate interactions:extrafollicular IL-4 drives germinal-center reactions,a new role for an old cytokine[J].EurJImmunol,2014,44(7):1917-1920.
[19] Zhang Y,Garcia-Ibanez L,Toellner KM.Regulation of germinal center B-cell differentiation[J].ImmunolRev,2016,270(1):8-19.
[20] Dan JM,Arlehamn CSL,Weiskopf D,etal.A cytokine-independent approach to identify antigen-specific human germinal center T follicular helper cells and rare antigen-specific CD4(+) T cells in blood[J].JImmunol,2016,197(3):983-993.
