石墨烯量子点荧光猝灭-恢复法测定Cu2+与谷胱甘肽的含量
2018-03-20宋凤娟艾永玲钟文英
宋凤娟,艾永玲,钟文英,2*,王 菁,2**
(中国药科大学 1医药生物功能材料重点实验室;2药物质量与安全预警教育部重点实验室,南京 210009)
Cu2+是人体内及许多生物体内重要的金属元素之一,它对于人体的新陈代谢、免疫系统起着至关重要的作用[1]。此外,Cu2+还可以与多种药物分子形成配合物以改变药物的疗效。传统检测Cu2+的方法有分光光度法[2]、原子吸收光谱法[3]、电感耦合等离子体发射光谱法[4]等,而这些方法都存在前处理比较复杂、仪器价格昂贵等缺点。因此,建立快速、准确、简便、成本低廉的检测微量Cu2+方法是非常有必要的。
谷胱甘肽(GSH)是由谷氨酸、半胱氨酸、甘氨酸3种氨基酸组成[5],GSH对于细胞的多种功能有重要作用[6-7],同时GSH的巯基能与多种化学物质及代谢产物相结合,使其作为药物被广泛应用[8-9,14-15]。因此,建立准确快速测定GSH的方法能为临床提供很多有用信息。通常用于检测GSH的方法有高效液相色谱法[10]、高效毛细管电泳法[11]、电化学法[12]等。这些方法各有优点,但存在操作繁琐、耗费时间长等不足。近些年来发展起来的荧光分析方法,具有操作简便、快速和灵敏度高等优点,弥补了传统分析方法的不足,尤其是基于量子点(QDs)荧光分析方法,已发展成为一种新型并有效的方法。
相比于传统的荧光有机染料,QDs具有宽激发、窄发射、高荧光量子产率等优点,是一种理想的分析探针[13]。其中石墨烯量子点(GQDs)是最近发现的粒径小于100 nm具有零维结构的石墨烯纳米片[14]。与传统的QDs相比,GQDs具有较好的光稳定性、高的荧光活性、良好的抗光漂白能力和生物相容性,在各个领域引起较大关注并成为当前的研究热点之一。与此同时,越来越多的研究开始着重于发展一种能够顺序检测不同阳离子和氨基酸的传感技术[15-16]。
基于以上出发点,本研究在温和的条件下氧化石墨粉,得到高分散、高荧光强度的GQDs溶液,并实现了顺序检测Cu2+和GSH。由于GQDs表面的羧基能与Cu2+通过静电相互作用,使荧光强度降低;而当体系中存在有GSH时,GSH的巯基又可与Cu2+相结合,形成Cu-SR键,使GQDs的荧光恢复。因此,本研究利用GQDs荧光猝灭-恢复的现象建立了一种简便准确检测Cu2+与GSH的方法,并应用于含Cu2+与GSH实际样品的测定。
1 材 料
1.1 试 剂
谷胱甘肽(上海阿拉丁生化科技股份有限公司);石墨粉(南京先丰纳米材料科技有限公司);其他试剂均为市售分析纯;实验用水均为超纯水(电阻系数≥18.2 MΩ·cm,Milli-Q,Millipore)。
1.2 仪 器
UV-3600紫外可见吸收光谱仪,IRAffinity-1S红外光谱仪(日本岛津公司);Fluoromax-4荧光光谱仪(日本Horiba公司);2000型透射电子显微镜(TEM,日本Jeol公司);BS110S电子天平(德国赛多利斯公司);pHS-25型pH计(上海雷磁仪器厂)。
2 方 法
2.1 GQDs的制备
GQDs按文献[17]方法合成有所改进,具体步骤为:称取石墨粉1.0 g,置于聚四氟乙烯反应釜中,加入浓H2SO4180 mL与浓HNO360 mL,混合均匀,超声2 h,80 ℃水浴加热24 h。冷却至室温后,用超纯水800 mL稀释,对所获得的GQDs溶液用Na2CO3溶液中和至中性,透析、冷冻干燥,配制成1 mg/mL的GQDs储备液,储存于4 ℃冰箱待用。
2.2 荧光法检测Cu2+
称取CuSO4·5H2O适量,用超纯水溶解,配制成不同浓度系列的Cu2+溶液。在1.5 mL离心管中,依次加入1 mg/mL的GQDs溶液50 μL和不同浓度的Cu2+储备液50 μL,再用超纯水定容至500 μL,涡旋混匀,于室温下放置20 min。以370 nm为激发波长,选狭缝宽度为10 nm/10 nm,测定其荧光强度。
2.3 荧光法检测GSH
称取GSH适量,用超纯水溶解,配制成不同浓度系列的GSH溶液。取经过100 mmol/L Cu2+猝灭的GQDs溶液450 μL,加入不同浓度的GSH储备液50 μL,涡旋混匀。以370 nm为激发波长,选狭缝宽度为10 nm/10 nm,测定其荧光强度。
3 结果与讨论
3.1 GQDs的表征
本实验中,通过对石墨粉进行混酸氧化的方式制备了GQDs,利用透射电子显微镜、荧光光谱仪、紫外可见吸收光谱仪对合成的GQDs进行表征,如图1所示。图1-A为GQDs的TEM图谱与粒径分布图谱,可见合成的GQDs的粒径约为5 nm,且分散均匀,这与粒径分布图集中显示的4~6 nm一致,结果表明用此方法合成的GQDs在溶液中大小均一、高度分散。如图1-B,1-C所示,激发波长在300~370 nm之间,GQDs的荧光强度随着激发波长的红移而增加,在激发波长为370 nm时达到峰值,随后荧光强度逐渐降低,且发射峰位置在激发波长300~400 nm之间并没有明显的变化。因此本研究选取370 nm作为激发波长,GQDs的荧光最大发射峰的位置为458 nm。紫外可见光谱图1-D中230 nm与270 nm的吸收峰为GQDs的特征峰,230 nm的吸收峰是C==C的π-π*跃迁形成,而270 nm的吸收峰是C==O的n-π*跃迁形成。从GQDs的红外光谱图1-E可见,在3 447 cm-1处存在C-OH的伸缩振动峰,C==C的伸缩振动峰为1 640 cm-1,C-O-C的振动峰为1 093 cm-1,红外光谱图表明用此方法合成的GQDs表面含有丰富的含氧官能团。此外合成的GQDs荧光强度对pH有较强的依赖性,如图1-F所示,在pH为7时GQDs的荧光强度最高,因此选择此为体系反应pH。
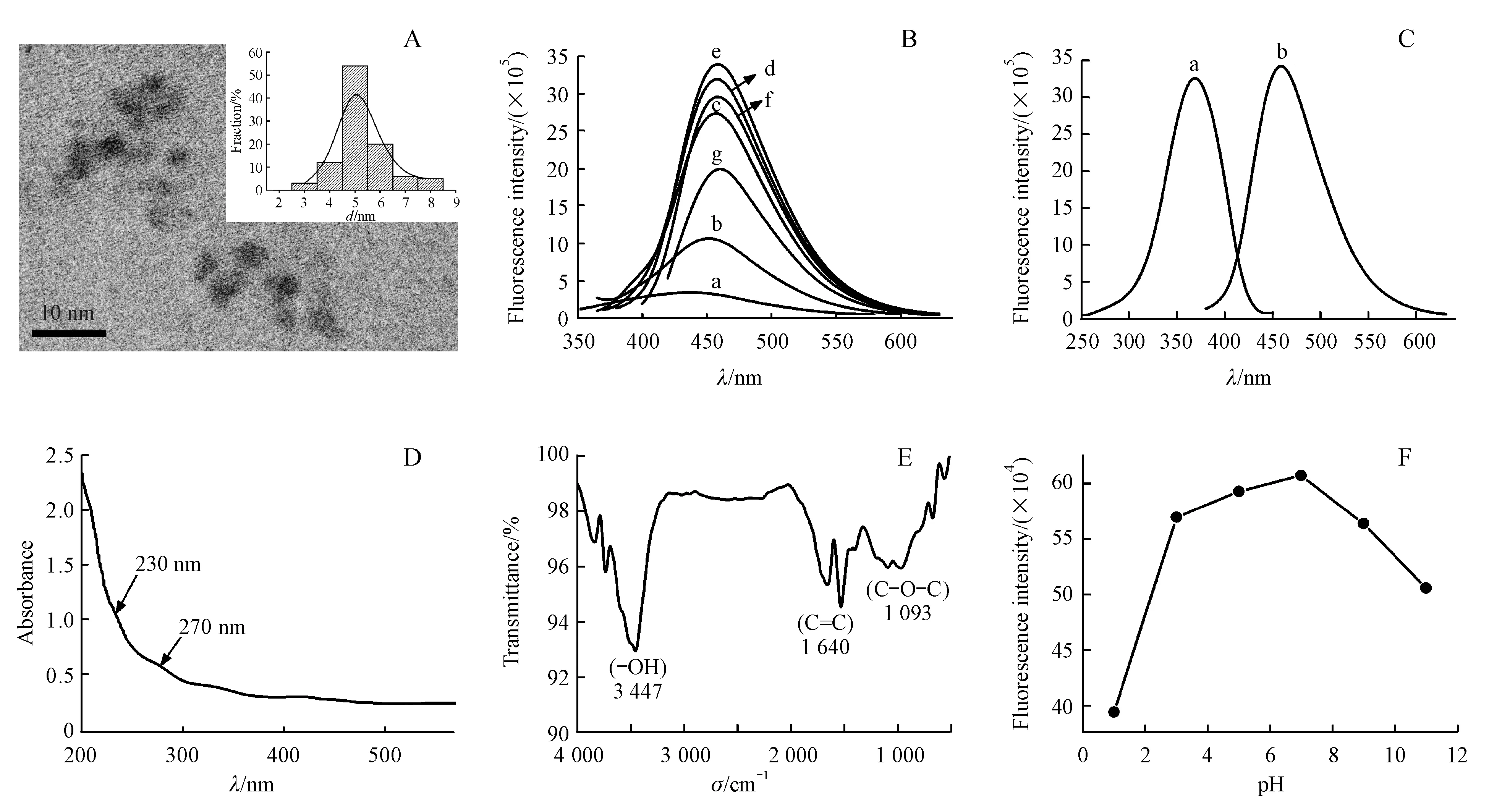
Figure1 Characterization of graphene quantum dots (GQDs)
A:TEM images of GQDs,Inset:Corresponding size distribution of GQDs;B:Fluorescence spectra of GQDs at different excitation wavelengths:(a) 300 nm;(b) 325 nm;(c) 350 nm;(d) 360 nm;(e) 370 nm;(f) 380 nm;(g) 400 nm;C:Excitation spectra (a) and emission spectra (b) of GQDs;D:UV-Vis spectra of GQDs;E:FT-IR spectra of GQDs;F:Relationship between pH value and fluorescence intensity
3.2 Cu2+与GSH对GQDs荧光光谱的影响
实验研究表明,Cu2+和GSH先后加入GQDs溶液,会显著改变GQDs的荧光强度,结果如图2所示。由图2曲线a、b比较可见,GQDs在加入100 mmol/L Cu2+溶液50 μL之后,荧光强度大幅度降低,这是由于GQDs表面的羧基基团与Cu2+通过静电作用结合,GQDs处于激发态的电子转移至Cu2+未占有电子能级的最低轨道上,GQDs的电子以非辐射的形式回到基态,导致荧光强度降低[18]。而随着GSH的加入到这个猝灭体系中,GQDs的荧光强度又逐渐恢复(曲线c)。但若体系中没有Cu2+存在,而只是加入相同量的GSH,体系的荧光强度与GQDs本身荧光发射并没有明显变化(曲线d)。这是由于GSH的巯基基团只与Cu2+结合,从而形成Cu-SR键,Cu-SR键的强度大于静电作用力的强度,因此Cu2+会逐渐从GQDs表面脱离下来,使得GQDs的荧光强度得以恢复。
3.3 荧光猝灭法对Cu2+的浓度测定
GQDs荧光猝灭的程度与Cu2+的浓度直接相关。图3-A呈现了随着不同浓度Cu2+的加入,GQDs的荧光强度逐渐降低,当Cu2+的浓度达到100 mmol/L后,GQDs的荧光强度随着Cu2+加入变化很小,基本上已经达到一个稳定值,因此后续检测GSH时,取Cu2+的浓度为100 mmol/L。Cu2+的浓度测定结果如图3-B所示,在1.0~10.0 mmol/L范围内与GQDs的荧光强度呈良好的线性关系,线性回归方程为F=-34 863.81c+762 248.98,线性相关系数(r)达0.995 8,检测限是0.01 mmol/L。在相同条件下对10 mmol/L的Cu2+标准溶液进行6次平均测定,得到相对标准偏差(RSD)为1.8%。以上可证明此荧光猝灭法能准确检测Cu2+。

Figure2 Fluorescence spectra of (a) GQDs,(b) GQDs+Cu2+(100 mmol/L),(c) GQDs+Cu2+(100 mmol/L)+GSH (1.0 mmol/L) and (d) GQDs+GSH (1.0 mmol/L)
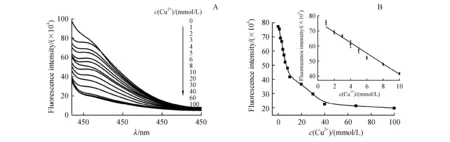
Figure3 Determination of Cu2+concentration by fluorescence quenching
3.4 荧光恢复法对GSH的含量测定
为了考察猝灭后的GQDs荧光恢复程度能检测GSH的具体范围,本研究向经过100 mmol/L Cu2+猝灭的GQDs溶液中加入不同浓度的GSH溶液,结果如图4所示。由于GSH的巯基基团与Cu2+的相互作用,随着不同浓度的GSH的加入,GQDs的荧光强度逐渐恢复。但当GSH的浓度超过1.0 mmol/L时,GQDs的荧光光谱变形,这可能由于GSH与Cu2+反应改变了GQDs所处的外界环境,进而影响到峰形。GSH的浓度在0.1~1.0 mmol/L范围内与GQDs的荧光强度呈线性关系,线性方程为F=370 422.25c+243 862.20,线性相关系数达0.991 2,检测限为0.1 mmol/L。同样,在相同条件下对0.6 mmol/L的GSH标准溶液进行了6次平均测定,得到相对标准偏差(RSD)为1.5%。因此表明这种利用GQDs荧光猝灭-恢复法对GSH的检测具有良好的准确度和精密度。
3.5 荧光体系的选择性考察
特异性是衡量分析方法的一个重要指标。本研究在同样的实验条件下,考察多种金属离子:Ag+、Ca2+、Mg2+、Zn2+、Fe2+、Hg2+、Pb2+、Al3+、Fe3+单独存在以及与Cu2+共存情况下对GQDs荧光强度的影响。其中其他金属离子浓度为Cu2+浓度的10倍,测定荧光强度变化ΔI(ΔI=F0-F,F0为GQDs的荧光强度,F为加入金属离子后的荧光强度)。结果如图5-A所示,除了Cu2+能显著猝灭GQDs的荧光发射,其余的离子对GQDs的荧光强度影响不大,可以说明该方法对Cu2+的检测有很好的选择性。
同样,本研究也考察了GSH检测中共存物质的潜在干扰,在经过Cu2+猝灭的GQDs溶液中分别加入4种不同的蛋白:半胱氨酸、葡萄糖、赖氨酸、多巴胺,其浓度均设为GSH浓度的10倍,测定荧光强度的变化ΔI′(ΔI′=F′-F0′,F′为加入蛋白后的荧光强度,F0′为被100 mmol/L Cu2+猝灭后的GQDs荧光强度),如图5-B所示,加入GSH之后GQDs的荧光强度有明显增强,然而其他蛋白并不能明显改变GQDs的荧光强度,结果显示此检测方法能很好地检测GSH,并不受其余干扰物质的影响。
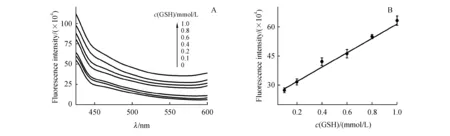
Figure4 Determination of GSH concentration by fluorescence recovery
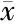
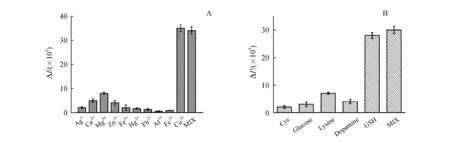
Figure5 Selectivity of the fluorescence system
3.6 实际样品分析
为了进一步探索本检测方法对实际样品的应用,本研究利用药品阿司匹林能与加入的硫酸铜络合形成阿司匹林铜,在测定之前用盐酸与阿司匹林铜反应使得络合的Cu2+再次游离到溶液中,用该方法检测所加入的Cu2+浓度。加入的浓度分别为3.0、5.0、7.0 mmol/L,结果如表1所示回收率在93.33%~101.4%,RSD不大于4%,同样,采用加标回收法测定人血清样品中GSH的含量,加入浓度分别为0.30、0.50、0.70 mmol/L,结果表明回收率在95.76%~106.7%,RSD均小于5%,因此,此检测方法对实际样品的检测结果也令人满意。
Table1 Determination of Cu2+and GSH in practical samples

SampleAdded/(mmol/L)Found/(mmol/L)Recovery/%RSD/(%,n=5)Copper⁃aspirincomplex302893334050531060327071101435Serumsample030032106748050049980225070067957638
4 结 论
本研究通过在温和条件下氧化石墨粉成功合成单分散的GQDs溶液,荧光强度高,粒径均一,并且利用GQDs荧光猝灭-恢复的效应,实现了对Cu2+与GSH灵敏检测,检测限分别为0.01和0.1 mmol/L。本文所建立的分析方法专属性强、重现性好、精密度高、操作简便,未来有希望为药物开发、药物检测提供支持。
[1] Ji HF,Zhang HY.A new strategy to combat Alzheimer′s disease combining radical-scavenging potential with metal-protein-attenuating ability in one molecule[J].BioorgMedChemLett,2005,15(1):21-24.
[2] Tang LJ,Li FF,Liu MH,etal.A new rhodamine B derivative as a colorimetric chemosensor for recognition of copper(II) ion[J].BullKoreanChemSoc,2010,31(11):3212-3216.
[3] Sahin CA,Tokgoz I.A novel solidified floating organic drop microextraction method for preconcentration and determination of copper ions by flow injection flame atomic absorption spectrometry[J].AnalChimActa,2010,667(1/2):83-87.
[4] Otero-Romani J,Moreda-Pineiro A,Bermejo-Barrera A,etal.Evaluation of commercial C18 cartridges for trace elements solid phase extraction from seawater followed by inductively coupled plasma-optical emission spectrometry determination[J].AnalChimActa,2005,536(1/2):213-218.
[5] Grek CL,Zhang J,Manevich Y,etal.Causes and consequences of cysteineS-glutathionylation[J].JBiolChem,2013,288(37):26497-26504.
[6] Yu F,Li P,Wang BS,etal.Reversible near-infrared fluorescent probe introducing tellurium to mimetic glutathione peroxidase for monitoring the redox cycles between peroxynitrite and glutathioneinvivo[J].JAmChemSoc,2013,135(20):7674-7680.
[7] Samarasinghe KTG,Godage DNPM,VanHecke GC,etal.Metabolic synthesis of clickable glutathione for chemoselective detection of glutathionylation[J].JAmChemSoc,2014,136(33):11566-11569.
[8] Chang RCC,So KF.Use of anti-aging herbal medicine,lycium barbarum,against aging-associated diseases.What do we know so far[J]?CellMolNeurobiol,2008,28(5):643-652.
[9] Hughes TB,Miller GP,Swamidass SJ.Site of reactivity models predict molecular reactivity of diverse chemicals with glutathione[J].ChemResToxicol,2015,28(4):797-809.
[10] Assensi M,Sastre J,Pallardó FV,etal.A high performance liquid chromatography method for measurement of oxidized glutathione in biological samples[J].AnalBiochem,1994,217(2):323-328.
[11] Zhao M,Zhou MF,Feng H,etal.Determination of tryptophan,glutathione,and uric acid in human whole blood extract by capillary electrophoresis with a one-step electrochemically reduced graphene oxide modified microelectrode[J].Chromatographia,2016,79(13/14):911-918.
[12] Wang Y,Lu J,Tang LH,etal.Graphene oxide amplified electrogenerated chemiluminescence of quantum dots and its selective sensing for glutathione from thiol-containing compounds[J].AnalChem,2009,81(23):9710-9715.
[13] Li XM,Rui MC,Song JZ,etal.Carbon and graphene quantum dots for optoelectronic and energy devices:a review[J].AdvFunctMater,2015,25(31):4929-4947.
[14] Zhao LM,Chen LN,Zhao SL.Detection of ascorbic acid by fluorescence probe based on graphene quantum dots[J].ChinJLumin(发光学报),2017,38(1):124-131.
[15] Hu Y,Heo CH,Kim G,etal.One-photon and two-photon sensing of biothiols using a bis-pyrene-Cu(II) ensemble and its application to image GSH in the cells and tissues[J].AnalChem,2015,87(6):3308-3313.
[16] You GR,Jang HJ,Jo TG,etal.A novel displacement-type colorimetric chemosensor for the detection of Cu2+and GSH in aqueous solution[J].RSCAdv,2016,6(78):74400-74408.
[17] Qian ZS,Shan XY,Chai LJ,etal.A fluorescent nanosensor based on graphene quantum dots-aptamer probe and graphene oxide platform for detection of lead (II) ion[J].BiosensBioelectron,2015,68:225-231.
[18] Li Z,Wang Y,Ni YN,etal.A rapid and label-free dual detection of Hg (II) and cysteine with the use of fluorescence switching of graphene quantum dots[J].SensorActuatB-Chem,2015,207:490-497.
