双特异性抗体mAb04-MICA对人白血病细胞K562的体内外抗肿瘤活性
2018-03-20杜晓典孙福谋袁敏讷刘雅利尚鹏钊
杜晓典,孙福谋,袁敏讷,王 斐,刘雅利,尚鹏钊,王 旻,张 娟
(中国药科大学生命科学与技术学院抗体工程实验室,南京 210009)
肿瘤的发生与发展需要新生血管供给营养,大量临床数据证明任何可探测的实体瘤的生长都伴随着肿瘤血管体系的形成[1-3]。近年来研究者在许多血液瘤临床患者的骨髓样本中也发现了大量增生的微血管。这说明无论是对实体瘤还是血液瘤,血管生成都发挥着重要作用。抗血管生成治疗已逐步发展成为肿瘤治疗的一种有效方法[4]。VEGF是目前所知的最强的直接作用于血管内皮细胞的生长因子,VEGF/VEGFR2信号通路是调节血管新生的重要通路之一[5]。针对VEGF通路已上市多种药物,其中单抗隆抗体有抗VEGF的贝伐单抗(bevacizumab,Avastin)以及抗VEGFR2的雷莫芦单抗(ramucirumab,IMC-1121B)。其中雷莫芦单克隆抗体通过结合VEGFR2,阻断VEGF与其结合,抑制VEGFR2的磷酸化,从而抑制其下游一系列信号通路,达到抑制肿瘤生长的作用[6-7]。但在治疗过程中,抗体药物单独用药不能明显提高患者的生存期,且伴随呕吐、腹泻、高血压等不良反应及耐药等问题,限制了其在临床的使用[8-9]。如何提高雷莫芦单抗的药效,降低不良反应,成为抗肿瘤血管生成抗体在临床应用中亟需解决的问题。
MIC基因属于跨越MHC-Ⅰ类区域的非经典HLA-Ⅰ(human leucocyte antigen-Ⅰ)类基因家族,它包括MICA至MICF 6个成员,MICA和MICB是发挥功能的重要成员,二者是NK细胞和CD8+T细胞表面活化型受体NKG2D的重要配体[10-11]。其中MICA在大多数肿瘤细胞如乳腺癌、肺癌及卵巢癌中有表达,被认为是肿瘤相关性抗原。NK细胞或CD8+T细胞借助NKG2D与肿瘤细胞表面的MICA或MICB相互作用而与肿瘤细胞靠近、结合并被活化,通过释放细胞因子等来裂解肿瘤细胞[12-13]。不幸的是,肿瘤细胞会通过脱落MIC分子来抑制免疫细胞的激活,若NKG2D识别了从肿瘤细胞表面脱落的游离MIC分子则不会激活免疫细胞,引起免疫逃逸[14]。因此解决这种免疫抑制现象的关键在于如何重建MICA在肿瘤免疫监视作用中的地位。
以肿瘤靶向抗体为基础设计双特异性抗体,在不提高给药剂量的前提下提高抗体的药效,是目前抗体工程领域主要研究方向。本课题组前期实验显示:通过将MICA分子与本实验室自主研发的靶向VEGFR2的单克隆抗体mAb04相融合,借助抗体的靶向性完成对肿瘤细胞的识别,再利用MICA与NKG2D的相互作用,从而激活NKG2D阳性免疫细胞杀伤肿瘤细胞[15]。本实验室已对mAb04-MICA体外抗白血病细胞K562的活性进行了初步的研究。结果表明,mAb04-MICA相比于母体单抗mAb04能够增强免疫细胞对肿瘤细胞的特异性杀伤,促进白血病细胞K562的凋亡[16]。然而,mAb04-MICA在体内的抗白血病能力还尚且未知。本研究旨在鉴定mAb04-MICA对抗原和受体的亲和力,并通过建立K562小鼠移植瘤模型,初步探索mAb04-MICA体内外抗白血病的药效。
1 材 料
1.1 试 剂
mAb04-MICA、mAb04抗体由本实验室构建,经摇瓶发酵并纯化得到;DMEM培养基、RPMI-1640培养基、胎牛血清(美国Gibco公司);胰蛋白酶(美国Ameresco公司);辣根过氧化物酶标记的山羊抗人IgG(H+L)(上海生工生物工程有限公司);CCK8溶液(美国MCE公司);组化试剂盒DAB显色液、苏木精染色液、DAPI(美国Solarbio公司);VEGFR2抗体、CD34抗体、VEGF抗体、Ki-67抗体(美国SAB公司);伊马替尼(瑞士Novartis公司);Matrigel基质胶(美国BD公司)。
1.2 细胞株
小鼠皮肤黑色素瘤细胞株B16-F10、人慢性粒细胞白血病细胞株 K562、人胚胎肾上皮细胞HEK-293T购自中科院上海细胞所。
1.3 动 物
6周龄雌性BALB/c裸鼠,体质量18~22 g,购自南京大学南京生物医药研究院,合格证号:201703990。饲养环境温度22~26 ℃,所有动物均自由进食水。动物实验均符合动物伦理委员会标准。
2 方 法
2.1 细胞培养
B16F10细胞贴壁生长,采用含10%优质胎牛血清的DMEM完全培养基;K562细胞悬浮生长,采用含10%优质胎牛血清的RPMI-1640培养基。两株细胞均于37 ℃含5%CO2的培养箱中培养。取生长良好的对数期细胞进行实验。
2.2 ELISA鉴定双特异性抗体的亲和力
酶条置于紫外灯下照30 min,每孔加VEGFR2/NKG2D 100 μL,4 ℃包被过夜。每孔加含5%脱脂奶粉的PBS 200 μL,于37 ℃封闭2 h,加入不同质量浓度的mAb04-MICA、mAb04、sMICA,对照组加入PBS,37℃孵育2 h。加入辣根过氧化物酶标记的山羊抗人IgG (H+L)100 μL,2 h后每孔加入TMB溶液100 μL,室温避光显色10 min,每孔加入浓硫酸50 μL终止反应。多功能酶标仪测定630和450 nm下的吸收度,并以A450-A630的值,作为最终检测结果。
2.3 抗体对K562细胞增殖的作用
培养K562、HEK-293T细胞至汇合度达到约80%,消化细胞并制备成浓度为每毫升5×104个细胞的单细胞悬液,以每孔100 μL接种于96孔板,37 ℃培养24 h。每孔加入配好的药物10 μL,48 h后加入CCK-8溶液10 μL,放置于37 ℃培养箱继续培养4 h,多功能酶标仪检测A450。求出抑制率后使用GraphPad Prism 5软件绘制折线图。
2.4 抗体对鼠VEGFR2(mVEGFR2)的交叉反应
培养B16-F10细胞至汇合度达到约80%,消化细胞并将浓度调节至每毫升5×106个细胞,分为5组,每管加入单细胞悬液250 μL。前3组均加入2%FBS-PBS,另外2组分别加入mAb04和抗鼠源VEGFR2的市售抗体Anti-mVEGFR2,冰浴孵育1 h。4 ℃冷冻离心机离心5 min,吸弃上清液。后两组分别加入Anti-mVEGFR2和mAb04孵育1 h。将带FITC标记的羊抗人IgG抗体按1∶500稀释,加入各管细胞中混匀,并置于冰浴进行孵育,每10分钟混匀1次,共孵育1 h。用2% FBS-PBS 500 μL洗涤,PBS 500 μL重悬肿瘤细胞,使用流式细胞仪进行检测,并用FlowJo软件分析数据。以上所用mAb04和Anti-mVEGFR2浓度均为200 nmol/L。
2.5 K562移植瘤裸鼠模型的建立
培养K562细胞,数目足够时,离心细胞,用含10% FBS RPMI-1640培养基重悬,调整细胞浓度为每毫升2×108个细胞。取细胞悬液50 μL与Matrigel基质胶50 μL混合,接种6周龄的BALB/c裸鼠。待K562实体瘤形成后,剥瘤,以组织接种法接种于新的6周龄BALB/c裸鼠。如此体内稳定3代后,植瘤成功率达到95%以上,K562移植瘤裸鼠模型建立成功。
2.6 K562移植瘤裸鼠给药方法
将成功建模的K562荷瘤裸鼠分为6组,每组分别给药mAb04(5 mg/kg)、mAb04-MICA(1 mg/kg)、mAb04-MICA(2.5 mg/kg)、mAb04-MICA(5 mg/kg)、伊马替尼(60 mg/kg),无菌PBS。每3天给药1次,给药体积为100 μL,每次给药均测量肿瘤体积,按以下公式计算瘤体积(V=LW2/2,其中L代表肿瘤最长径,W代表与肿瘤最长径垂直的最大横径)。给药10次以后,以离颈方式处死荷瘤裸鼠并解剖取瘤,对离体的瘤组织称重并绘制瘤重分布图,根据最终瘤重计算抑瘤率。未处死取瘤的移植瘤裸鼠,继续饲养观测各组移植瘤裸鼠的生存期并绘制曲线。
2.7 免疫组化检测肿瘤组织增殖及血管生成相关指标
肿瘤组织保存在4%多聚甲醛溶液中。切片用二甲苯脱蜡2次,0.1%的Triton-X100处理15 min,10%山羊血清的PBS溶液封闭,室温1 h。在1%山羊血清的PBS溶液中加入特异性一抗1∶100,4 ℃过夜孵育。在无血清的PBS溶液中加入带HRP标记二抗1∶100,室温3 h。切片染色,使用DAB试剂盒,将溶液A和溶液B 50 μL与双蒸水900 μL混合,滴在切片组织上,室温孵育5 min。苏木素染色液染核2 min。切片依次用50%、70%、80%、90%和100%乙醇洗1次,每次2 min。风干后,加封片剂,盖上盖玻片。倒置荧光显微镜拍照(×100)。
3 结 果
3.1 双特异性抗体与VEGFR2和NKG2D的结合能力
采用ELISA鉴定双特异性抗体与VEGFR2及NKG2D在分子水平上的结合能力。如图1所示,mAb04-MICA与抗原具有较为良好的亲和活性。其中mAb04-MICA与VEGFR2显示了较高的亲和力,且与母体单抗mAb04几乎一致,证明了MICA分子的融合并没有影响抗体对抗原的结合。同时,MICA与NKG2D的亲和活性也得以完整保留。因此与预期的亲和活性类似,能与抗原VEGFR2及受体NKG2D进行结合。
3.2 抗体在体外对K562细胞增殖的影响
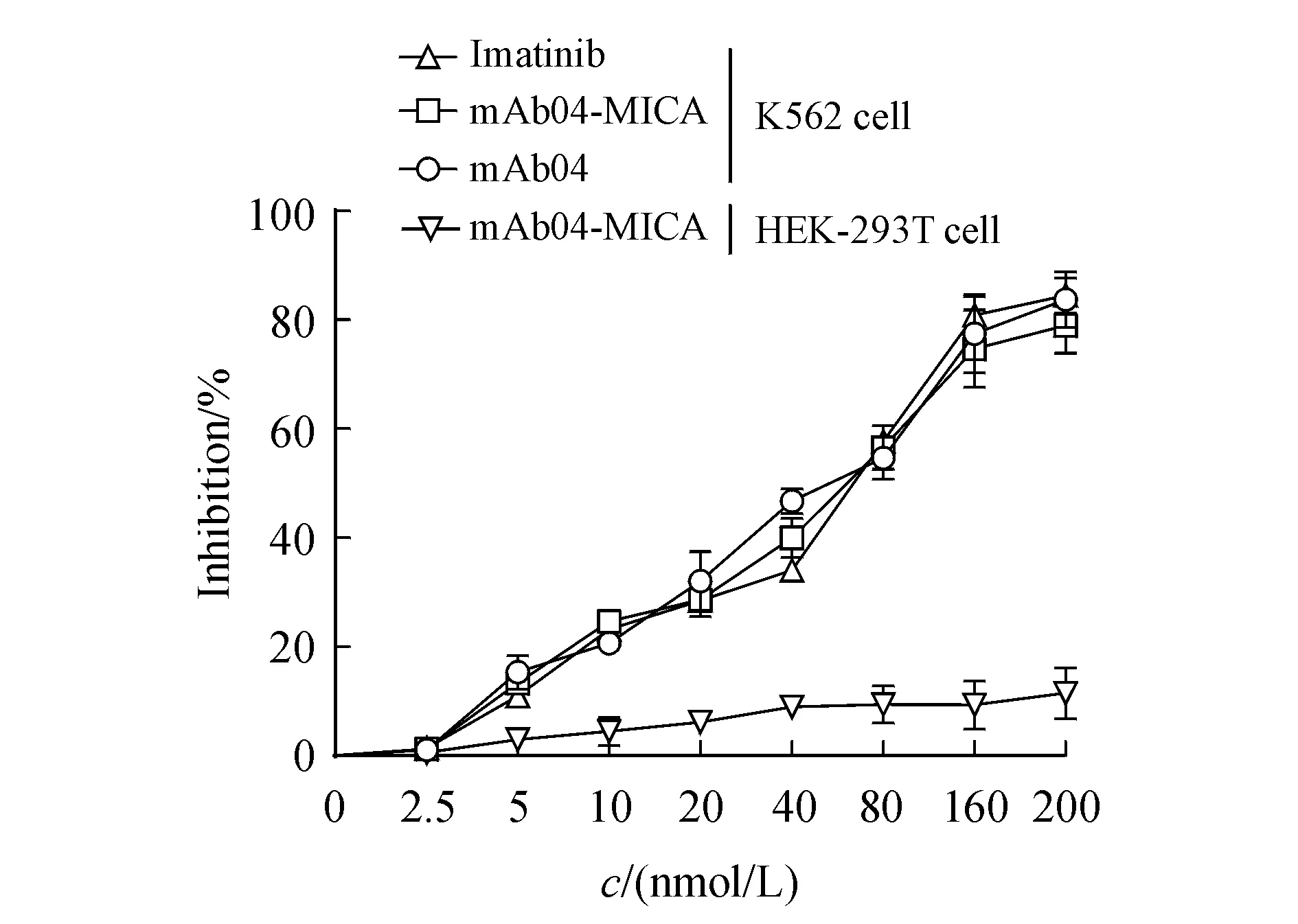
在药物作用48 h后,用CCK8法检测双特异性抗体对K562细胞的增殖抑制作用。如图2所示,双特异性抗体能够有效抑制VEGF诱导下的K562细胞的增殖能力,并且抑制作用具有浓度依赖性;半数抑制率在10-8mol/L水平,与阳性药伊马替尼相当。但是对VEGF诱导下的VEGFR2阴性表达的HEK-293T细胞增殖无抑制作用。mAb04-MICA能特异性地阻碍VEGF与K562细胞表面VEGFR2的结合进而抑制细胞的增殖,在发挥抗肿瘤活性的同时能够确保安全性。
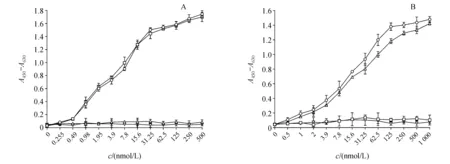

A:Binding affinity of the fusion protein to recombinant VEGFR2;B:Binding affinity of the fusion protein to recombinant NKG2D
3.3 流式细胞仪检测mAb04-MICA对mVEGFR2的结合能力
如图3-A和3-B所示,mAb04-MCIA和Anti-mVEGFR2对B16F10都有很高的结合能力,分别是27.1%、32.6%。用mAb04-MCIA封闭mVEGFR2后Anti-mVEGFR2对其失去结合能力,结合率仅为3.57%(图3-C)。同样的,先用Anti-mVEGFR2封闭mVEGFR2后,mAb04-MCIA对其结合率仅为1.79%(图3-D),表明靶向人VEGFR2的mAb04-MICA对高表达mVEGFR2的鼠源肿瘤细胞具有识别和结合能力,与鼠源VEGFR2和人源VEGFR2具有高度同源性结论一致,为该人源抗体在小鼠体内进行进一步的药学活性和毒性研究提供了理论依据和实验支持。此外,高表达VEGFR2的肿瘤细胞经过mAb04-MCIA预处理,能够阻断市售Anti-mVEGFR2对细胞的结合作用,更进一步说明了该双特异性抗体对抗原VEGFR2的特异靶向性和专一性。
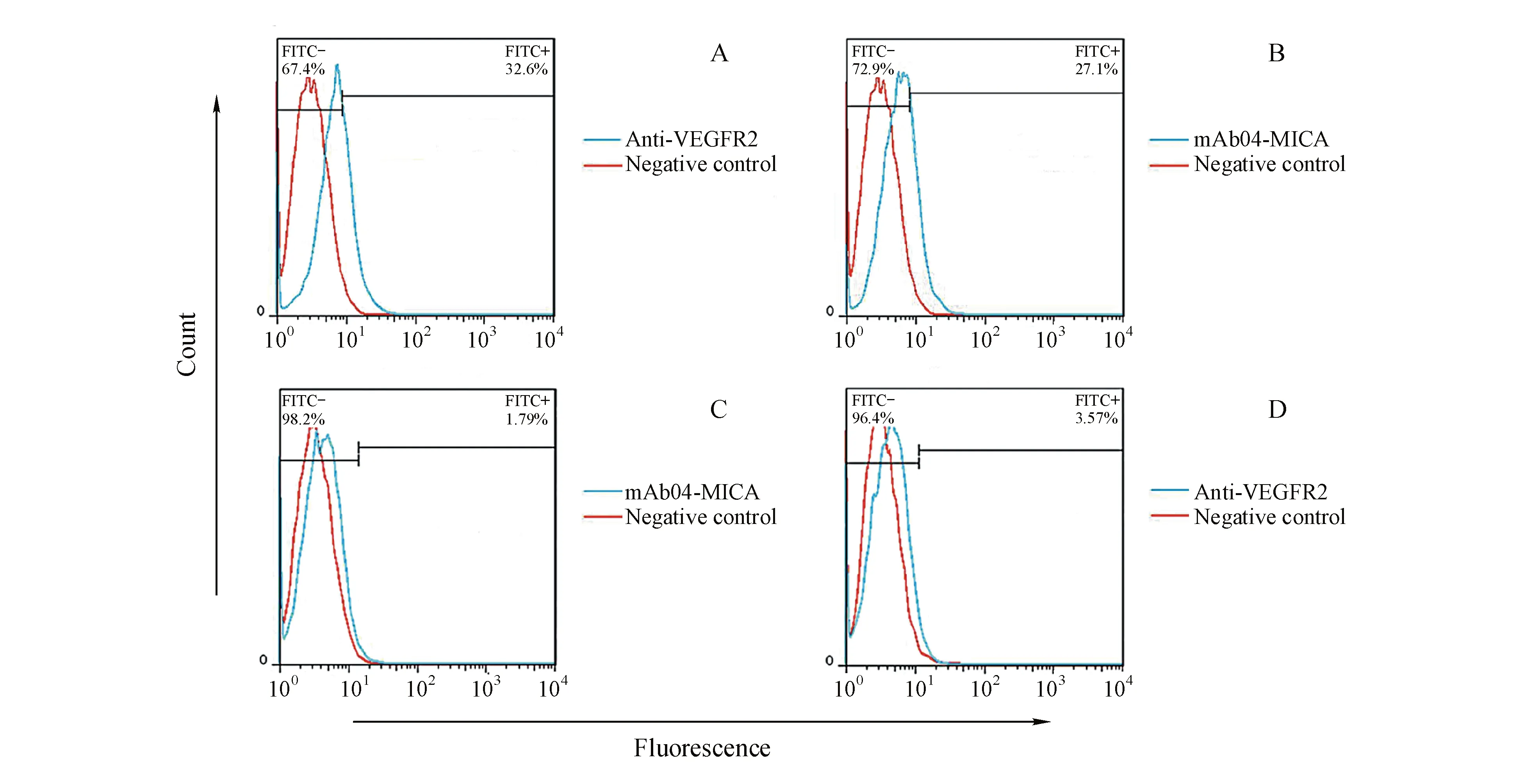
Figure3 mAb04-MICA targeting human VEGFR2 can also target to mVEGFR2
A:Commercially available anti-mVEGFR2 antibody showed high binding ability to mVEGFR2;B:mAb04-MICA showed high binding ability to mVEGFR2;C:Anti-mVEGFR2 antibody showed nearly no binding to mVEGFR2 after blocking with mAb04-MICA;D:mAb04-MICA showed nearly no binding to mVEGFR2 after blocking with anti-mVEGFR2 antibody
3.4 mAb04-MICA对K562小鼠移植瘤生长的抑制作用
K562移植瘤模型建模后,待瘤体积达到100 mm3时开始给药(day 1),每3日经皮下给药1次,测量并记录瘤体积,绘制移植瘤生长曲线(图4-B)。移植瘤裸鼠剥瘤后,按组别对移植瘤瘤块进行拍照(图4-A),不同给药组之间移植瘤体积存在差异。瘤块离体后测量瘤重,绘制分布图,如图4-C所示。图4-D展示依据最终瘤重计算所得各组药物的抑瘤率:高剂量mAb04-MICA组抑瘤率高达69.6%,母体单抗组为49.9%,伊马替尼处理组为68.1%。依据图4-B和4-C的结果以及t检验结果显示:(1)mAb04-MICA的抑瘤率呈浓度依赖性;(2)高剂量mAb04-MICA组的抑瘤率明显高于同等剂量的母体单抗组;(3)高剂量mAb04-MICA组的抑瘤率等同于市售治疗白血病一线药伊马替尼组;综上所述,双特异性抗体mAb04-MICA比母体单抗mAb04更加有效的抑制荷瘤裸鼠移植瘤的生长,与伊马替尼的抑瘤效果无显著性差异。
3.5 mAb04-MICA对K562荷瘤小鼠生存期的影响
结合图5发现,相同剂量的双特异性抗体mAb04-MICA比母体单抗mAb04更有效的延长荷人白血病裸鼠的生存期,mAb04-MICA延长荷瘤鼠的生存期的活性呈浓度依赖性,且高剂量组与阳性对照药伊马替尼相当。此结果与荷K562裸鼠瘤体积生长及瘤重分布结果一致。
3.6 免疫组化检测瘤组织中Ki-67表达量
从免疫组化结果(图6)可以观察到:和阴性对照相比mAb04-MICA可以明显抑制荷人白血病裸鼠皮下移植瘤组织中Ki-67的表达,且呈mAb04-MICA浓度依赖性。Ki-67是一种增殖细胞相关的核抗原,其功能与有丝分裂密切相关,在细胞增殖中不可或缺,Ki-67作为标记细胞增殖状态的抗原,其表达量的减少说明mAb04-MICA可以有效抑制裸鼠肿瘤细胞的增殖。
3.7 免疫组化检测肿瘤组织血管生成相关指标
VEGF/VEGFR2信号通路激活的第一步是VEGFR2的二聚化和磷酸化,在体内,随瘤体积的增大伴随旁分泌VEGF增加,血管增生,以满足瘤组织养料的供应。从图7-A,图7-B可以看出,和阴性对照相比mAb04-MICA可以明显抑制K562移植瘤裸鼠皮下移植瘤组织中p-VEGFR2、VEGF的表达量,且呈浓度依赖性。p-VEGFR2表达量减少说明mAb04-MICA可以有效抑制裸鼠肿瘤细胞表面VEGFR2的磷酸化。VEGF减少则说明mAb04-MICA可以通过抑制VEGFR2的磷酸化来反向下调VEGF的表达,从而抑制血管新生。CD34是新生血管标志物,CD34的减少(图7-C)也从一个方面说明mAb04-MICA大大减少了肿瘤新生血管的数量和密度。

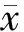
A:Images of tumors peeled from different treatments in BALB/c nude mouse model;B:Tumor growth curves of each group under different treatments;C:Average tumor weights of different groups after 30-day treatment;D:Inhibitory rate of different groups
*P<0.05,**P<0.01,ns:no significance
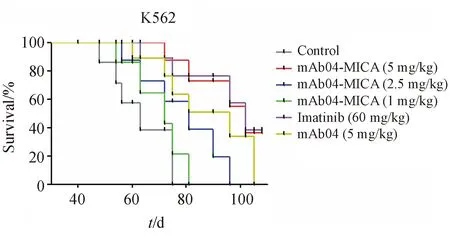
Figure5 Survival of tumor-bearing mice after 100-day tumor challenge
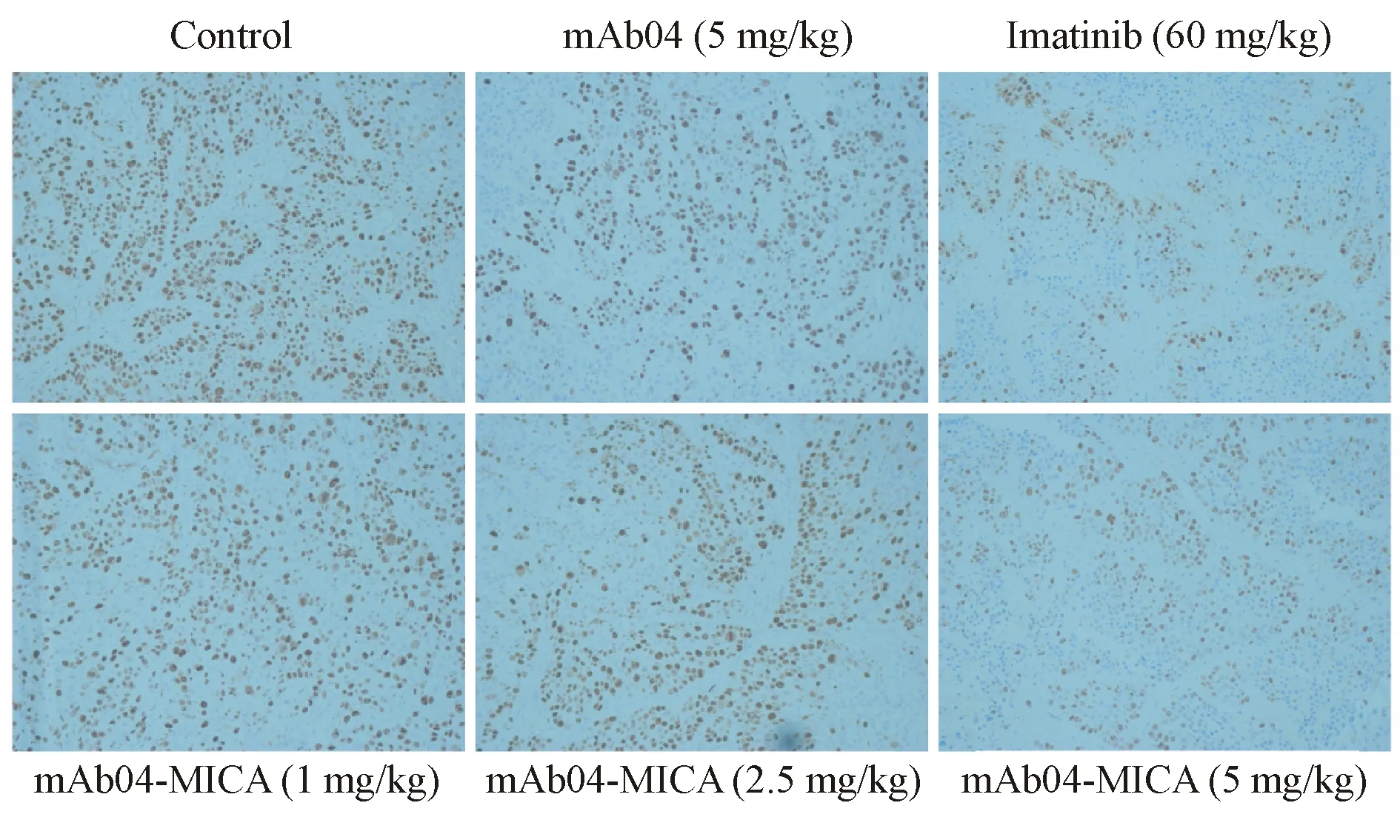
Figure6 Proliferate of tumor cells under different treatments was detected by IHC staining of Ki-67 (brown staining)
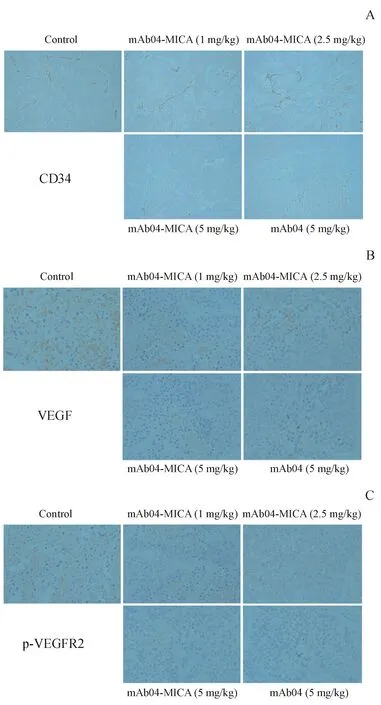
Figure7 IHC staining tumor tissue in K562 xenograft (×100)
A:IHC staining of p-VEGFR2 on paraffin sections of xenografted tumor.p-VEGFR2+cells were identifed with an anti-Ki-67 antibody (brown staining);B:IHC staining of VEGF (brown staining);C:IHC staining of CD34.The CD34+blood vessels were identifed with an anti-CD34 antibody (brown staining).Photomicrographs showed representative pictures from 3 independent tumor samples
4 讨 论
白血病是一种异质性群体疾病,在我国儿童和35岁以下人群中致死率排名第一[17]。研究表明,白血病能够表达具有功能的VEGFR2从而促进肿瘤的增殖[18]。
前期工作中,本课题组获得了可以特异性靶向VEGFR2的全人源抗体mAb04,具有较高的对VEGFR2的亲和力、抗血管生成作用和抗肿瘤活性[19]。在其基础上,本课题组设计出双特异性抗体mAb04-MICA,在保留母体单抗mAb04抗血管功能的同时,重塑NKG2D途径介导的免疫监视,将靶向性抗体与具有免疫调节作用的蛋白偶联,在尽可能减少给药剂量的情况下,最大限度发挥抗肿瘤作用。
本实验室已对双特异性抗体mAb04-MICA体内外抗血管生成和抗乳腺癌的活性进行了研究,发现其能够有效抑制肿瘤组织中新生血管的形成,并且通过MICA分子将NK细胞募集至肿瘤微环境中,重建免疫免疫监视作用[15,20-21]。此外,mAb04-MICA体外抗K562细胞的活性研究表明其可以促进K562细胞的凋亡和阻滞细胞周期[16]。
本文研究了双特异性抗体mAb04-MICA对白血病细胞K562的体内外抗肿瘤活性。结果显示,mAb04-MICA对抗原VEGFR2和MICA的受体NKG2D均具有良好的结合,能够显著抑制K562的体外增殖,而对VEGFR2低表达的HEK-293T不显示增殖抑制作用,进一步说明了该双特异性抗体的特异性抗肿瘤活性。
考虑到mAb04-MICA为人源抗体,尽管人源和鼠源的VEGFR2同源性高达86.37%,抗人VEGFR2的抗体对鼠源VEGFR2(mVEGFR2)的靶向性仍有待验证。B16-F10是VEGFR2高表达的的小鼠黑色素瘤细胞株,选作mVEGFR2载体。首先通过B16-F10的流式结合实验验证了mAb04-MICA对于mVEGFR2的高亲和性。选用T淋巴细胞免疫缺陷型裸鼠进行K562细胞的植瘤。以临床治疗白血病的一线药物伊马替尼为阳性对照药,初步验证了双特异性抗体mAb04-MICA的抗肿瘤活性较mAb04单抗显著增强。通过免疫组化方法测定瘤组织中Ki-67、p-VEGFR2、VEGF及CD34的表达,结果显示mAb04-MICA可以通过抑制肿瘤细胞VEGFR2的磷酸化,降低p-VEGFR2的表达,减少VEGF在肿瘤组织部位的表达和富集,有效抑制VEGF/VEGFR2通路的活化,进而抑制肿瘤新生血管的生成,达到抑制肿瘤细胞增殖和肿瘤生长的抗肿瘤活性。观测各组移植瘤裸鼠的生存期,发现mAb04-MICA可以剂量依赖性地抑制K562移植瘤的生长,在生存期延长上比mAb04单抗显著增强,与伊马替尼药效相当,但是相比化学疗法,该双特异性抗体在恢复患者免疫系统功能上具有更大的优势,这一点对于预后非常重要。
mAb04-MICA通过抑制肿瘤新生血管和重塑免疫监视机制,突破了抗体在白血病领域的治疗效果。本文探究了其抗血管作用,对于免疫系统的恢复方面,后续还需要进行相关指标的检测,如通过检测CD11b分子的表达观测NK细胞在肿瘤组织中的浸润情况,通过检测肿瘤组织中IFN-γ和TNF-α的分泌来检测双特异性抗体对NK细胞的激活作用等。
[1] Ferrara N,Kerbel RS.Angiogenesis as a therapeutic target[J].Nature,2005,438(7070):967-974.
[2] Carmeliet P,Jain RK.Molecular mechanisms and clinical applications of angiogenesis[J].Nature,2011,473(7347):298-307.
[3] Jr RR.Vascular endothelial growth factor (VEGF) signaling in tumor progression[J].CritRevOncolHematol,2007,62(3):179-213.
[4] Musumeci F,Radi M,Brullo C,etal.Vascular endothelial growth factor (VEGF) receptors:drugs and new inhibitors[J].JMedChem,2012,55(24):10797-10822.
[5] Xu WW,Li B,Lam AK,etal.Targeting VEGFR1- and VEGFR2-expressing non-tumor cells is essential for esophageal cancer therapy[J].Oncotarget,2015,6(3):1790-1805.
[6] Fuchs CS,Tabernero J,Tomášek J,etal.Biomarker analyses in REGARD gastric/GEJ carcinoma patients treated with VEGFR2-targeted antibody ramucirumab[J].BrJCancer,2016,115(8):974-982.
[7] Fuchs CS,Tomasek J,Yong CJ,etal.Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD):an international,randomised,multicentre,placebo-controlled,phase 3 trial[J].Lancet,2014,383(9911):31-39.
[8] Saif MW,Elfiky A,Salem RR.Gastrointestinal perforation due to bevacizumab in colorectal cancer[J].AnnSurgOncol,2007,14(6):1860-1869.
[9] Kappers MH,Smedts FM,Horn T,etal.The vascular endothelial growth factor receptor inhibitor sunitinib causes a preeclampsia-like syndrome with activation of the endothelin system[J].Hypertension,2011,58(2):295-302.
[10] Cho HM,Rosenblatt JD,Tolba K,etal.Delivery of NKG2D ligand using an anti-HER2 antibody-NKG2D ligand fusion protein results in an enhanced innate and adaptive antitumor response[J].CancerRes,2010,70(24):10121-10130.
[11] Veluchamy JP,Heeren AM,Spanholtz J,etal.High-efficiency lysis of cervical cancer by allogeneic NK cells derived from umbilical cord progenitors is independent of HLA status[J].CancerImmunolImmunother,2017,66(1):51.
[12] Lopez-Soto A,Huergo-Zapico L,Acebes-Huerta A,etal.NKG2D signaling in cancer immunosurveillance[J].IntJCancer,2015,136(8):1741-1750.
[13] Isernhagen A,Malzahn D,Viktorova E,etal.The MICA-129 dimorphism affects NKG2D signaling and outcome of hematopoietic stem cell transplantation[J].EMBOMolMed,2015,7(11):1480-1502.
[14] Wu JD,Atteridge CL,Wang X,etal.Obstructing shedding of the immunostimulatory MHC class I chain-related gene B prevents tumor formation[J].ClinCancerRes,2009,15(2):632-640.
[15] Xie W,Fang L,Wang Y,etal.VEGFR2 targeted antibody fused with MICA stimulates NKG2D mediated immunosurveillance and exhibits potent anti-tumor activity against breast cancer[J].Oncotarget,2016,7(13):16445-16461.
[16] Ren X,Xie W,Wang Y,etal.VEGFR2-targeted fusion antibody improved NK cell-mediated immunosurveillance against K562 cells[J].ImmunolRes,2016,64(4):1060-1070.
[17] Zhou YJ,Dou RK,Bi ZF,etal.Promotion of apoptosis in leukemia K562 cells by natural plant-derived antimicrobial solution (PAMs)[J].JChinaPharmaUniv(中国药科大学学报),2015,46(6):712-718.
[18] Shi L,Zhang J,Wu P,etal.Discovery and identification of potential biomarkers of pediatric acute lymphoblastic leukemia[J].ProteomeSci,2009,7(1):7.
[19] Xie W,Li D,Zhang J,etal.Generation and characterization of a novel human IgG1 antibody against vascular endothelial growth factor receptor 2[J].CancerImmunolImmunother,2014,63(9):877-888.
[20] Acheampong DO,Tang M,Wang Y,etal.A novel fusion antibody exhibits antiangiogenic activity and stimulates NK cell-mediated immune surveillance through fused NKG2D ligand[J].JImmunother,2017,40(3):94-103.
[21] Wang T,Sun F,Xie W,etal.A bispecific protein rG7S-MICA recruits natural killer cells and enhances NKG2D-mediated immunosurveillance against hepatocellular carcinoma[J].CancerLett,2016,372(2):166-178.
