穿心莲内酯对糖尿病肾病小鼠的治疗作用及机制
2018-03-20李梦诗曹静桦何亚军亓翠玲王丽京
李梦诗,吴 腾,曹静桦,何亚军,亓翠玲,王丽京
(广东药科大学基础学院血管生物学研究所,广州 510006)
糖尿病是常见的内分泌疾病,在全球流行性疾病中仅次于心脑血管疾病、肿瘤、艾滋病位列第4,严重威胁着人类健康[1]。糖尿病肾病是糖尿病最常见的并发症,也是导致终末期肾病的重要因素,最终导致肾衰竭[2]。肾小球系膜细胞是肾小球的主要功能细胞,无论是在肾脏的生理功能或是病理变化中都发挥着重要作用。由肾小球系膜细胞的过度增生及细胞外基质(extracellular matrix,ECM)的过度积累所导致的肾小球硬化是糖尿病肾病的主要病理特点,通常伴有蛋白尿和肾小球滤过率下降等临床表现[3-6]。纤维粘连蛋白(fibronectin,FN)是ECM的主要成分,是评价ECM累积的重要指标[7]。有研究报道糖尿病患者机体内氧化应激水平有升高的趋势,可以在糖尿病肾病患者肾脏中检测到活性氧化物质(reactive oxygen species,ROS)增高。有研究提示,在糖尿病动物模型中,通过抑制肾脏ROS水平可有效改善肾小球和肾小管的病理性改变[8]。亦有研究表明,NAPDH氧化酶4(NOX-4)是肾脏细胞ROS产生的主要途径之一[9-13]。
穿心莲属爵床科穿心莲属植物,其主要有效成分为穿心莲内酯(andrographolide,Andro),是一种二环双萜内酯类化合物。中医认为穿心莲属于寒性药物,有消热排毒的疗效。近年研究表明Andro具有抗炎的作用,并对动脉粥样硬化、高血压及肿瘤有一定疗效及抑制作用[14-16]。此外。Andro还被发现能够在1型糖尿病中发挥保护胰岛β细胞的功能及减缓NOD小鼠自发免疫性糖尿病的病理进程[17-18]。另外,也有研究证实Andro能通过减少细胞ROS产生,从而在体内/体外达到治疗与氧化应激相关疾病的目的[19-21]。目前,Andro对糖尿病肾病的作用尚未见报道,本研究利用自发糖尿病转基因Leprdb/db小鼠,研究Andro对Leprdb/db小鼠糖尿病肾病的作用及其机制。
1 材 料
1.1 试 剂
穿心莲内酯粉末(美国Sigma公司)溶解于DMSO中,配成质量浓度为200 mg/mL的溶液,使用时蒸馏水稀释1000倍;24 h尿蛋白检测试剂盒、肌酐检测试剂盒和尿素氮检测试剂盒(南京建成生物工程研究所);苏木精染液、小鼠及兔二抗、DAB显色试剂(北京中杉金桥生物有限公司);BSA[生工生物工程(上海)股份有限公司],4%多聚甲醛溶液(博士德生物工程有限公司)。
1.2 仪 器
PR-MBJ-1全自动生物组织包埋机(PR公司);石蜡切片机(德国Leica公司);独立送回风净化笼具IVC与小鼠代谢笼(苏杭科技器材有限公司);倒置显微镜(日本Olympus公司);冷冻高速离心机(德国Eppendorf公司);酶标仪(美国Bio Tek公司)。
1.3 动 物
转基因小鼠Leprdb/db小鼠购自南京大学模式动物研究所(Jackson实验室货号000642),C57BL/6小鼠购自广东省动物中心,许可证号:SCXK(粤)2013-0002。小鼠自购买后均饲养于SPF级实验动物环境中,光照时间为12 h/12 h昼夜交替。所有动物实验均符合动物伦理委员会标准。
2 方 法
2.1 小鼠分组及给药
选用18周龄体重在42~48 g的雄性Leprdb/db小鼠,剪指做好标记,将小鼠随机分为两组,一组每两天腹腔注射1 μg/g Andro至26周[7],另一组则注射DMSO溶解的相同体积的生理盐水至26周,另外,选用同样周龄的体重在28~32 g雄性C57BL/6小鼠作为阴性对照组。每组各7只。
2.2 肌酐、尿素氮,尿蛋白含量的测定
治疗8周后,将小鼠置于代谢笼中24 h,从收集尿液的瓶子中取出尿样,进行尿蛋白和尿素氮的检测。将小鼠眼眶取血,4 000 r/min离心取上清液,检测血清中的肌酐水平。
用AU800全自动生化分析仪检测血肌酐、尿素氮。其中血肌酐采用苦味酸法,尿素氮采用脲酶法。
24 h尿蛋白定量:采用考马斯亮蓝法检测实验小鼠24 h尿蛋白含量。
2.3 苏木精-伊红(HE)染色
石蜡切片梯度脱蜡,水化,苏木精染色1分30秒,流水返蓝1 h,伊红染色15秒,流水冲洗3遍,脱水透明,中性树脂封片。
2.4 过碘酸-希夫(PAS)染色
石蜡切片梯度脱蜡至水,蒸馏水洗1~2 min,过碘酸溶液氧化10 min,流水洗10 min,希夫(Schiff)试剂染色10 min,流水洗5 min,苏木精染核2 min,流水冲洗10 min,常规脱水、透明、封片。
2.5 免疫组化
石蜡切片脱蜡后,用PBS洗3次,每次5 min。高压修复5 min。PBS洗后,用3%过氧化氢-甲醇37 ℃孵育30 min。PBS洗3次,每次5 min,10%BSA封闭。一抗(1%BSA稀释1∶100)4 ℃冰箱孵育过夜。第2天,复温后,PBS洗,37 ℃烘箱孵育相应二抗(1%BSA稀释1∶100)40 min。DAB显色,苏木精染核后,脱水、透明、封片。
PAS染色及免疫组化染色,由Image-Pro Plus统计积分光密度(integrated optical density,IOD)。
2.6 统计学处理
采用GraphPad Prism 5.0软件对数据进行单因素方差分析,以P<0.05为差异有统计学意义。
3 结 果
3.1 Andro对Leprdb/db小鼠的24 h尿蛋白、血肌酐和血尿素氮水平的影响
用Andro治疗Leprdb/db小鼠,随机分为两组,一组每2天腹腔注射1 μg/g Andro至26周,另一组则注射相同体积DMSO溶解的的生理盐水。治疗后发现Andro治疗组的24 h尿蛋白(P<0.001)、血肌酐(P<0.05)和血尿素氮(P<0.01)水平比对照组明显降低(图1)。
3.2 Andro对Leprdb/db小鼠肾小球病理性变化的影响
治疗结束后取材,石蜡包埋,切片HE染色。结果发现:Andro实验组与对照组相比,治疗组肾小囊结构恢复正常,肾小球细胞的细胞核排列规则,提示Andro能显著改善Leprdb/db小鼠肾小球系膜的扩张(图2-A)。
此外,为检测小鼠肾脏中的还原糖水平,对这3种小鼠的切片进行PAS染色(图2-B)。发现Andro 治疗后,Leprdb/db小鼠肾脏着色比对照组明显减轻(P<0.05),与正常C57BL/6小鼠水平相近,表明Andro可以减轻肾脏还原糖累积。因此,Andro 能够改善Leprdb/db小鼠在形态学上的肾损伤,同时也能减轻Leprdb/db小鼠整个肾脏的还原糖水平(图2-B、2-C)。
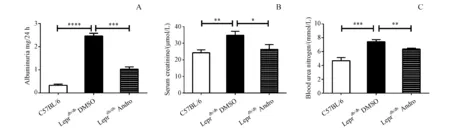

A:Albuminuria levels;B:Serum creatinine;C:Blood urea nitrogen levels
*P<0.05,*P<0.01,***P<0.001,****P<0.000 1
Figure2 Andrographolide ameliorates glomerular pathological changes in Leprdb/dbmice
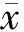
3.3 Andro对Leprdb/db小鼠肾脏中FN表达的影响
FN是ECM的主要成分,ECM的累积与糖尿病肾病的发展密切相关。本研究用免疫组化进行FN染色(图3),发现DMSO组Leprdb/db小鼠肾FN的水平明显高于正常对照组小鼠(P<0.000 1),而Andro治疗减少Leprdb/db小鼠肾脏中FN表达水平(P<0.001)。上述结果证明Andro可以通过减少Leprdb/db小鼠肾脏中FN的积累进而改善糖尿病肾病。
Figure3 Effect of Andro on fibronectin (FN) expression in Leprdb/dbmice kidney

3.4 Andro对Leprdb/db小鼠肾小球NOX-4水平的影响
相比C57BL/6小鼠,NOX-4在Leprdb/db小鼠肾小球系膜中的大量表达,Andro治疗减少了小鼠肾脏中NOX-4的表达水平(P<0.01)。上述结果提示,Andro可能是通过减少Leprdb/db小鼠细胞NOX-4的表达水平,进而改善糖尿病肾病中的氧化应激状态,从而改善糖尿病肾病。
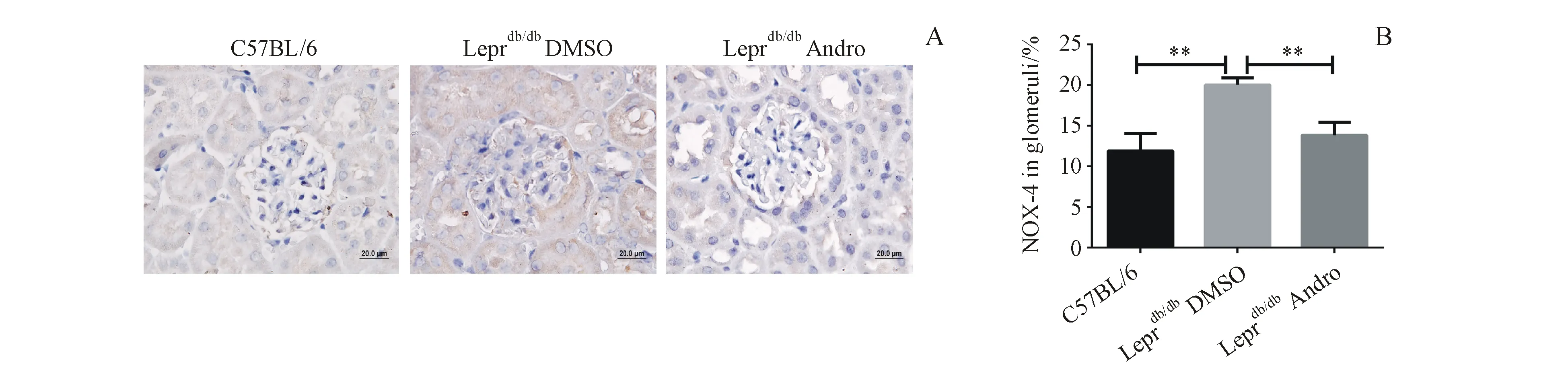
Figure4 Effect of Andro on NOX-4 expression in Leprdb/dbmice kidney

4 讨 论
糖尿病肾病是糖尿病最常见的并发症之一,在我国的发病率亦呈上升趋势。20%~40%的糖尿病患者会并发糖尿病肾病,严重影响了患者的生活质量。糖尿病肾病的发病机制尚未明确,可以通过测量血尿素氮、血清肌酐、肌酐清除率和蛋白尿来诊断糖尿病肾病[22]。目前,糖尿病肾病临床常用药一般分为降糖类药物和非降糖类药物。常用的治疗糖尿病肾病的中成药有肾康注射液、黄芪注射液等[23]。黄芪注射液可以降低肾脏蛋白的排泄,具有保护肾脏的功能[24]。
Andro具有抗炎、抗肿瘤及治疗动脉粥样硬化等的作用,近年来,研究发现Andro能够改善自发免疫性糖尿病NOD小鼠的糖尿病病理进程[17-18]。Lan等[25]也报道Andro可以显著降低高糖诱导MCs细胞增殖和FN的表达,但是Andro对自发糖尿病Leprdb/db小鼠糖尿病肾病的作用尚未见研究。Leprdb/db小鼠是由美国Jackson实验室于1966年在C57BLKS/J(BKS)近交系中发现糖尿病突变基因(db),是位于小鼠4号染色体的瘦素受体(leptin receptor)基因发生突变所致[26]。因其多饮、多食、多尿、肥胖、高血糖、高胰岛素血症等症状与人类2型糖尿病患者的临床症状相似,因此被广泛应用于糖尿病及其并发症等疾病的研究中。
本研究利用Leprdb/db小鼠研究了Andro对糖尿病肾病的作用。发现Andro可以显著降低Leprdb/db小鼠24 h尿蛋白、尿肌酐和血尿素氮的水平,显著改善了Leprdb/db小鼠肾脏代谢相关的生化指标代谢水平。另外,本研究通过观察Leprdb/db小鼠肾脏组织形态,发现Andro治疗对Leprdb/db小鼠的肾小球病理性改变有明显的改善作用,并且可以减少其肾脏的还原糖水平和ECM的累积。近年来,越来越多的研究表明,氧化应激在糖尿病肾病的发展进程中发挥着不可忽视的作用[27]。为此,本研究进一步研究发现Andro可能通过降低Leprdb/db小鼠肾脏中NOX-4表达水平以抑制肾脏细胞的氧化应激状态,进而缓解了Leprdb/db小鼠糖尿病肾病的病情。然而,Andro对Leprdb/db小鼠糖尿病肾病的具体分子机制尚需进一步研究。
[1] Danaei G,Finucane MM,Lu Y,etal.National,regional,and global trends in fasting plasma glucose and diabetes prevalence since 1980:systematic analysis of health examination surveys and epidemiological studies with 370 country-years and 2.7 million participants[J].Lancet,2011,378(9785):31-40.
[2] Sun H,Yuan Y,Sun ZL.Cholesterol contributes to diabetic nephropathy through SCAP-SREBP-2 Pathway[J].IntJEndocrinol,2013,2013:592576.
[3] Forbes JM,Fukami K,Cooper ME.Diabetic nephropathy:where hemodynamics meets metabolism[J].ExpClinEndocrinolDiabetes,2007,115(2):69-84.
[4] Jerums G,Panagiotopoulos S,Premaratne E,etal.Integrating albuminuria and GFR in the assessment of diabetic nephropathy[J].NatRevNephrol,2009,5(7):397-406.
[5] Tramonti G,Kanwar YS.Review and discussion of tubular biomarkers in the diagnosis and management of diabetic nephropathy[J].Endocrine,2013,43(3):494-503.
[6] Zhang,XF,Tan BK.Anti-diabetic property of ethanolic extract of Andrographis paniculata in streptozotocin-diabetic rats[J].ActaPharmacolSin,2000,21(12):1157-1164.
[7] Menini S,Amadio L,Oddi G,etal.Deletion of p66Shc longevity gene protects against experimental diabetic glomerulopathy by preventing diabetes-induced oxidative stress[J].Diabetes,2006,55(6):1642-1650.
[8] Ji X,Li C,Ou Y,etal.Andrographolide ameliorates diabetic nephropathy by attenuating hyperglycemiamediated renal oxidative stress and inflammation via Akt/NF-κB pathway[J].MolCellEndocrinol,2016,437:268-279.
[9] Baynes JW.Role of oxidative stress in development of complications in diabetes[J].Diabetes,1991,40(4):405-412.
[10] Giacco F,Brownlee M.Oxidative stress and diabetic complications[J].CircRes,2010,107(9):1058-1070.
[11] Schnackenberg CG.Oxygen radicals in cardiovascular-renal disease[J].CurrOpinPharmacol,2002,2(2):121-125.
[12] Gorin Y,Block K,Hernandez J,etal.Nox4 NAD(P)H oxidase mediates hypertrophy and fibronectin expression in the diabetic kidney[J].JBiolChem,2005,280(47):39616-39626.
[13] Fujii M,Inoguchi T,Maeda Y,etal.Pitavastatin ameliorates albuminuria and renal mesangial expansion by downregulating NOX4 in db/db mice[J].KidneyInt,2007,72(4):473-480.
[14] Sheeja K,Guruvayoorappan C,Kuttan G.Antiangiogenic activity of andrographis paniculata extract and andrographolide[J].IntImmunopharmacol,2007,7(2):211-221.
[15] Sinha J,Mukhopadhyay S,Das N,etal.Targeting of liposomal andrographolide to L.donovani-infected macrophagesinvivo[J].DrugDeliv,2000,7( 4) :209-213.
[16] Jada SR,Hamzah AS,Lajis NH,etal.Semisynthesis and cytotoxic activities of andrographolide analogues[J].JEnzymeInhibMedChem,2006,21(2):145-155.
[17] Zhang Z,Jiang J,Yu P,etal.Hypoglycemic and beta cell protective effects of Andrographolide analogue for diabetes treatment[J].JTranslMed,2009,7:62.
[18] Zhang C,Gui L,Xu Y,etal.Preventive effects of Andrographolide on the development of diabetes in autoimmune diabetic NOD mice by inducing immune tolerance[J].IntImmunopharmacol,2013,16(4):451-456.
[19] Yan GR,Zhou HH,Wang Y,etal.Protective effects of Andrographolide analogue AL-1 on ROS-induced RIN-mbeta cell death by inducing ROS generation[J].PLoSOne,2013,8(6):e63656.
[20] Dey SK,Bose D,Hazra A,etal.Cytotoxic activity and apoptosis-inducing potential of di-spiropyrrolidino and di-spiropyrrolizidino oxindole Andrographolide derivatives[J].PLoSOne,2013,8(3):e58055.
[21] Zhu YY,Yu G,Zhang Y,etal.A novel Andrographolide derivative AL-1 exerts its cytotoxicity on K562 cells through a ROS-dependent mechanism[J].Proteomics,2013,13(1):169-178.
[22] Kaur M,Bedi O,Sachdeva S,etal.Rodent animal models:from mild to advanced stages of diabetic nephropathy[J].Inflammopharmacology,2014,22(5):279-293.
[23] Fang WH.Drug treatment of diabetic nephropathy[J].AnhuiMedPharmJ(安徽医药),2009,13(2):215-217.
[24] Cheng SH,Hou FY,Zhang LJ.Investigation on curative effect of astragalus injection on ddiabetic nephrosis[J].ChinTraditPatMed(中成药),2000,22(3):207-209.
[25] Lan T,Wu T,Gou H,etal.Andrographolide suppresses high glucose-induced fibronectin expression in mesangial cells via inhibiting the AP-1 pathway[J].JCellBiochem,2013,114(11):2562-2568.
[26] Hummel KP,Dickie MM,Coleman DL.Diabetes,a new mutation in the mouse[J].Science,1966,153(3740):1127-1128.
[27] Brezniceanu ML,Liu F,Wei CC,etal.Attenuation of interstitial fibrosis and tubular apoptosis in db/db transgenic mice overexpressing catalase in renal proximal tubular cells[J].Diabetes, 2008,57(2):451-459.
