SET8基因下调对大鼠血管平滑肌细胞增殖迁移的影响及其机制
2018-03-19张东雪胡春燕梁向楠高少辉
张东雪,胡春燕,梁向楠,高少辉
(河北医科大学第四医院,石家庄 050011)
动脉粥样硬化是导致心血管疾病发生和患者死亡的关键因素[1]血管内膜增生是动脉粥样硬化等血管疾病发生的关键环节[2],而血管平滑肌细胞(VSMCs)的增殖、迁移是血管内膜增生的直接原因[3]。因此,抑制VSMCs增殖、迁移是减少心血管疾病发生的关键环节。金属基质蛋白酶(MMP)2和MMP9可降解细胞外基质,参与了VSMCs的增殖与迁移等过程[4]。E钙黏附蛋白(E-Cadherin)可维持上皮细胞的完整性,与细胞的侵袭、转移和分化密切相关[5]。SET8是现今发现惟一能够特异性单甲基化组蛋白H4赖氨酸20位(H4K20)的赖氨酸甲基转移酶,具有调控细胞增殖、迁移与分化的作用[6]。但是,目前SET8对VSMCs增殖、迁移的作用尚不明确。2017年6~12月,我们拟通过大鼠胸主动脉VSMCs来观察SET8基因下调对大鼠VSMCs增殖、迁移能力的影响,为心血管疾病提供可能的治疗靶点。
1 材料与方法
1.1实验动物、试剂及仪器选取河北医科大学动物实验中心的健康雄性SD大鼠6只,均为4周龄,体质量80~120 g,合格证号:1305090。实验试剂:DMEM培养基(美国Gibco公司);SET8-短发夹RNA(SET8-shRNA)质粒(广州复能基因有限公司),PCR引物(上海捷瑞生物工程有限公司),实时荧光定量PCR试剂盒(日本TaKaRa公司);SET8抗体(英国Abcam公司),GAPDH抗体(美国Bioworld公司),兔二抗和鼠二抗(美国KPL公司);脂质体LipofectamineTM2000(美国Invitrogen公司),Transwell小室(美国Corning公司);四甲基偶氮唑蓝(MTT)粉(美国Sigma公司),ECL显色剂(美国Thermo Fisher公司);蛋白提取试剂盒(普利莱),RNA提取试剂盒(美国Thermo Fisher公司)。实验仪器:实时荧光定量PCR仪(美国life公司),酶标仪(美国Biotek公司),倒置相差显微镜(日本OLYMPUS公司)。
1.2VSMCs的制备与分组选取SD大鼠,在生物安全柜中取出胸主动脉,去除其外膜及内膜,剩下中间层的VSMCs,将血管剪碎,每块组织约1 cm×1 cm。将组织块均匀地贴到培养瓶壁上,采用组织块贴壁法培养原代大鼠VSMCs,2 h后翻瓶,在二氧化碳培养箱中继续培养,传代培养至第3代。将细胞接种于适宜孔板中,细胞融合率达80%时给予转染干预。将VSMCs随机分为正常对照组、空质粒组、SET8-shRNA组,正常对照组为正常VSMCs,空质粒组转染2 μg/L NS-shRNA,SET8-shRNA组转染2 μg/L SET8-shRNA。
1.3各组VSMCs SET8 mRNA检测采用实时荧光定量PCR。PCR引物由Primer 5.0软件设计,各组转染48 h后,以cDNA为模板,加入SET8的上游、下游引物,GAPDH作为内参照。采用SYBR®Green方法,应用实时荧光定量PCR仪进行检测,以GAPDH为内参,以2-ΔΔCt表示目的基因相对表达量。体系为20 μL反应条件为95 ℃预变性5 min,95 ℃变性10 min,60 ℃退火,延伸30 s,40个循环,并设置溶解曲线,将信号采集设置在退火延伸阶段,采集图像进行分析。实验重复3次。
1.4各组VSMCs SET8蛋白检测采用Western blotting法。各组转染48 h后,应用普利莱试剂盒提取蛋白质,并用BCA法测定蛋白浓度;蛋白上样量为50 μg,采用10%的SDS-聚丙烯酰胺凝胶电泳进行分离;转膜、5%牛奶封闭1 h,加入一抗稀释液(GAPDH 1∶ 10 000,SET8 1∶ 500),4 ℃孵育过夜。次日,洗膜,放入二抗稀释液(1∶ 10 000),37 ℃环境下孵育1 h。ECL显色并进行图像采集和分析,实验重复3次。
1.5各组VSMCs增殖能力观察采用MTT法。取第3代VSMCs以适当浓度接种于96孔板中,当细胞生长至融合率达60%~70%时进行转染,细胞分组及处理方法同1.2,放入培养箱继续培养。每组设3个复孔。分别在转染后第0、12、24、36、48 h进行检测。检测前4 h各孔中加入5 mg/mL的MTT溶液20 μL,继续培养4 h;取板弃去培养液,各孔中加入150 μL二甲基亚砜并充分震荡;酶标仪490 nm波长处检测OD值,记录结果。实验重复3次。
1.6各组VSMCs迁移能力观察采用Transwell实验。取第3代VSMCs,以适当浓度接种于6孔板中;当细胞生长至融合率达60%~70%时进行转染,细胞分组及处理方法同1.2。细胞转染24 h后,将基质胶与冷的无牛清DMEM培养基以1∶ 8混合;每孔加入50 μL混合液,于37 ℃培养箱孵育5 h。待基质胶变成白色凝固层,吸去多余培养基。以胰酶消化细胞,收集3组细胞;用无牛清的DMEM培养基重悬细胞,调整细胞密度为1×106/mL。上室加入100 μL细胞悬液,下室加入500 μL的完全培养基。放入培养箱中继续培养24 h后,甲醇固定,结晶紫染色,显微镜下照相并计数迁移至下室的细胞数。实验重复3次。
1.7各组VSMCs MMP2、MMP9、E-Cadherin mRNA检测检测方法同1.3。
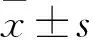
2 结果
2.1各组VSMCs SET8表达比较正常对照组、空质粒组、SET8-shRNA组SET8 mRNA相对表达量分别为1.00±0.00、0.83±0.03、0.48±0.04,SET8蛋白相对表达量分别为0.99±0.20、0.81±0.06、0.68±0.02,SET8-shRNA组与正常对照组、空质粒组相比P均<0.05。
2.2各组VSMCs增殖能力比较转染后第0、12、24、36、48 h,正常对照组VSMCs的OD值分别为0.36±0.01、0.78±0.08、0.99±0.03、1.21±0.03、1.31±0.03,空质粒组分别为0.36±0.01、0.73±0.06、0.97±0.03、1.12±0.21、1.25±0.06,SET8-shRNA组分别为0.34±0.01、0.49±0.08、0.63±0.09、0.80±0.01、0.88±0.05,SET8-shRNA组与正常对照组和空质粒组第12、24、36、48 h时相比,P均<0.05。
2.3各组VSMCs迁移能力比较正常对照组、空质粒组、SET8-shRNA组VSMCs迁移细胞数分别为(180.67±13.05)、(171.33±15.95)、(55.00±12.29)个,SET8-shRNA组与正常对照组、空质粒组相比P均<0.05。
2.4各组VSMCs MMP2、MMP9、E-Cadherin mRNA表达比较正常对照组、空质粒组、SET8-shRNA组的MMP2 mRNA相对表达量分别为1.00±0.00、1.03±0.11、0.71±0.15,MMP9 mRNA相对表达量分别为1.00±0.00、1.05±0.20、0.52±0.12,E-Cadherin mRNA相对表达量分别为1.00±0.00、0.89±0.20、1.65±0.23,SET8-shRNA组与正常对照组、空质粒组相比P均<0.05。
3 讨论
动脉粥样硬化与心血管事件的发生密切相关[7,8]。而导致动脉粥样硬化的重要因素之一是VSMCs的增殖和迁移[9]。正常VSMCs具有增殖性弱、迁移性弱的特征,主要起收缩作用,并用来维持血管的正常形态[10]。研究[11,12]发现,在受到病理刺激时VSMCs可去分化为高增殖、高迁移特性的分泌型细胞,并向内膜下间隙迁移,导致内膜增生,进而导致血管动脉粥样硬化。因此,抑制VSMC过度增殖与迁移是减少动脉粥样硬化斑块形成的关键。
Linscott等[13]研究发现,赖氨酸甲基转移酶SET8可影响染色体结构,并且还能招募特异的调节蛋白,在细胞内具有调控组蛋白修饰、调节染色质结构和基因转录、调控细胞周期等作用,因此SET8参与细胞增殖、转移、分化等多种细胞生理功能。研究[14,15]表明,干扰SET8基因表达可有效抑制肿瘤细胞的增殖和迁移能力。本研究MTT和Transwell实验结果表明,与正常对照组、空质粒组相比,SET8-shRNA组VSMCs的增殖、迁移能力明显降低,提示干扰SET8基因表达能够抑制VSMCs的增殖与迁移能力。
Lai等[16]研究发现,MMP2主要作用是降解Ⅳ型胶原和明胶,使细胞能够突破基底膜屏障,在侵袭转移中起着重要作用;MMP9能够降解明胶、Ⅳ型和Ⅴ型胶原,促进细胞的侵袭和迁移。E-Cadherin是维持上皮细胞结构极性和完整性的糖蛋白,对于维持细胞与细胞间的黏附能力非常重要,与细胞的侵袭、转移和分化密切相关[17]。Yang等[18]研究发现,SET8作为表观修饰因子可以与TWIST在体内相互作用,能够催化H4K20单甲基化进而调控TWIST靶基因MMP2、MMP9和E-Cadherin的转录,介导靶基因的表达,进而参与调控细胞的增殖、迁移。本实验结果显示,与正常对照组、空质粒组相比,SET8-shRNA组VSMCs MMP2、MMP9 mRNA表达降低,E-Cadherin mRNA表达升高。这表明SET8表达降低后,催化H4K20单甲基化作用减弱,从而抑制了靶基因MMP2和MMP9的表达,使胶原蛋白及胶原成分降解作用减弱,细胞不易突破基底膜屏障;同时促进E-Cadherin的表达,使细胞间黏附能力增强,从而抑制了VSMCs的增殖与迁移。
综上所述,SET8基因下调后大鼠VSMCs的增殖与迁移能力降低;这可能与下调MMP2、MMP9表达,上调E-Cadherin表达有关。本研究仅在细胞实验中观察到了干扰SET8能抑制VSMCs细胞的增殖与迁移,其具体是通过何种机制来影响MMP2、MMP9及E-Cadherin表达进而影响VSMCs的增殖与迁移能力仍需进一步验证,从而为预防和治疗动脉粥样硬化提供依据。
