蒜氨酸在家兔体内药代动力学研究*
2018-03-17李明强韩志俊李恒梅宋姗姗遵义医学院微生物学与免疫学实验室临床医学系贵州遵义563003
李明强,胡 铭,韩志俊,李恒梅,宋姗姗(遵义医学院:.微生物学与免疫学实验室,.临床医学系,贵州遵义563003)
蒜氨酸为大蒜素前体物质存在于大蒜中,为水溶性的氨基酸类化合物,化学性质稳定,在蒜酶的作用下分解成大蒜素。由于大蒜素脂溶性和刺激性,在制剂制备过程中必须使用脂溶剂、增溶剂,对机体造成毒性反应,导致大蒜素临床制剂(大蒜素注射液)至今未得到广泛应用。但是大蒜素高效、广泛的生物学效应吸引学者对其进行更加深入的研究,希望能得到更好的大蒜素制剂,使其更好地应用于临床[1]。近年来,体外实验研究发现,大蒜素与蒜氨酸都具有抗微生物、抗肿瘤、抗氧化、免疫调节及防治心血管病作用[2⁃5],也逐渐成为人们对大蒜生物活性成分的研究热点。对蒜氨酸制剂的研究多局限于将蒜氨酸与蒜酶共同使用,在消化道蒜酶分解蒜氨酸为大蒜素,吸收大蒜素发挥药效作用[6],但鲜见蒜氨酸制剂研究,以及蒜氨酸在家兔体内的药代动力学研究报道。本文就蒜氨酸在家兔体内的血药浓度变化、分布及在体内代谢物情况进行研究,以期为蒜氨酸的应用研究提供理论依据。
1 材料与方法
1.1 一般材料 (1)动物:健康家兔20只,由本单位动物实验中心提供。(2)试剂:蒜氨酸为本实验室制备,10%钨酸钠(10 g钨酸钠加蒸馏水100 mL溶解),0.333 mol/L硫酸溶液(蒸馏水290 mL加入98%浓硫酸10 mL,逐滴缓慢加入),三氯醋酸,正己烷,盐酸,甲醇。(3)标准品蒜:氨酸标准品,含量98%,国家指定标准物质,由上海源叶生物科技有限公司生产,产品编号:YY91270;大蒜素标准品,含量98%,国家指定标准物质,由上海源叶生物科技有限公司生产,产品编号:PCS0325。实验用蒜氨酸由本实验室提取。(4)仪器:设备离心机、组织匀浆机、安捷伦1200型液相色谱分析仪、高速台式离心机、旋涡混合器。
1.2 方法 取健康家兔20只,称体重,检查健康状况,给药前24h禁止喂食蒜、葱类植物,分为两组,每组10只。组1用100 mg/L蒜氨酸溶液,按100 mg/kg剂量耳缘静脉注射给药,注射给药后 10、30 min,1、3、6、12 h 自兔子耳静脉采血约2 mL,并立即进行标本处理。组2在完成组1实验后,按100 mg/kg剂量给予组2家兔耳缘静脉注射100 mg/L的蒜氨酸溶液,根据组1大蒜素检测结果,在血药浓度高峰期时,经心脏采血致家兔死亡,分别取肝、肾、肺、脑组织匀浆,按1.2.1和1.2.2检测蒜氨酸和大蒜素含量。
1.2.1 蒜氨酸检测 标本处理在无大分子两性电离物质蛋白质存在的条件下,参照文献[7]分离沉淀蒜氨酸,再用标本体积蒸馏水溶解蒜氨酸进行色谱分析。采用钨酸蛋白沉淀法制备无蛋白滤液:取蒸馏水5 mL,吸取抗凝血1 mL,擦去吸管壁外血液,缓缓将血液放入蒸馏水,将吸管提高,吸取上清液反复冲洗吸管3次。充分混合,使红细胞完全溶解;加入0.333 mol/L硫酸溶液1 mL,充分混匀,此时血液由鲜红变成棕色,静置5~10 min,使其酸化完全;加入10%钨酸钠1 mL,边加边摇,放置约5 min后,如振摇也不再出现泡沫,说明蛋白质已完全变性沉淀;以2 500 r/min离心10 min,即得完全澄清无色之无蛋白血滤液。吸出透明液体,用1 mol/L氢氧化钠溶液0.3 mL调节无蛋白滤液的pH至3.0,析出蒜氨酸,再以4 000 r/min离心20 min,沉淀用1 mL三蒸水溶解,微孔滤膜过滤,进行色谱分析。
色谱分析参照文献[7]色谱条件:Eclipse XDB⁃C18(150.0 mm×4.6 mm,5µm)色谱柱;流动相为水∶乙腈(85∶15);流速为 0.5 mL/min;柱温为 25℃;进样 20µL,紫外检测波长为210 nm。标准曲线的制备:分别称取蒜氨酸24.300 mg,加入1 mL蒸馏水,为24.300 mg/mL蒜氨酸溶液标准液,再用蒸馏水稀释成24.300 00、12.150 00、1.215 00、0.121 50、0.012 15 mg/mL 蒜氨酸溶液。取上述浓度的蒜氨酸溶液0.1 mL分别置于加入0.9 mL兔血液标本中,再按血液标本处理,进行液相色谱分析,进样20µL,记录色谱图及峰面积。以蒜氨酸的浓度X(µg/mL)为纵坐标,峰面积积分值Y为横坐标,绘制标准曲线。
1.2.2 大蒜素检测 标本处理:参照文献[8]血样品预处理,取0.7 mL血浆加入10%三氯醋酸溶液0.2 mL,振荡1 min,精密加入正己烷1 mL,涡旋3 min提取药物,以4 000 r/min离心15 min,取上清液,0.45µm微孔率膜过滤,进行液相色谱分析,进样20µL。
色谱分析参照文献[9]色谱条件:Eclipse XDB⁃C18(150.0 mm×4.6 mm,5µm)色谱柱;流动相为乙腈∶水=85∶15,流速为 0.5 mL/min;柱温为 20℃;进样 20µL,紫外检测波长为220 nm。
标准曲线制备:取20 mg/mL大蒜素0.5 mL与0.5 mL二甲基亚砜,溶解为10 mg/mL大蒜素溶液,再用蒸馏水稀释为 1.00、0.10、0.01 mg/mL。分别取 20.00、10.00、1.00、0.10、0.01 mg/mL 大蒜素溶液,取 0.1 mL 各浓度溶液分别置于加入0.9 mL兔血浆标本中,混匀静止10 min,取此血浆0.7 mL,按上法预处理,进行色谱分析。以峰面积(A)为横坐标,大蒜素浓度(C)为纵坐标,回归得到大蒜素在血浆中的标准曲线。
1.3 统计学处理 应用SPSS18.0统计软件进行数据分析,计量资料以±s表示,采用t检验,检验水准α=0.05。P<0.05为差异有统计学意义。
2 结 果
2.1 蒜氨酸检测 蒜氨酸浓度与其峰面积均呈良好的线性关系,R2=0.999 9,见图1。

图1 蒜氨酸浓度⁃峰面积制备标准曲线
2.2 大蒜素检测 大蒜素浓度与其峰面积具良好线性关系,R2=0.997 3,见图 2。

图2 大蒜素浓度⁃峰面积制备标准曲线
2.3 蒜氨酸血药浓度随时间的变化过程 变化过程符合二房室一级动力学过程,见图3。主要的药动学参数:曲线下面积(AUC)为 16 964.0(mg·min)/L,K12为0.002 92,K21为 0.003 6,半衰期(t1/2(12))为 237.3 min,t1/2(21)为 192.5 min,表观分布容积(Vd)为 4.912 L,清除率(Cl)为0.0 177 mg/(L∙min)。

图3 蒜氨酸血药浓度⁃时间变化曲线
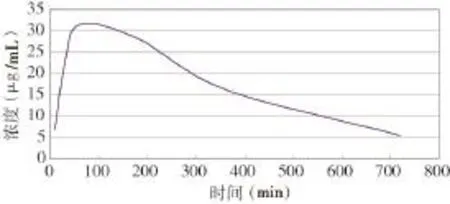
图4 大蒜素血药浓度⁃时间变化曲线
2.4 大蒜素血药浓度的变化过程 变化过程为二房室一级动力学过程见图4,主要药物动力学参数:AUC为12 583.1(mg·min)/L,Ka为 0.030 50,K12为 0.003 05,K21为 0.002 66,t1/2(12)为 227.2 min,t1/2(21)为 260.53 min,Vd为4.51 L,Cl为0.012 mg/(L∙min)。
2.5 家兔血液与器官组织中蒜氨酸和大蒜素浓度比较 注射蒜氨酸、大蒜素溶液1 h后经心脏采血致家兔死亡,血液、肝、肾、肺、脑组织中蒜氨酸与大蒜素结果见表1。肝脏中的蒜氨酸、大蒜素浓度均高于血液,差异均有统计学意义(P<0.01);肺组织中大蒜素浓度明显低于血液,差异均有统计学意义(P<0.01),其中蒜氨酸浓度与血液比较,差异无统计学意义(P>0.05);肾、大脑组织中蒜氨酸、大蒜素浓度与血液比较,差异无统计学意义(P>0.05)。
表1 家兔血液与器官组织中蒜氨酸、大蒜素浓度比较(±s,µg/mL)
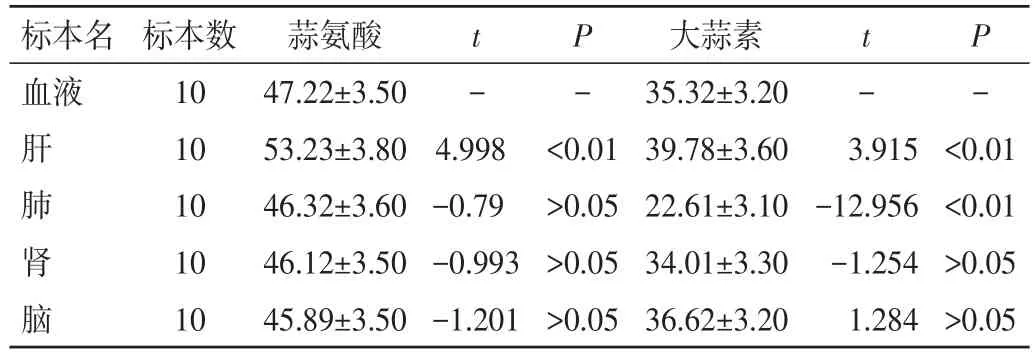
表1 家兔血液与器官组织中蒜氨酸、大蒜素浓度比较(±s,µg/mL)
注:-表示无此项
标本名血液t -P-t -P-肝肺肾脑<0.01<0.01>0.05>0.05标本数10 10 10 10 10蒜氨酸47.22±3.50 53.23±3.80 46.32±3.60 46.12±3.50 45.89±3.50 4.998-0.79-0.993-1.201<0.01>0.05>0.05>0.05大蒜素35.32±3.20 39.78±3.60 22.61±3.10 34.01±3.30 36.62±3.20 3.915-12.956-1.254 1.284
3 讨 论
血液蒜氨酸检测,标本处理根据血液生化检验无蛋白滤液制备与文献[7]蒜氨酸等电点相结合分离蒜氨酸,根据蒜氨酸紫外吸收光谱进行色谱分析,得到蒜氨酸浓度⁃时间曲线为二房室一级动力学过程,与文献[10]报道相符。文献[10]报道的是小鼠灌胃给药,具有吸收分布曲线,而本文采用静脉注射给药,无吸收分布曲线。大蒜素为脂溶性物质,标本中大蒜素的分离参照文献[8]采用有机溶剂正己烷萃取,微孔滤膜过滤,参照文献[9]根据大蒜素紫外吸收光谱进行色谱分析,结果大蒜素血药浓度⁃时间变化曲线为二房室一级动力学过程,与文献[8]报道相符。文献[8]报道的乙二醇单甲醚磷脂酰乙醇胺衍生物(PEG⁃PE)修饰的大蒜素长循环脂质体(PEG⁃DATS⁃LCL)延缓了大蒜素在体内的释放,显著延长了大蒜素半衰期,而大蒜素注射液的大蒜素血药浓度⁃时间变化曲线与本研究报道基本一致。
蒜氨酸为大蒜主要氨基酸成分,在蒜酶的作用下分解为大蒜素。有研究表明,蒜氨酸在不同温度条件下蒜氨酸热分解产物为二烯丙基二硫醚、二烯丙基三硫醚、二烯丙基四硫醚等大蒜素成分,但并不影响抗氧化活性[11⁃13]。本研究结果显示,蒜氨酸进入机体后,在血液中检测有大蒜素存在,说明蒜氨酸进入机体内,在代谢酶的作用下,分解生成大蒜素,并发挥蒜氨酸和大蒜素双重药物的药理作用。表明蒜氨酸在蒜酶、代谢酶和高温裂解作用下产物均为大蒜素。在代谢过程中,蒜氨酸分解代谢,生成大蒜素。本研究中蒜氨酸 AUC 为 16 964.0(mg·min)/L,高于大蒜素的12 583.1(mg·min)/L。蒜氨酸与大蒜素的 Vd 均大于 3,二者均为体液分布。
本研究结果显示,蒜氨酸血药浓度较高时,代谢较快,血药浓度快速下降,大蒜素血药浓度快速升高,当大蒜素浓度接近蒜氨酸浓度后,蒜氨酸代谢速度减慢,保持蒜氨酸浓度高于大蒜素浓度;符合物质代谢酶促反应的特点,当反应物浓度较高时,反应速度加快,生成物浓度升高,抑制正向反应速度[18],最后蒜氨酸完全代谢转化为大蒜素,以大蒜素形式排出体外,24 h后血液中未检测出蒜氨酸和大蒜素,所以蒜氨酸t1/2均大于大蒜素t1/2,蒜氨酸Cl为0.017 7 mg/(L∙min),高于大蒜素的0.012 mg/(L∙min)。
组织器官中蒜氨酸与大蒜素结果显示,肝脏能富集蒜氨酸,并在肝脏中转化为大蒜素,在肝脏中蒜氨酸和大蒜素浓度均高于血液浓度,差异均有统计学意义(P<0.01)。蒜氨酸是氨基酸成分在肾脏不能排泄,大蒜素为脂溶性成分也不在肾脏排泄,肾组织中蒜氨酸和大蒜素与血液比较,差异无统计学意义(P>0.05)。肺部组织中蒜氨酸浓度与血液比较,差异无统计学意义(P>0.05);大蒜素为脂溶性挥发性成分,随气体挥发由呼吸道排出体外,其浓度显著低于血液,差异有统计学意义(P<0.01),与文献[12]报道相符。蒜氨酸和大蒜素都是小分子物质,能够通过血⁃脑屏障而进入中枢神经系统,所以脑组织中的浓度与血液比较,差异无统计学意义(P>0.05)。
综上所述,蒜氨酸为食用药物大蒜氨基酸类化合物,对机体物无毒性反应;水溶性利于制剂制备,能提高药物浓度,发挥有效的药理作用;进入机体后可生成大蒜素,具有双重药理作用,在体内无药物累积和残留。由此可见,蒜氨酸有望成为深受临床欢迎,治疗多种疾病的药物。
[1]胡铭,李明强.大蒜素药理作用及药用制剂研究进展[J].现代医药卫生,2017,33(18):2799⁃2802.
[2]陶庆霞,张鹏,吴翠莹,等.大蒜素抗肿瘤作用及其机制的研究进展[J].中华神经创伤外科电子杂志,2016,2(6):365⁃368.http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zhsjcswk⁃dzzz201606010.
[3]BOMBICZ M,PRIKSZ D,VARGA B,et al.Anti⁃atherogenic properties of allium ursinum liophylisate:impact on lipoprotein homeostasis and cardiac biomarkers in hypercholesterolemic rabbits[J].Int J Mol Sci,2016,17(8).
[4]陈锋,朱震宏,刘素辉,等.蒜氨酸、蒜酶及二者联用对耐甲氧西林金黄色葡萄球菌的抗菌作用[J].西安交通大学学报(医学版),2011,32(2):190⁃192.
[5]ABBEHAUSEN C,SUCENA SF,LANCELLOTTI M,et al.Synthesis,spectroscopic characterization,DFT studies,and antibacterial and anti⁃tumor activities of a novel water soluble Pd(Ⅱ)complex with l⁃alliin[J].J MOL STRUCT,2013,1035:421⁃426.
[6]周圆,郑春丽,朱家壁.大蒜辣素前体包芯片的制备[J].中国新药杂志,2011,20(23):2316⁃2320.
[7]李明强,胡铭,宋删删,等.高效分离提取蒜氨酸方法研究[J].现代医药卫生,2017,33(19):2937⁃2940.
[8]孙萍,邓树海,于维萍.PEG修饰大蒜素长循环脂质体的制备及药物动力学研究[J].实用心脑肺血管病杂志,2006,14(6):454⁃456.
[9]黎维勇,宋波.高效液相色谱法测定大蒜素注射液中大蒜素的含量[J].中国医院药学杂志,2005,25(2):122⁃123.
[10]常军民,向阳,美丽万,等.蒜氨酸在大鼠的药代动力学研究[J].中成药,2004,26(3):184⁃186.
[11]胡兴鹏,周华,杜阳敏,等.蒜氨酸的热分解及其机理分析[J].食品科学,2017,38(3):64⁃68.
[12]CHEN Z,XU M,WANG C,et al.Thermolysis kinetics and thermal deg⁃radation compounds of alliin[J].Food Chem,2017,223:25⁃30.
[13]ZHANG M,LEI N,ZHANG Z,et al.Thermal processing effects on the chemical constituent and antioxidant activity of s⁃alk(en)ylcysteine s⁃oxides(alliin)extract[J].LWT⁃Food Science and Technology,2013,51(1):309⁃313.
[14]钱民章,陈建业.生物化学[M].8 版 .北京:科学出版社,2013:43⁃63.
