热烫对4种芸薹属蔬菜硫代葡萄糖苷及其吲哚族降解产物的影响
2018-03-16雷琳阚茗铭叶发银赵国华
雷琳,阚茗铭,叶发银,赵国华,2*
1(西南大学 食品科学学院,重庆,400715) 2(重庆市特色食品工程技术研究中心,重庆,400175)
硫代葡萄糖苷,简称硫苷(glucosinolates),是一类含硫、含氮、阴离子、亲水性的植物次生代谢产物,由β-硫代葡萄糖基和1个与硫原子连接的侧链R组成。根据侧链R不同,可将硫苷分为三大类型:即脂肪族、吲哚族和芳香族硫苷[1]。硫苷广泛存在于十字花科芸薹属蔬菜中,在植物体中完整的硫苷并不具有生理活性,但当植物被咀嚼或机械破碎时,硫苷在内源黑芥子酶的作用下容易水解生成异硫氰酸酯、硫氰酸酯、恶唑烷酮和腈类等具有生物活性的化合物[2]。
近年来,吲哚族硫苷降解产物由于其特殊的生理功能越来越受到关注。AGERBIRK等[3]的研究表明(图1),当芸薹属蔬菜组织被破坏后,黑芥子酶水解3-吲哚基甲基硫苷生成吲哚-3-乙腈(indole-3-acetonitrile,I3A)和吲哚-3-甲基异硫氰酸盐,后者不稳定,接着与水、抗坏血酸、氨基酸及其他植物代谢物生成抗坏血酸原(ascorbigen,ABG)[4]和吲哚-3-甲醇 (indole-3-carbinol,I3C)等具有生理活性的物质。在加热、弱酸性及中性溶液中,I3C发生缩合形成二聚物3,3-二吲哚基甲烷及其他三聚物[5]。研究表明I3C具有减缓葡萄球菌肠毒素B介导的肝损伤[6]、防止顺铂诱导的急性肾毒性[7]、抗肿瘤[8]及抑制微生物生长[9]等活性。
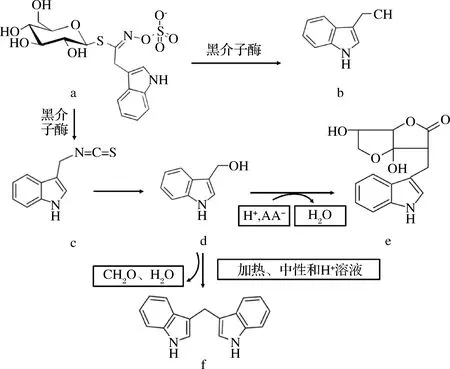
a, 3-吲哚基甲基硫苷;b,吲哚-3-乙腈;c,吲哚-3-甲基异硫氰酸盐;d,吲哚-3-甲醇;e,抗坏血酸原;f,3,3-二吲哚基甲烷;AA,抗坏血酸图1 3-甲基吲哚基硫苷降解的简化途径Fig.1 Simplified summary of breakdown of indol-3- ylmelthylglucosinolate
机械、冷冻和热加工会显著影响植物硫苷和异硫氰酸盐的种类及含量[10-11]。蔬菜被食用前通常需要经过工业或烹饪加工,其中热烫是必要的预熟处理工艺之一[12]。然而,有关热烫对蔬菜硫苷及其吲哚族硫苷主要降解产物的影响鲜见报道。本文选用国内4种常见的芸薹属蔬菜——甘蓝、娃娃菜、小白菜、瓢儿菜,研究90 ℃下不同热烫时间对硫苷及其吲哚族硫苷主要降解产物(I3C、I3A和ABG)的影响,初步掌握有利于发挥此类蔬菜生理功能的加工方式。
1 材料与方法
1.1 材料与试剂
甘蓝(BrassicaoleraceaL.)、娃娃菜(Brassicarapapekinensissp.)、小白菜(BrassicacampestrisL. subsp.chinensisvar.communis(L.) Makino, Tsen et Lee )和瓢儿菜(Brassicarapachinensis)均购自农贸市场。将蔬菜清理干净,通风沥干后,分割成大小均匀的块状(3 cm×3 cm),各取4份,每份200 g,置于保鲜袋中,放入-80 ℃冰箱备用。
苯甲基硫苷标准品(glucotropaeolin, TRO) (>95%),日本TCI公司;硫酸酯酶(≥10,000 units/g solid), 美国Sigma公司;DEAE SephadexA-25,美国Amersham Biosciences公司;I3C (≥98%)、I3A (≥98%)、四甲基氯化铵,中国Adamas-beta公司。参照EWA等[13]的方法,用I3C和抗坏血酸合成ABG。其他试剂均为分析纯,购自成都科龙化工试剂厂。
1.2 仪器与设备
BS-223S电子天平,德国塞多利斯公司;HH-2数显恒温水浴锅,金坛市富华仪器有限公司; LC-20A高效液相色谱仪(紫外/荧光检测器),日本岛津公司;5810型台式高速离心机,德国Eppendorf公司;DHG-9140恒温鼓风干燥箱,上海齐欣科学仪器有限公司;ALPHA1-4 LSC真空冷冻干燥机,河南兄弟仪器设备有限公司;DZF-6020真空干燥箱,上海齐欣科学仪器有限公司;PB-10电化学分析仪/pH计,德国赛多利斯公司。
1.3 实验方法
1.3.1 蔬菜的热烫处理
在1 000 mL 大烧杯中加入500 mL超纯水,于恒温水浴锅内加热至90 ℃。将200 g蔬菜样品倒入90 ℃超纯水中。4份样品分别在90 ℃超纯水中热烫处理0、20、40、60 s。处理后的样品沥去表面水分, 立即放在-20 ℃冰箱中预冷却24 h,经真空冷冻干燥48 h后,粉碎,过200目筛,置-80 ℃ 冰箱中,备用。
1.3.2 硫苷的提取与分析
参照VAN等[14]的方法并作适当修改。称取热烫处理后的冻干蔬菜样品5 g,置于15 mL离心管中,加入5 mL煮沸的甲醇,83 ℃水浴20 min,于3 000 r/min离心10 min,收集上清液,沉淀物再用5 mL甲醇(体积分数为70%) 重复提取2次,合并上清液。取2 mL提取液流经DEAE SephadexA-25离子交换柱,排干提取液后,用2 mL醋酸钠溶液(0.02 mol/L)冲洗柱子,加入75 μL硫酸酯酶溶液,室温封口过夜后用0.5 mL超纯水洗脱3次,过0.45 μm滤膜,高效液相色谱(high-performance liquid chromatography, HPLC)分析硫苷含量。
HPLC分析条件[15]:色谱柱为Thermo BDS C18(4.6 mm×250 mm, 5 μm),流动相A:四甲基氯化铵(0.5 g/L),流动相B:乙腈(体积分数为20%);线性梯度洗脱程序为1 min时,100% A;21 min时,100% B;26 min时,100% A,保持5 min后结束;31min内可使硫苷全部分离;检测波长229 nm;流速1.1 mL/min;柱温35 ℃;进样量10 μL;以TRO作为内标。按照公式1,根据保留时间、峰面积、内标和相对校正系数对硫苷组分进行定量测定[15-16]。
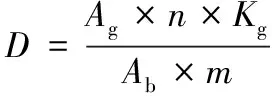
(1)
式中:D,干基样品中硫苷含量,μmol/g干重;Ag,脱硫硫苷峰面积;Ab,内标峰面积;n,试样中加入内标的量,μmol;m,称量试样质量,g;Kg,脱硫硫苷相对校正系数(见表1)。
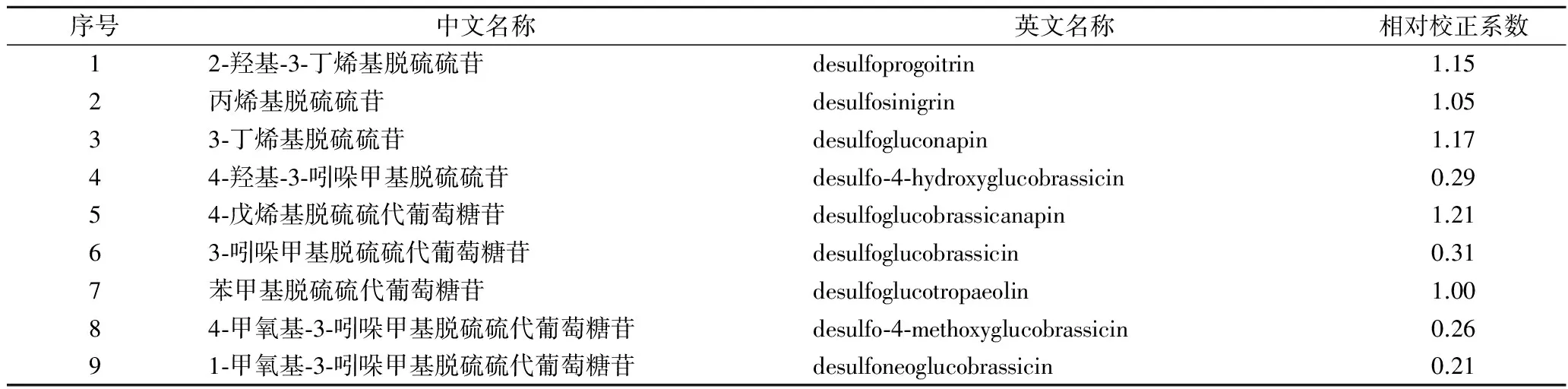
表1 脱硫硫苷相对校正系数[15]Table 1 Correction of coefficient of desulfo-glucosinolates[15]
1.3.3 吲哚族硫苷降解产物含量测定
参照ALEKSANDROVA等[17]的方法并作适当修改。称取热烫处理后的冻干蔬菜样品5 g,用10 mL丙酮提取2次,合并提取液并过滤,滤液用20 mL乙酸乙酯提取,合并有机层并用无水Na2SO4干燥,过滤膜后通过旋转蒸发仪浓缩,残渣用乙腈溶解至2 mL,采用外标法,HPLC定量分析各组分含量。
HPLC分析条件[13]:ODS-23 (4.6 mm×150 mm,5 μm),流动相A:乙腈(体积分数为10%)-乙酸铵缓冲溶液(0.1 mol/L,pH=5.7),流动相B:乙腈(体积分数为80%)-乙酸铵缓冲溶液(0.1mol/L,pH=5.7);线性梯度洗脱程序为0 min时,100% A;25 min时,100% B并维持5 min;35 min时,100% A,保持5 min后结束;40 min内可使吲哚族硫苷降解产物全部分离;检测波长280 nm;流速1.3 mL/min;柱温35 ℃;进样量20 μL;以I3A、I3C和ABG作为外标,绘制标准曲线,分别得到线性回归方程进行定量测定,以μmol/g干重为单位。I3A回归方程为:y=36 756x+12 054,R2=0.992 8;I3C回归方程为:y=52 494x-1 716.1,R2=0.999 4;ABG回归方程为:y=5 100.7x+3 613.6,R2=0.998 3。
1.4 数据处理
所有实验进行3次重复测定,测定结果以平均值±标准差表示,显著性差异用多重比较法中的标记字母法表示,用SPSS19.0.0软件进行数据分析,显著性水平为p<0.05。
2 结果与分析
2.1 四种新鲜芸薹属蔬菜硫苷组成
由表2可知,4种蔬菜中检测出9种硫苷,包括4种脂肪族硫苷、4种吲哚族硫苷、1种芳香族硫苷,且脂肪族硫苷总量>吲哚族硫苷总量>芳香族硫苷总量。不同芸薹属蔬菜总硫苷含量差异较大,甘蓝总硫苷含量最高,其次是娃娃菜、小白菜、瓢儿菜。这与何洪巨等[18]的研究一致,即白菜类(娃娃菜、小白菜、瓢儿菜)的硫苷含量低于甘蓝类。
本研究中鲜甘蓝含量较高的是4-戊烯基硫苷(glucobrassicanapin,GBN)、2-羟基-3-丁烯基硫苷(progoitrin,PRO)和4-甲氧基-3-吲哚甲基硫苷(4-methoxyglucobrassicin,4ME),含量最低的是4-羟基-3-吲哚甲基硫苷(4-hydroxyglucobrassicin,4OH)、3-吲哚甲基硫苷(glucobrassicin,GBC)和1-甲氧基-3-吲哚甲基硫苷(neoglucobrassicin,NEO);弓志青等[19]的研究发现,PRO、丙烯基硫苷(sinigrin,SIN)和GBC为甘蓝中的主要硫苷;而PRO是致甲状腺肿素的前体物质,SIN是芸薹属蔬菜主要的辛辣味物质。这些差异可能是由于甘蓝的品种、采摘阶段、栽培条件的不同所致。鲜娃娃菜中未检测到PRO及苯乙基硫苷(phenylethylglu-cosinolate,GNT),其含量最丰富的是3-丁烯基硫苷(gluconapin,NAP),约为4OH的19倍。小白菜和瓢儿菜中含量最丰富的是GBN;小白菜中未检测到NEO;瓢儿菜中未检测到4OH,4ME和NEO含量接近且最少。
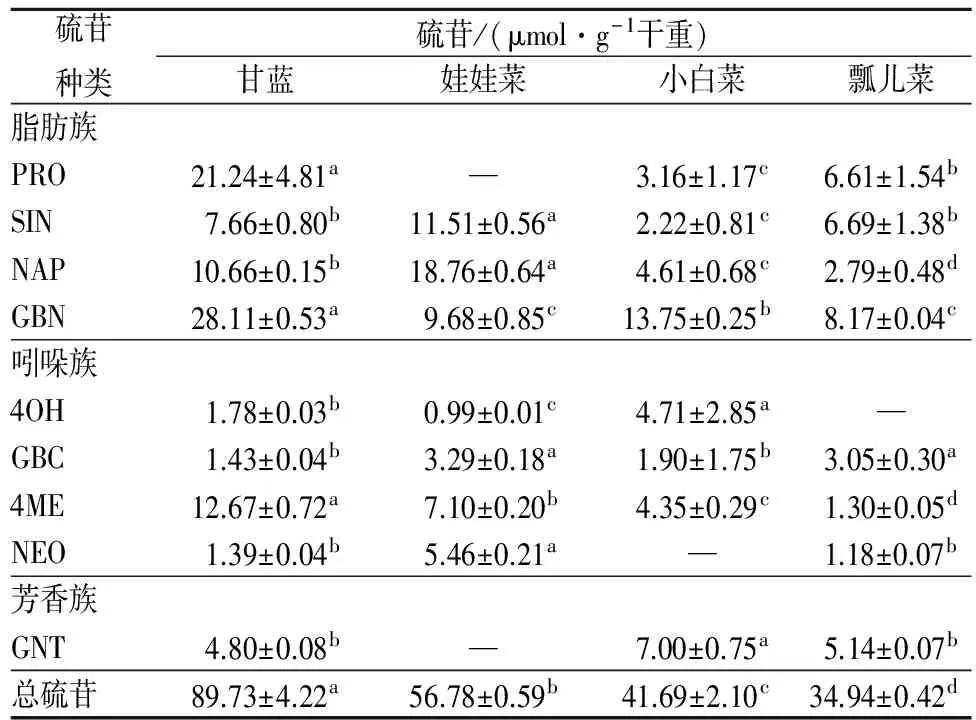
表2 四种新鲜芸薹属蔬菜硫苷组成Table 2 The compositions of glucosinolates in fourselected Brassica vegetables
注:“-”,该样品中未检出此种物质。同行小写字母不同代表差异显著,p<0.05。
2.2 热烫降低芸薹属蔬菜硫苷含量
如图2所示,经热烫后各蔬菜总硫苷含量均随热烫时间的延长而显著降低。甘蓝热烫20 s后,总硫苷保留率为70%;当热烫时间延长至60 s时,总硫苷保留率降低至27%;娃娃菜,小白菜和瓢儿菜前期受热烫影响较大,20 s时,总硫苷保留率为45%;当热烫时间延长至60 s时,总硫苷保留率降低至27%~29%(图2-A)。本研究结果与其他文献报道类似:王会霞等[20]研究烫漂对冲菜硫苷的降解变化时发现,硫苷的降解遵循一级降解规律,加热时间越长,损失越多;WENNBERG等[21]发现与鲜样相比,热烫处理5 min后,甘蓝总硫苷保留率显著下降;何湘漪[22]等比较了蒸煮、微波和烹饪3种方式对十字花科蔬菜硫苷的影响,发现处理时间越长,蔬菜各硫苷组分的保留率越小。这说明热烫有利于去除芸薹属蔬菜中PRO、SIN等不良成分。
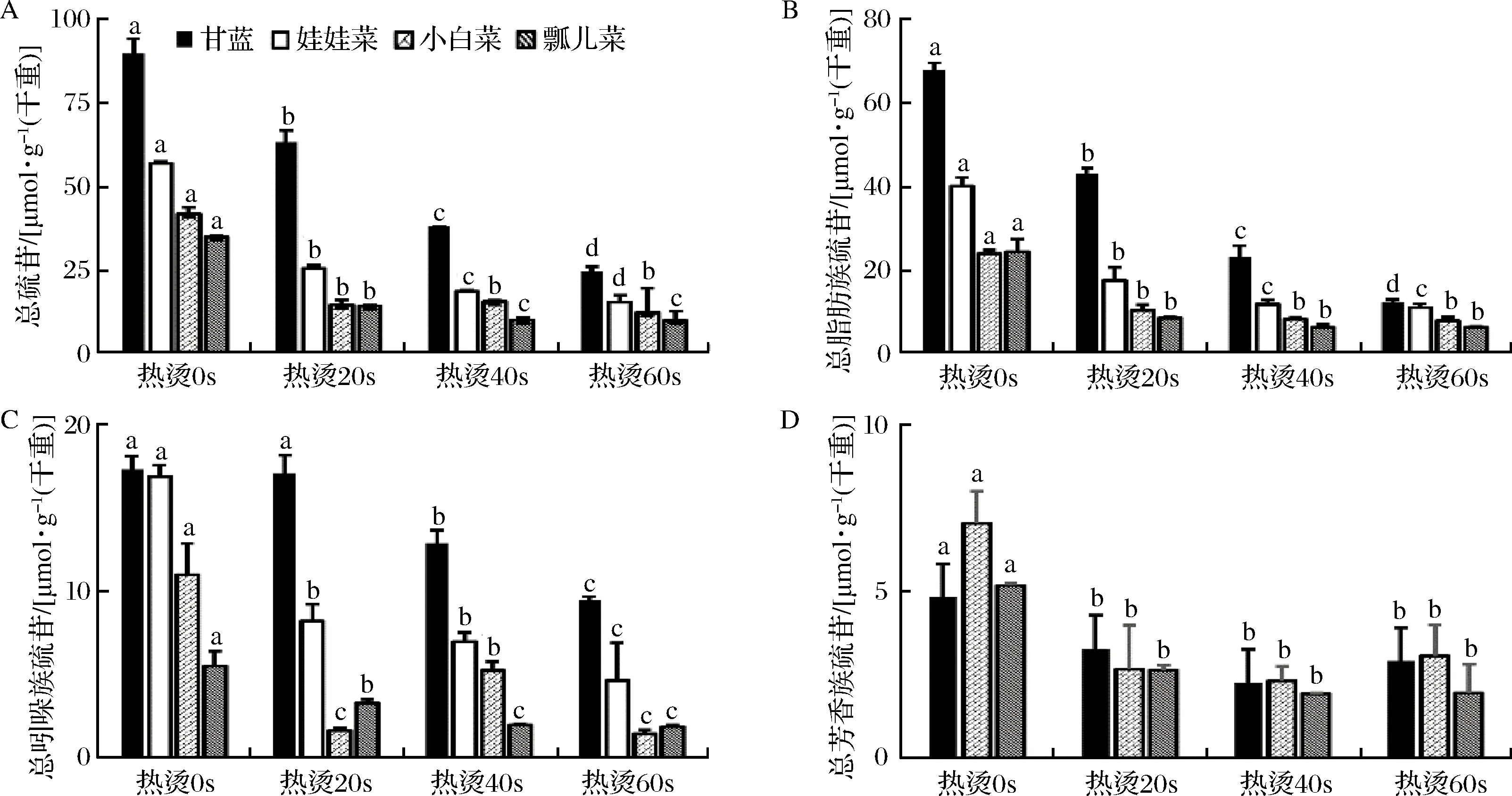
图2 热烫后4种蔬菜硫苷物质含量Fig.2 Contents of glucosinolates in four selected vegetables after blanching注:同种蔬菜不同热烫时间下小写字母不同表示差异显著,p<0.05。
不同种类硫苷损失程度不同,热烫过程中脂肪族硫苷损失率(37%~82%)>吲哚族硫苷损失率(7%~40%)>芳香族硫苷损失率(2%~14%)(图2-B~图2-D)。本研究及何湘漪[22]结果表明,热加工时吲哚族硫苷的保留率大于脂肪族硫苷;相反CISKA等[23]和OERLEMANS等[24]的结果表明,与脂肪族硫苷相比,吲哚族硫苷的热稳定性较差,热加工时损失较多。这可能是由于蔬菜的品种差异,导致叶片的厚度、柔软度及蔬菜纤维含量和种类不同,从而造成不同蔬菜种类的硫苷降解情况有所变化[21, 25]。此外,小白菜在热烫过程中,其吲哚族硫苷含量呈现先增加后降低的现象(热烫20 s,1.67 μmol/g干重;热烫40 s,5.26 μmol/g干重; 热烫60 s,1.46 μmol/g干重) (图2-C);这可能是在热烫初期,小白菜中一些原本与细胞壁结合的硫苷被释放出来,而黑芥子酶在高温下活性降低[26-27],其水解硫苷的能力降低而使硫苷含量升高;但后期随着热烫时间增加,硫苷受热降解及溶水损失影响,其含量逐渐降低。
2.3 热烫增加芸薹属蔬菜吲哚族硫苷降解产物含量
芸薹属蔬菜吲哚族硫苷降解产物具有抗肿瘤[8]及抑制微生物生长等[9]活性,其主要降解产物为I3C、I3A和ABG。由表3可知,各蔬菜鲜样总吲哚族硫苷降解产物含量相近,随着热烫时间延长,吲哚族硫苷降解产物含量均呈现不同程度增加;热烫60 s时,吲哚族硫苷降解产物在娃娃菜中含量最高,约增加了5倍;在甘蓝中约增加了3倍,在小白菜和瓢儿菜中约增加了1倍。4种蔬菜中ABG含量最丰富,I3C和I3A含量则相当。与鲜样相比,甘蓝I3C受热烫影响最小,热烫60 s后,其含量约增加了2倍;小白菜和瓢儿菜ABG受热烫影响最小,随热烫时间增加,其含量均增加不到1倍;娃娃菜ABG受热烫影响最大。
前期研究[28]发现十字花科蔬菜煮制15 min后,其吲哚族总硫苷降解产物在绿色花椰菜和紫色花椰菜中分别损失了48.5%和78.5%,但在芜菁甘蓝中增加了142.9%。CISKA等[29]发现白菜煮制60 min后,与鲜样相比,其吲哚族硫苷降解产物I3C和I3A含量均降低了20%,而I3C的二聚缩合产物3,3-二吲哚基甲烷含量却显著增加。本研究结果与前人研究不一致,这可能是由于1)蔬菜品种差异所致;2)本研究热烫时间较短,吲哚族硫苷降解中间产物来不及缩合生成二聚物和三聚物,因而在60 s内呈现增加的趋势 (图1)[3]。
3 结论
鲜甘蓝总硫苷含量在4种芸薹属蔬菜中最高;热烫后各蔬菜硫苷均遭到破坏,且脂肪族硫苷损失率>吲哚族硫苷损失率>芳香族硫苷损失率。与鲜样相比,热烫后蔬菜中的吲哚族硫苷降解产物增加了约1~5倍,且热烫60 s后娃娃菜中吲哚族硫苷降解产物含量最高。综上所述,热烫60 s可减少4种芸薹属蔬菜总硫苷含量,有利于去除致甲状腺肿素前体物质(PRO)和辛辣味物质(SIN);而热烫60 s能有效增加四种芸薹属蔬菜吲哚族硫苷降解产物含量,可作为增加蔬菜抗癌等生理活性的烹饪预处理手段之一。
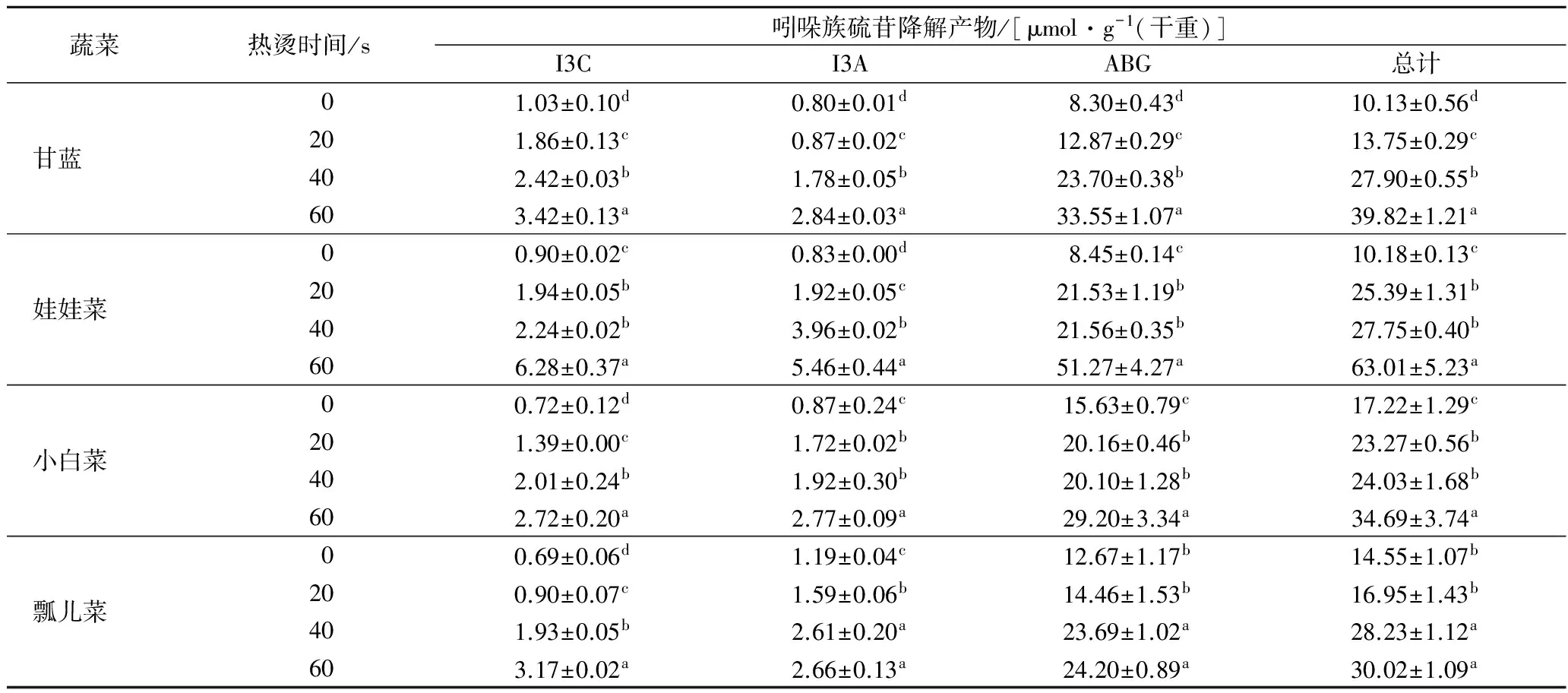
表3 四种芸薹属蔬菜吲哚族硫苷降解产物组成Table 3 The breakdown products of indole-glucosinolates in four selected Brassica vegetables
注:同种蔬菜同列小写字母不同表示差异显著,p<0.05。
[1] FRANCISCO M, VELASCO P, MORENO D A, et al. Cooking methods of Brassica rapa affect the preservation of glucosinolates, phenolics and vitamin C[J]. Food Research International, 2010, 43(5):1 455-1 463.
[2] NUGON-BAUDON L, RABOT S, WAL J M, et al. Interactions of the intestinal microflora with glucosinolates in rapeseed meal toxicity: first evidence of an intestinal Lactobacillus possessing a myrosinase-like activityinvivo[J]. Journal of the Science of Food & Agriculture, 1990, 52(4):547-559.
[3] AGERBIRK N, VOS M D, KIM J H, et al. Indole glucosinolate breakdown and its biological effects[J]. Phytochemistry Reviews, 2009, 8(1):101.
[4] TAI A, FUKUNAGA K, OHNO A, et al. Antioxidative properties of ascorbigen in using multiple antioxidant assays[J]. Bioscience Biotechnology & Biochemistry, 2014, 78(10):1 723.
[5] BUSBEE P B, NAGARKATTI M, NAGARKATTI P S. Natural indoles, indole-3-carbinol (I3C) and 3,3'-diindolylmethane (DIM), attenuate staphylococcal enterotoxin B-mediated liver injury by downregulating miR-31 expression and promoting caspase-2-mediated apoptosis[J]. Plos One, 2015, 10(2): e0118506.
[6] EINAGA R N, MAHRAN Y F. Indole-3-carbinol protects against cisplatin-induced acute nephrotoxicity: role of calcitonin gene-related peptide and insulin-like growth factor-1[J]. Scientific Reports, 2016, 6:1-13.
[7] FUJIOKA N, FRITZ V, UPADHYAYA P, et al. Research on cruciferous vegetables, indole-3-carbinol, and cancer prevention: A tribute to Lee W. Wattenberg[J]. Molecular Nutrition & Food Research, 2016, 60(6):1 228-1 238.
[8] WANG Xin-mei, HE Hong-yan, LU Yuan-zhi, et al. Indole-3-carbinol inhibits tumorigenicity of hepatocellular carcinoma cells via suppression of micro RNA-21 and upregulation of phosphatase and tensin homolog[J]. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research, 2014, 1853(1):244-253.
[9] SOTELO T, LEMA M, SOENGAS P, et al. In vitro activity of glucosinolates and their degradation products against brassica-pathogenic bacteria and fungi[J]. Applied & Environmental Microbiology, 2015, 81(1), 432-440.
[10] 方孟玮, 杨润强,郭丽萍,等. 切分、汽蒸及脱水对甘蓝叶片中硫苷-黑芥子酶系统的影响[J]. 食品科学, 2016, 37(5): 41-45.
[11] 宋亚, 李凯利, 方佳宁, 等. 鲜切紫甘蓝中花青苷和硫代葡萄糖苷在贮藏过程中的变化[J]. 食品科学, 2016, 37(18): 96-101.
[12] 陈锦屏. 果品蔬菜加工学[M].西安:陕西科技出版社, 1990:79-81.
[13] EWA C, PATHAK D R. Glucosinolate derivatives in stored fermented cabbage[J]. Journal of Agricultural and Food Chemistry, 2004, 52: 7 938-7 943.
[14] VAN E D, BELLOSTAS N, STROBELB W, et al. Influence of pressure/temperature treatments on glucosinolate conversion in broccoli (BrassicaoleraceaeL. cv Italica) heads[J]. Food Chemistry, 2009, 112(3):646-653.
[15] 中华人民共和国农业部. NY/T1582—2007,油菜籽中硫代葡萄糖苷的测定高效液相色谱法[S]. 北京: 中国标准出版社, 2007.
[16] MICHINTON I, SANG J, BURKE D, et al. Separation of desulphoglucosinolates by reversed-phase high-performance liquid chromatography[J]. Journal of Chromatography A, 1982, 247(1):141-148.
[17] ALEKSANDROVA L G, KOROLEV A M, PREOBRAZHENSKAYA M N. Study of natural ascorbigen and related compounds by HPLC[J]. Food Chemistry, 1992, 45(1):61-69.
[18] 何洪巨, 陈杭, SCHNITZLER H. 中国十字花科蔬菜品种硫代葡萄糖苷组成与含量[C].中国园艺学会青年学术讨论会. 北京:中国园艺学会,2000:294-299.
[19] 弓志青, 张慜, 刘春泉. 甘蓝不同部位及加工对硫代葡萄糖苷组分和含量的影响[J]. 中国食品学报, 2011, 11(4):218-223.
[20] 王会霞, 李晨, 薛峰,等. 加工处理方式对冲菜中硫代葡萄糖苷的影响[J]. 食品科学, 2011, 32(7):168-172.
[21] WENNBERG M, EKVALL J, OLSSON K, et al. Changes in carbohydrate and glucosinolate composition in white cabbage (Brassicaoleracea, var. capitata ) during blanching and treatment with acetic acid [J]. Food Chemistry, 2006, 95(2):226-236.
[22] 何湘漪, 何洪巨, 范志红,等. 烹调方法对3种十字花科蔬菜中硫代葡萄糖苷物质保存的影响[J]. 中国食品学报, 2013, 13(8):124-131.
[23] CISKA E, KOZLOWSKA H. The effect of cooking on the glucosinolates content in white cabbage[J]. European Food Research and Technology, 2001, 212(5): 582-587.
[24] OERLEMANS K, BARRETT D M, SUADES C B, et al. Thermal degradation of glucosinolates in red cabbage[J]. Food Chemistry, 2006, 95(1):19-29.
[25] EAS R, HEANEY R K. The effect of cooking and processing on the glucosinolate content: studies on four varieties of Portuguese cabbage and hybrid white cabbage[J]. Journal of the Science of Food & Agriculture, 1993, 62(3):259-265.
[26] EWA CIESLIK, TERESA LESZCZYNSKA, AGNIESZKA FILIPIAK-FLORKIEWICZ, et al. Effects of some technological processes on glucosinolate contents in cruciferous vegetables[J]. Food Chemistry, 2007, 105(3):976-981.
[27] BJERGEGAARD C, SORENSEN H. Characterization of proteins, including myrosinases, associated to rapeseed dietary fibres, compared to proteins in pea dietary fibres[J]. Polish Journal of Food and Nutrition Science, 1995,4(2):47-57.
[28] KAPUSTA-DUCH J, KUSZNJEREWICZ B, LESZCZYNSKA T, et al. Effect of cooking on the contents of glucosinolates and their degradation products in selected Brassica, vegetables[J]. Journal of Functional Foods, 2016, 23:412-422.
[29] CISKA, E, VERKERK, R, HONKE, J. Effect of boiling on the content of ascorbigen, indole-3-carbinol, indole-3-acetonitrile, and 3,3′-diindolylmethane in fermented cabbage[J]. Journal of Agricultural and Food Chemistry, 2009, 57(6):2 334-2 338.
