加热蒜氨酸形成活性硫产物的鉴定
2018-03-16黄雪松李星星陈子兴
黄雪松, 李星星,陈子兴
(暨南大学 理工学院,食品科学与工程系, 广东 广州,510632)
我国是世界上最大的大蒜(AlliumsativumL.,蒜头、胡蒜、独蒜等)生产、消费和出口国家[1]。大蒜具有增强免疫力、抗肿瘤、抗氧化、抗动脉粥样硬化、降血糖、降血压、降胆固醇[2-4]、解除蛋白酶的抑制[5]等多方面的生物活性,还有益于合成人体肾上腺素、胆碱、谷胱甘肽和牛磺酸等生理活性物质[6-7]。这些活性作用与其所含有蒜氨酸等含硫氨基酸有直接或间接的联系。
活性硫(reactive sulfur species,RSS)是一类对人体代谢有重要作用的硫化氢、硫烷、巯基、亚砜、亚磺酸类的含硫化合物。谷胱甘肽、胱氨酸是典型的RSS化合物[8]。大蒜中的蒜氨酸,在蒜氨酸酶的作用下,可以形成大蒜素,并进而形成许多可以挥发的二烯丙基二硫和二烯丙基三硫等RSS化合物,已被视为具有多种生物活性的“活性硫”化合物,也具有多方面的生物活性。如BENAVIDES等研究表明:大蒜的血管活性作用是由二烯丙基硫化物转化为过硫烷(hydropersulfides)类RSS物质所产生的。该过程是由二烯丙基硫与谷胱甘肽反应而产生,同时也释放出H2S[9]。蒜氨酸在加热条件下,也可以形成挥发性二烯丙基二硫和二烯丙基三硫等RSS化合物[10]。另外,黄雪松、周华等人还研究了蒜氨酸受热分解产生活性硫物质的动力学参数[11]。
但对于蒜氨酸在非酶条件下,诸如黑蒜、蒜泥、糖醋蒜等加工生产过程是否形成RSS的研究未见报道。为排除原料中蒜氨酸酶等的影响,拟采用蒜氨酸纯品、模拟黑蒜等加工产品的热处理条件,再采用液相色谱-质谱联用法(LC-MS)、串联质谱法(MS/MS)和液相色谱-高分辨质谱法(UPLC-HRMS)等方法鉴定是否形成RSS等生物活性物质,为揭示黑蒜等蒜制品的保健作用提供理论依据。
1 材料和方法
1.1 实验材料、试剂与仪器
蒜氨酸和S-烯丙基-半胱氨酸(SAC)均为化学合成(周华提供[12],分别与标准品对照后确定为蒜氨酸和SAC产品),其纯度为95%~98%。
冰醋酸,甲酸(分析纯),天津市富宇精细化工有限公司;乙腈、甲醇(色谱纯),美国迪马公司;尼龙66针式过滤器(直径13 mm,孔径0.45 μm)、尼龙66微孔过滤膜(直径13 mm,孔径0.45 μm),天津市津腾实验设备有限公司。
恒温水浴锅(HH-4),中国江苏金坛市宏华仪器厂;超声波清洗器(KQ-218),昆山市超声仪器有限公司;LC-MS的LC部分(Agilent 1100),美国安捷伦;色谱柱型(Eclipse XDB-C18,150 mm×2.1 mm, 5 μm),MS(AB 4000 Q TRAP),美国生物系统公司;UPLC-HRMS的LC部分(Agilent1290),美国安捷伦公司;色谱柱(RRHD SB-C18,2.1 mm×50 mm, 1.8 μm),质谱部分(Maxis impact),美国布鲁克公司。
1.2 实验方法
1.2.1 蒜氨酸的热处理
称取约0.75 g蒜氨酸溶于30 mL 20%的甲醇水溶液中,用铝盖密封后,于90 ℃恒温水浴中加热2 d,再冷却后保存于-20 ℃冰箱中。用时置室温平衡24 h,取出1 mL用针式过滤器过滤到液相进样瓶,待HPLC的测定。
1.2.2 蒜氨酸热分解产生活性硫产物的鉴定
(1)初步鉴定:将上述样液经LC-MS测定并推断产物的分子质量,并据蒜氨酸的结构特点推测所获RSS可能的分子结构。
(2)进一步确证:在初步鉴定的基础上,进一步利用MS/MS法和UPLC-HRMS法对蒜氨酸的热解产生的RSS进行对比分析,从而鉴定蒜氨酸受热分解形成的RSS产物。
1.2.3 测定条件
(1) LC-MS:液相色谱:色谱柱型(Eclipse XDB-C18,150 mm×2.1 mm, 5 μm)、不分流、在室温下用乙腈(A)-水(B)为流动相,梯度洗脱程序为:0~3 min,A为2%;3~35 min,A从2%→45%;35~40 min,A为45%;40.1~50 min,A为2%;总流速为250 μL/min,进样量为10 μL。
三重四极杆串联质谱仪配用电喷雾离子源,同时采用正离子模式(ESI+)和负离子模式进行检测(ESI-)。其工作软件为Analyst Software,检测条件如下:离子源电压(IS),5 500 V;解簇电压(DP),60 V;离子化温度(TEM),500 ℃;气帘气(CUR)、雾化气(GS1)和干燥气(GS2)均为氮气,压强分别为20、45和40 psi;扫描质量范围为50~1 200m/z。
(2)MS/MS:采用ESI+进行检测,离子化温度(TEM)为0 ℃;解簇电压(DP),50 V;入口电压(EP),10 V;碰撞能量(CE),17 eV;碰撞室出口电压(CXP),4 V;帘气(CUR)、雾化气(GS1)和干燥气(GS2)的压强分别为15、35和0 psi;扫描质量范围为30~200m/z。其他条件与2.3.3-(1)中的条件一致。
(3) UPLC-HRMS:超高效液相色谱:色谱柱型(RRHD SB-C18,2.1 mm×50 mm, 1.8 μm)、不分流、在室温下用0.1%甲酸水溶液(A)-乙腈(B)为流动相,梯度洗脱程序为:0~1 min,B为15%;1~4 min,B从15%→85%;4~8 min,B为85%;8~9 min,B从85%→15%;9~10 min,B为15%;总流速为200 μL/min,进样量为10 μL。
超高分辨率电喷雾-四极杆飞行时间质谱采用ESI正离子模式,工作软件为Data Analyst 4.0,检测条件为:毛细管电压(capillary),3 500 V;端板补偿电压(end plate offset),-500 V;充电电压(charging voltage),2 000 V;喷雾器压强(nebulizer),0.2 MPa;干燥气流速(dry gas),8.0 L/min;干燥温度,180 ℃;扫描质量范围为50~1 000m/z。
1.3 数据分析
本实验的所有样品均设置了3个重复,用Microsoft Office Excel 2007对数据进行处理并作图,对数据以误差线(平均值标准差)的形式表示。
2 结果与分析
2.1 热处理蒜氨酸产物的初步鉴定
图1为加热后留存于液相部分的受热分解形成物的总离子流图。由图1可见,蒜氨酸的热分解产物十分复杂、且较难以分离,只选择峰型较好的物质进行鉴定。

图1 蒜氨酸受热分解形成产物的总离子流图Fig.1 The total ion chromatogram of alliin’s decomposition products
2.1.1S-烯丙基-半胱氨酸
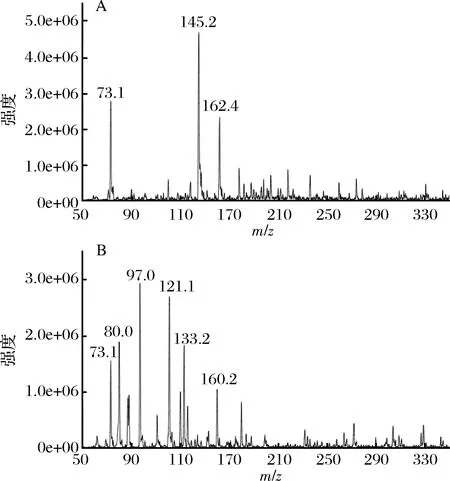
图2 保留时间约为2.72 min的产物的正离子模式质谱图(A)和负离子模式质谱图(B)Fig.2 Mass spectrum of the product whose retention time is 2.72 min with positive ion mode (A) and negative ion mode (B)
如图2所示,总离子流图中保留时间约为2.72 min的产物的质谱图中出现[M+H]+=162.4的正离子和[M-H]-=160.2的负离子,说明该产物的分子质量为161(奇数)。结合蒜氨酸的分子质量(MW=177),可推测该产物比蒜氨酸少1个氧原子,这应当是蒜氨酸的亚砜键热解断裂而生成的SAC,其结构如图3中的(2)所示。
2.1.2 烯丙基丙氨酸基活性硫
通过解析LC-MS得到的质谱图,发现蒜氨酸热处理产物中有一些化合物的分子质量呈规律变化。如表1所示,化合物1、2和3的分子质量与SAC的分子质量相差32的整数倍,且碎片离子也有一定的相似程度,因此这几个产物的分子式中可能比SAC多了n(n=1,2或3)个硫原子或氧原子;但因低分辨质谱中2个氧原子的原子量为32.00约等于1个硫原子的原子量(32.06),这2种情况无法区别而难以对其确认。另外,由于磺酸、次磺酸、亚磺酸、磺酸硫酯、二砜等含有较多氧原子的化合物极性均较大,不符合它们在总离子流图中的出峰顺序,从极性上看,只有硫烷类化合物符合离子流的出峰顺序,因此推测这3种化合物为烯丙基丙氨酸基RSS化合物,其分子结构如图3中的(3)、(4)和(5)所示。
基于上述推测,表1中m/z=105、120、137和152的离子峰恰好是由RSS中的C—S键和S—S键断裂(同时可能有质子的迁移)所产生的碎片离子峰。例如,化合物(3)在ESI正离子模式下的裂解过程可表示为图4。换言之,图3中所推测的烯丙基丙氨酸基二硫烷结构可在质谱图中得到较好的验证。此外,KANG等[13]在加热过的大蒜中曾发现过烯丙基丙氨酸基三硫烷,其质谱离子峰m/z=226、152和137与本实验的结果是一致的。
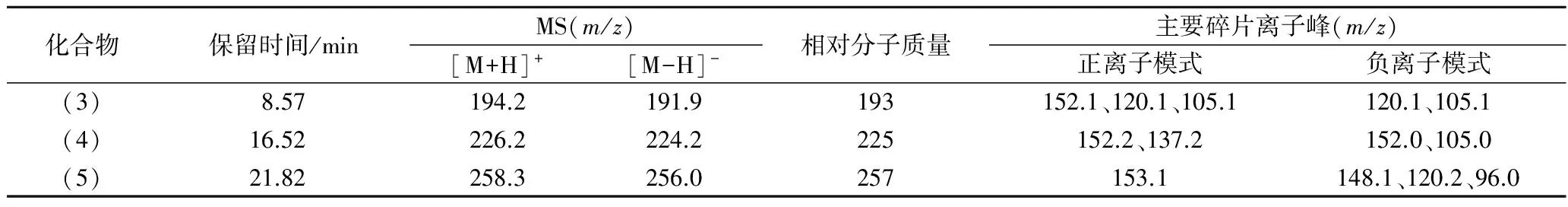
表1 烯丙基丙氨酸基活性硫的质谱信息Table 1 MS of allyl alanine sulfides
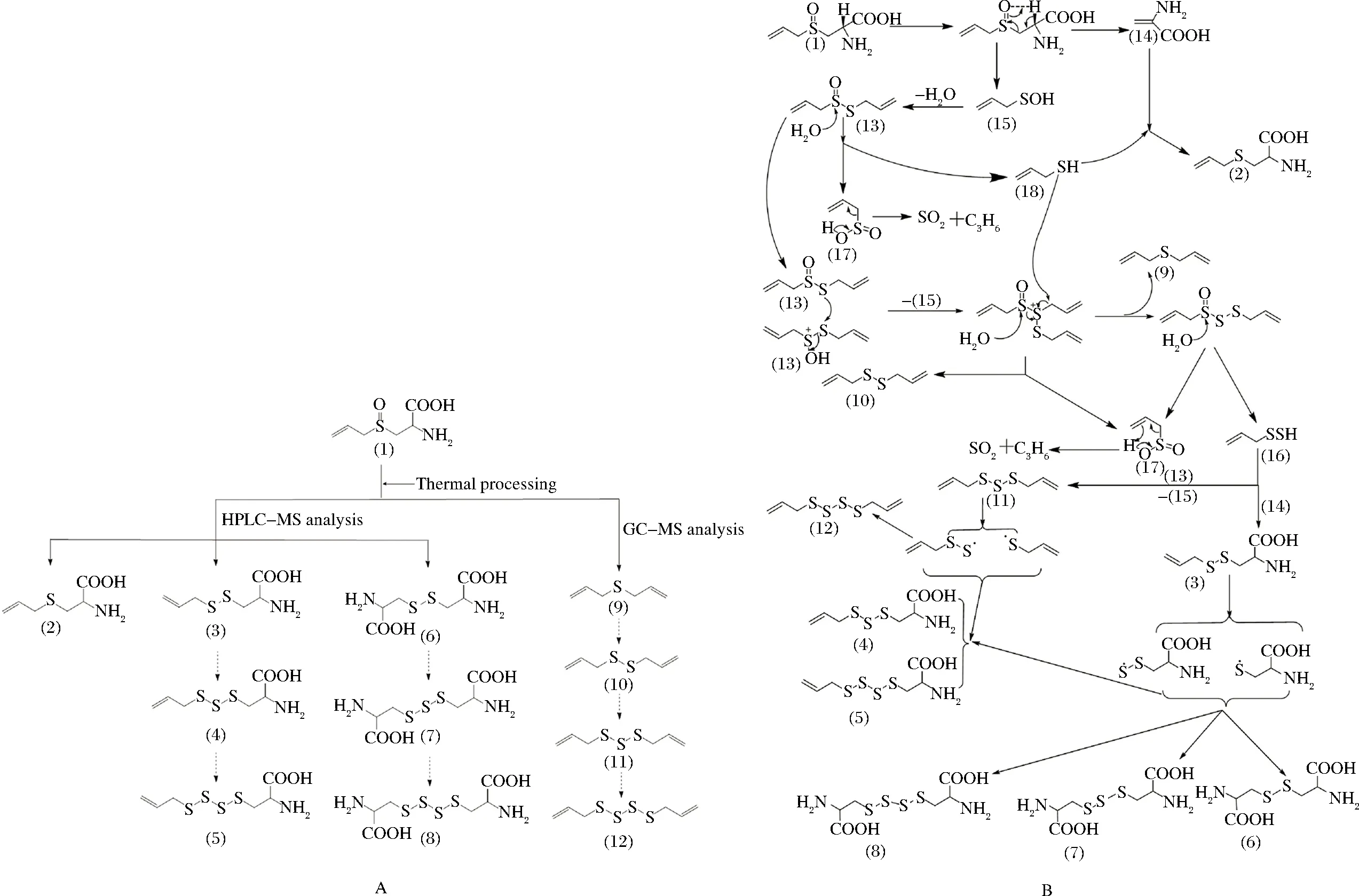
图3 蒜氨酸加热过程中硫烷类化合物的可能形成途径Fig.3 Formation of sulfide from thermally degraded alliin
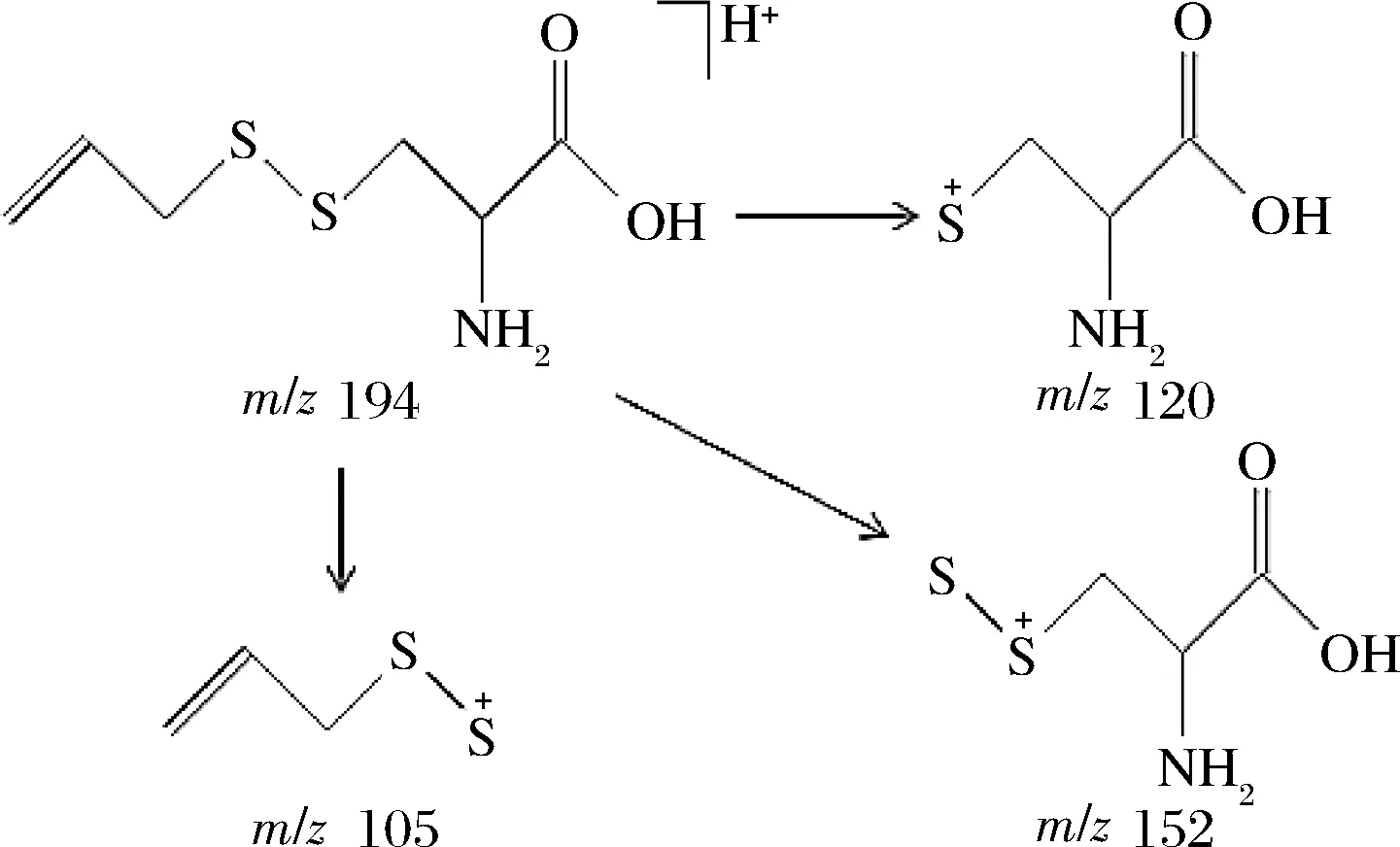
图4 化合物(3)的质谱裂解过程Fig.4 The pyrolysis of compound (3) in mass spectrometer
2.1.3 双丙氨酸基活性硫
除上述烯丙基丙氨酸基RSS外,质谱图中还有另外3个分子质量具有同样质量差异规律的产物离子,如表2所示。由于这几个化合物极性很大,其出峰顺序十分靠前,导致其在色谱柱中的分离效果不是很好。但是,根据其分子质量、极性的大小以及氮数规律,可推测这3种化合物的结构式如图3中的(6)、(7)和(8)所示。
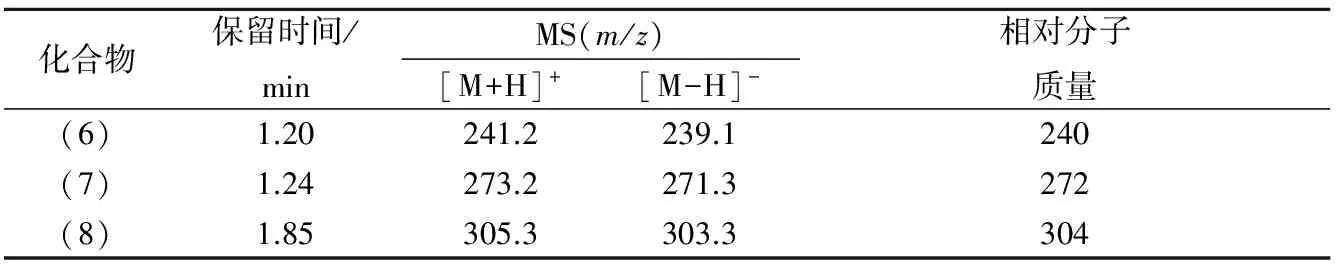
表2 双丙氨酸基活性硫的质谱信息Table 2 MS of dialanine sulfides
2.2 蒜氨酸热处理产物-丙氨酸硫烷类物质的确证
2.2.1 S-烯丙基-半胱氨酸(SAC)
如图5所示为总离子流图(图1)中保留时间为2.72 min的产物与SAC标准品的MS/MS图,由图可知它们的二级碎片离子基本相同,且其中m/z=73和145的碎片离子峰也与已有文献中SAC的碎片离子峰一致[13],这证实了SAC确实是蒜氨酸的分解产物之一。
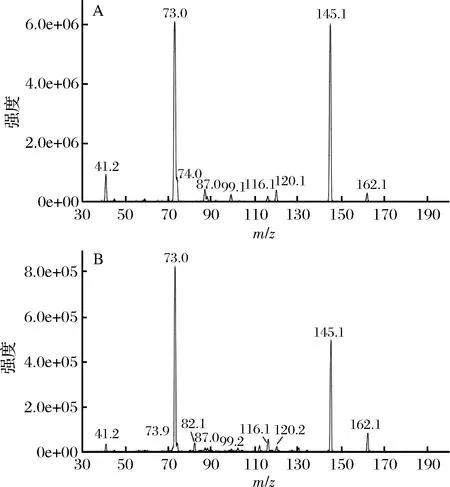
图5 SAC标准品(A)与图4中保留时间为2.72 min的产物(B)的二级质谱图Fig.5 MS/MS spectrums of standard SAC sample (A) and the product of which retention time is 2.72 min (B)
2.2.2 烯丙基丙氨酸活性硫和双丙氨酸基活性硫
UPLC-HRMS的结果表明,图3中所推测的蒜氨酸分解产物的分子式均存在,如表3所示,这些物质在UPLC中的出峰顺序也符合它们的极性顺序。此外,HRMS的结果还表明:磺酸、次磺酸、亚磺酸、磺酸硫酯和二砜等这类含有较多氧原子的化合物均不存在。
KUBEC等[15]测得蒜氨酸加热后生成的主要挥发性成分中含有二烯丙基一硫醚、二烯丙基二硫烷、二烯丙基三硫烷和二烯丙基四硫烷,其结构分别如图3中的(9)、(10)、(11)和(12)所示。这些双烯丙基RSS与本实验所推测的产物在结构上均为烯丙基或丙氨酸基取代的RSS化合物,即它们在加热过程中具有相似的裂解与重组途径,这间接佐证了本文所推测的各种产物结构式的合理性。此外,由于烯丙基丙氨酸基RSS和双丙氨酸基RSS中含有羧基,而羧基易形成氢键使得它们在水溶液中具有较高的溶解度和沸点,这可以解释这些物质在加热后仍留存于水相部分而不是同低沸点的双烯丙基RSS(见图3)一起成为挥发物这一事实。此外,结合表3中各个化合物的峰面积和KUBEC等的实验,我们推测蒜氨酸热处理产物中各类RSS化合物的含量均随分子中S原子个数的增加而减少,这表明RSS化合物中硫原子的个数会随着加热时间的延长或热处理强度的提高而增加(如图3中的虚线箭头所示)。根据这些分析,我们认为蒜氨酸分解形成RSS化合物的途径,可以归结为图3-A所示。
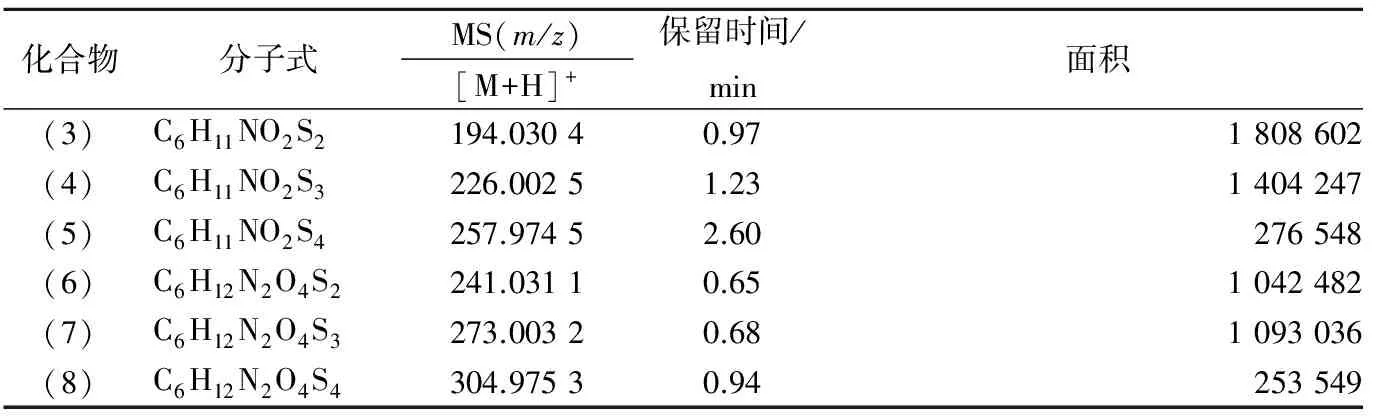
表3 高分辨质谱的结果Table 3 Result of high resolution mass spectrum
3 讨论
3.1 活性硫的形成机制
根据杨波[16]和朱根权[17]的研究,硫烷类化合物的热处理与转化很可能是通过自由基历程进行的。因此,可以推测本实验发现的烯丙基丙氨酸基RSS和双丙氨酸基RSS的生成也是通过自由基历程来实现的。例如,在蒜氨酸的热解过程中,烯丙基丙氨酸基三硫烷的可能形成机理如图6所示。
除了C—S键均裂产生的自由基重新组合这一途径,根据YU等[18]的观点,在上述途径发生的同时,蒜氨酸中的亚砜键可能重排产生次磺酸中间体,进而生成烯丙基醇和半胱氨酸等中间产物,然后这些中间产物再与均裂途径产生的自由基发生链反应生成RSS。
根据上述分析,我们推测有关RSS化合物的合成机制如图3-B所示。
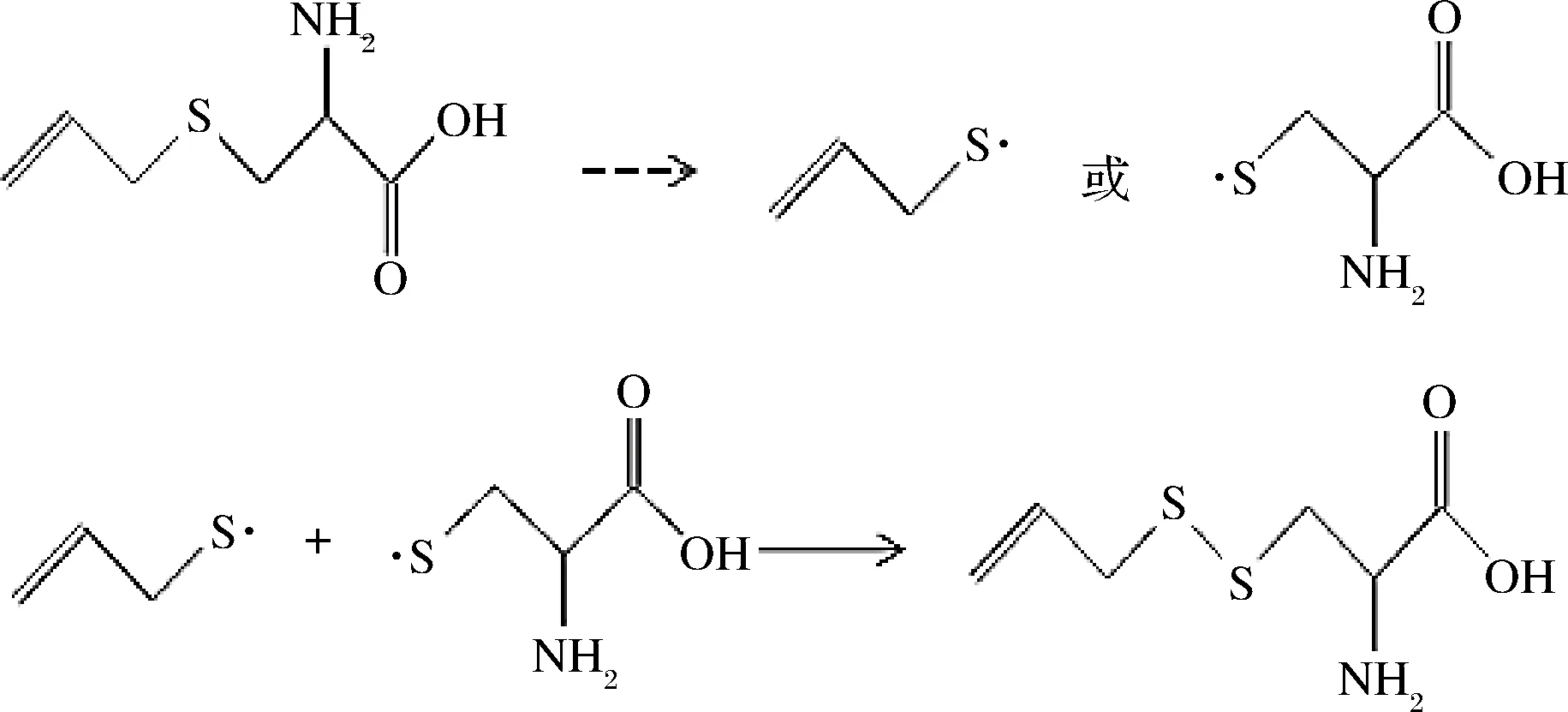
图6 烯丙基丙氨酸基三硫烷的可能生成机理之一Fig.6 The proposed pathway of formation of allyl alanine trisulfide
3.2 蒜氨酸生成SAC的新途径
SAC是一种具有抗氧化活性、抗癌活性、神经营养活性等多种生理活性的化合物[19-20],一般认为其由γ-谷氨酰半胱氨酸在γ-谷氨酰转肽酶(γ-GTP)的作用下转化生成[21-22]。而本实验的结果证实了由蒜氨酸直接加热生成SAC,这是一新获得SAC的新途径,这一途径可以解释大蒜在高温加工过程中,γ-GTP失活但SAC含量上升的事实[23]。但从总离子流图中各个峰的相对大小来看,SAC仅是蒜氨酸热处理产物的一小部分。
3.3 推测烯丙基丙氨酸基RSS和丙氨酸RSS具有烯丙基RSS类似的生物活性
由于烯丙基丙氨酸基RSS和双丙氨酸基RSS与双烯丙基RSS均具有RSS结构,且双烯丙基RSS具有抗菌、抗癌和阻止结肠细胞的增殖与转移等生理作用[24],因此可以推测本文发现的具有类似功能基团的RSS产物也具有相似的生理功能。已有相关报道表明烯丙基丙氨酸基三硫烷具有抗菌活性[25],烯丙基丙氨酸基二硫烷可以阻止结肠癌细胞增殖[26-27]。目前市场上十分受欢迎的黑蒜以及大蒜汁饮料均有许多对人体有益的生理功效[28-29],这些功效很可能与图3中的RSS有关,但这有待进一步确证。
本实验发现的蒜氨酸分解产物烯丙基丙氨酸基四硫烷尚无相应的CAS登录号,即该化合物有可能是首次发现。其他RSS均被证实可直接由蒜氨酸热分解产生,这阐明了加热过的大蒜中烯丙基丙氨酸基三硫烷的来源[30]。
[1] 崔荣江, 张华, 徐文艺, 等. 我国大蒜机械化生产现状及发展思路探讨. 农机化研究, 2015(3): 264-268.
[2] BANERJEE R, MAULIK S K. Effect of garlic on cardiovascular disorders: A review[J]. Nutr,2002(19): 1-4.
[3] SCHAFER G, KASCHULA C H. The immunomodulation and anti- inflammatory effects of garlic organosulfur compounds in cancer chemoprevention[J]. Anticancer Agents Med. Chem, 2014(14): 233-240.
[4] ICIEK M, KWIECIEN I, WODEK L. Biological properties of garlic and garlic-derived organosulfur compounds[J]. Environ. Mol. Mutagen, 2009(50): 247-265.
[5] 贾江滨, 许重远, 罗景慧, 等. 大蒜中含硫氨基酸研究进展[J]. 中草药, 2000, 31(6): 70-72.
[6] 金红芳, 赵曼曼, 耿彬, 等. 内源性含硫氨基酸代谢与心血管损伤和修复[J]. 生理科学进展, 2012, 43(5): 330-333.
[7] 赵国华, 阚建全, 陈宗道. 含硫氨基酸食品功能性[J]. 粮食与油脂, 1999(4): 35-37.
[9] BENAVIDES G A, SQUADRITO G L, MILLS R W, et al. Hydrogen sulfide mediates the vasoactivity of garlic[J]. Proc. Natl. Acad. Sci. U.S.A, 2007(104):17 977-17 982.
[10] 胡兴鹏, 周华, 杜阳敏, 等. 蒜氨酸的热分解及其机理分析[J]. 食品科学, 2017, 38(3): 64-68.
[11] 黄雪松, 陈子兴. 蒜氨酸的热解动力学研究[J]. 食品安全质量检测学报, 2017(3): 930-934.
[12] 李文清, 周华, 胡兴鹏等. 大蒜素和有机溶剂对蒜氨酸酶活性及大蒜油组成的影响[J]. 现代食品科技, 2014, 30(11): 80-83.
[13] KANG S S, LIM D R, KYUNG K H. 3-(allyltrisulfanyl)-2-aminopropanoic acid, a novel nonvolatile water-soluble antimicrobial sulfur compound in heated garlic[J]. Journal of Medicinal Food, 2010, 13(5): 1 247-1 253.
[14] ELKAYAM A, PELEG E, GROSSMAN E, et al. Effects of allicin on cardiovascular risk factors in spontaneously hypertensive rats[J]. Israel Medical Association Journal, 2013, 15(3): 170-173.
[15] KUBEC R, VELISEK J, DOLEZAL M, et al. Sulfur-containing volatiles arising by thermal degradation of alliin and deoxyalliin[J]. Journal of Agriculturaland Food Chemistry, 1997, 45(9): 3 580-3 585.
[16] 杨波, 王树青, 田松柏, 等. 硫醚类硫化物的热解及腐蚀性研究, 石油化工腐蚀与防护, 2010, 27(4): 17-20.
[17] 朱根权, 夏道宏, 阙国和. 含硫化合物热解规律的研究燃料化学学报, 2000, 28(6): 518-521.
[18] YU T H, WU C M, ROSEN R T, et al. Volatile compounds generated from thermal degradation of alliin and deoxyalliin in an aqueous solution[J]. Journal of Agricultural and Food Chemistry, 2010, 1187(1): 370-402.
[19] LEE Y R, LEE Y K, HWANG I G, et al. Optimization of the processing conditions for heated garlic juice by response surface methodology[J]. Journal of Food Science & Nutrition, 2008, 13(4): 334-339.
[20] SHUKLA Y, KALRA N. Cancer chemoprevention with garlic and its constituents[J]. Cancer Letters, 2007, 247(2): 167-181.
[21] AMAGASE H, PETESCH B L, MATSUURA H, et al. Intake of garlic and its bioactive components[J]. Journal of Nutrition, 2001, 131(3s): 955S.
[22] XU X, MIAO Y, CHEN J Y, et al. Effective production of S-allyl-L-cysteine through a homogeneous reaction with activated endogenous gamma-glutamyltranspeptidase in garlic (Allium Sativum)[J]. Journal of Food Science and Technology, 2015, 52(3): 1 724-1 729.
[23] LEE S, YOO M, KIM S, et al. Identification and quantification of S-allyl-l-cysteine in heated garlic juice by HPLC with ultraviolet and mass spectrometry detection[J]. LWT-Food Science and Technology, 2014, 57(2): 516-521.
[24] LAI K C, HSU S C, KUO C L, et al. Diallyl sulfide, diallyl disulfide, and diallyl trisulfide inhibit migration and invasion in human colon cancer colo 205 cells through the inhibition of matrix metalloproteinase-2, -7, and -9 expressions[J]. Environmental Toxicology, 2013, 28(9): 479-488.
[25] KANG S S, LIM D R, KYUNG K H. 3-(allyltrisulfanyl)-2-aminopropanoic acid, a novel nonvolatile water-soluble antimicrobial sulfur compound in heated garlic[J]. Journal of Medicinal Food, 2010, 13(5): 1 247-1 253.
[26] SHIRIN H, PINTO J T, KAWABATA Y, et al. Antiproliferative effects ofS-allylmercaptocysteine on colon cancer cells when tested alone or in combination with sulindac sulfide[J]. Cancer Research, 2001, 61(2): 725-731.
[27] XIAO J, CHING Y P, LIONG E C, et al. Garlic-derived S-allylmercaptocysteine is a hepato-protective agent in non-alcoholic fatty liver disease in vivo animal model[J]. European Journal of Nutrition, 2013, 52(1): 179-191.
[28] CHOI I S, CHA H S, LEE Y S. Physicochemical and antioxidant properties of black garlic[J]. Molecules, 2014, 19(10): 16 811-16 823.
[29] LAWAL A O, LAWAL A F, OLOGUNDUDU A, et al. Antioxidant effects of heated garlic juice on cadmium-induced liver damage in rats as compared to ascorbic acid[J]. Journal of Toxicological Sciences, 2011, 36(5): 549-557.
[30] ELKAYAM A, PELEG E, GROSSMAN E, et al. Effects of allicin on cardiovascular risk factors in spontaneously hypertensive rats[J]. Israel Medical Association Journal, 2013, 15(3): 170-173.
