肉桂醛或柠檬醛调控酵母生长对谷胱甘肽合成的影响
2018-03-16孙怡然万伟建段超刘东国柳艳云段学辉
孙怡然,万伟建,段超,刘东国,柳艳云,段学辉
(南昌大学 食品学院食品科学与技术国家重点实验室,江西 南昌,330047)
还原型谷胱甘肽,即γ-L-谷氨酰-L-半胱氨酰-甘氨酸(glutathione,GSH),是生物体内最丰富的非蛋白巯基化合物[1]。在生物体中,γ-谷氨酰半胱氨酸合成酶(γ-GCS)和谷胱甘肽合成酶(GS)利用ATP能量,能将前体氨基酸谷氨酸、半胱氨酸、甘氨酸催化合成GSH[2-3]。谷胱甘肽具有抗氧化、维持细胞酶活的稳定、参与DNA和蛋白质的合成、抵御内毒素以及自由基对细胞的损害等功能[4-7],在食品中添加GSH,可以提高食品的营养价值,加强风味,防止食品的色泽变化[8];在医药领域中,GSH可以缓解辐射、化疗等对机体造成的副作用,同时对肝病的治疗也具有一定的效果[9-10];在化妆品领域中,GSH可以提高细胞的抗氧化能力,降低色素的积累[11]。然而,众多研究显示酵母细胞难以过量连续合成GSH,其关键原因之一是GSH不能有效分泌到胞外,细胞内积累一定浓度的GSH会对合成限速酶谷氨酰半胱氨酸合成酶的活性产生反馈抑制,限制了细胞内GSH的过量连续合成[12]。
有研究利用物理、化学方法对酵母细胞进行处理,提高细胞的通透性,从改变细胞的传质能力来提高胞内产物的合成水平。段学辉[13]等采用气流干燥、超声、及低浓度甲苯处理酿酒酵母,改善细胞透性,增强了胞内酶的催化合成活性。LI[14]等采用细胞渗透处理结合两步法反应,明显地提高了细胞催化合成GSH的产量。张帅帅[15]等利用40%的乙醇对乳酸克鲁维酵母透性化处理,用于催化合成低聚半乳糖,其产量达到98.93 g/L。说明提高细胞的通透性有助于产物的合成。另外,有机分子肉桂醛、柠檬醛在细胞生长过程中对细胞膜真菌麦角甾醇的合成产生影响,从而调节细胞膜的合成[16-17];而且肉桂醛对β(1,3)-葡聚糖以及几丁质的合成具有抑制作用,影响细胞壁的合成[18]。汪琨[19]等利用去氢木香内酯处理酿酒酵母,发现其对细胞内β-葡聚糖合酶具有一定的抑制作用。一些抗生素如卡泊芬净、尼可霉素以及两性霉素B也有类似的效果[20-21]。
本研究选择在酵母生长培养液中添加一定浓度的有机小分子化合物肉桂醛或柠檬醛,对酵母细胞生长进行调控,影响酵母细胞膜和细胞壁的合成,导致生长酵母的细胞膜和细胞壁结构发生一定变化;并通过考察控制培养细胞酶法合成GSH及细胞外积累能力变化,探讨研究肉桂醛、柠檬醛调控生长对细胞合成GSH的影响。
1 材料与方法
1.1 材料
絮凝酵母(SaccharomycescerevisiaeSP5)为本实验室保藏。谷胱甘肽(GSH)、L-谷氨酸、L-半胱氨酸、甘氨酸、肉桂醛、柠檬醛:阿拉丁试剂有限公司;无水乙醇、六水合氯化镁、磷酸二氢钾、磷酸氢二钾、氢氧化钠、硫酸铵:西陇化工;葡萄糖:天津市大茂化学试剂厂;四氧嘧啶:Maclin。
1.2 方法
1.2.1 GSH测定
采用四氧嘧啶法[22]
1.2.2 细胞培养
参照张倩等[23]培养方法。
种子培养:将斜面种子在30 ℃下活化3 h,取一环至装有50 mL种子培养基的250 mL的锥形瓶中,培养时间24 h,30 ℃温度下,培养24 h,摇床转速180 r/min;
发酵培养:30 ℃ 温度下,培养36 h,摇床转速180 r/min;斜面培养基(g/L):葡萄糖20,酵母粉10,蛋白胨20,琼脂粉20;
种子培养基(g/L):葡萄糖20 ,酵母粉10 ,蛋白胨20 ,培养基初始pH为6.0,灭菌锅压强为0.07 MPa,灭菌时间15 min;
发酵培养基(g/L):葡萄糖35 ,酵母粉10,硫酸铵5,肌醇0.1 ,KH2PO41.5,MgSO4·7H2O 0.5,培养基初始pH为6.0,灭菌锅压强为0.07 MPa,灭菌时间15 min;
1.2.3 细胞干重(DCW)测定
将发酵液在8 000 r/min下离心10 min,去除上清液,并用无菌水清洗3次,离心收集菌体,于75 ℃下烘干至恒重。
1.2.4 调控生长改善细胞传质能力
在发酵培养初期加入一定浓度的肉桂醛或柠檬醛,调控生长培养36 h。
1.2.5 生长调控结合分段培养方式考察酵母细胞的GSH合成能力
在发酵培养初期加入一定浓度的肉桂醛或柠檬醛,调控生长培养24 h后停止摇床,补加一定浓度葡萄糖后静态调控培养12 h,比较组合调控培养细胞GSH合成能力的变化。
1.2.6 细胞酶催化合成GSH
参照CHEN等[24]的方法,取2 g湿酵母,加入10 mL酶反应液,加入150 mL的摇瓶中,于37 ℃,转速180 r/min,恒温震荡培养6 h,检测GSH合成量。
酶反应液(mmol/L):葡萄糖400,L-Cys 15,L-Gly 40,L-Glu 20,MgCl2·6H2O,反应液用pH为7.0 的柠檬酸缓冲液配置。
1.3 酶法总GSH计算方法
总GSH=胞外GSH+胞内GSH
2 结果与讨论
2.1 发酵培养中酵母细胞生长及胞内GSH的合成
按照酵母培养条件发酵培养40 h,每4 h取样收集细胞,测定培养液中生长的细胞浓度(DCW)和胞内GSH合成情况,结果如图1所示。

图1 酵母生长及细胞内GSH含量变化Fig.1 The change of growth and intracellular GSH concentration of yeast
由图1可以看出,发酵培养的前16 h内,发酵液中细胞浓度以及生长细胞内GSH含量快速增加,培养到24 h后,细胞量增长缓慢,在培养到36 h,发酵液中的生物量及其细胞内的GSH含量达到最高,分别为8.09 g/L和44 mg/L;在酵母培养的发酵液中,基本检测不到GSH的存在,表明胞内GSH无明显分泌。
2.2 肉桂醛及柠檬醛对酵母细胞的生长和GSH合成的影响
在细胞发酵初期,分别添加0、15、30、45、60、75、90 μg/mL的肉桂醛,质量浓度为0、20、40、60、80、100、150、200、250 μg/mL的柠檬醛,发酵36 h后,收集细胞,检测细胞内外GSH含量以及细胞干重,结果如图2、3所示。
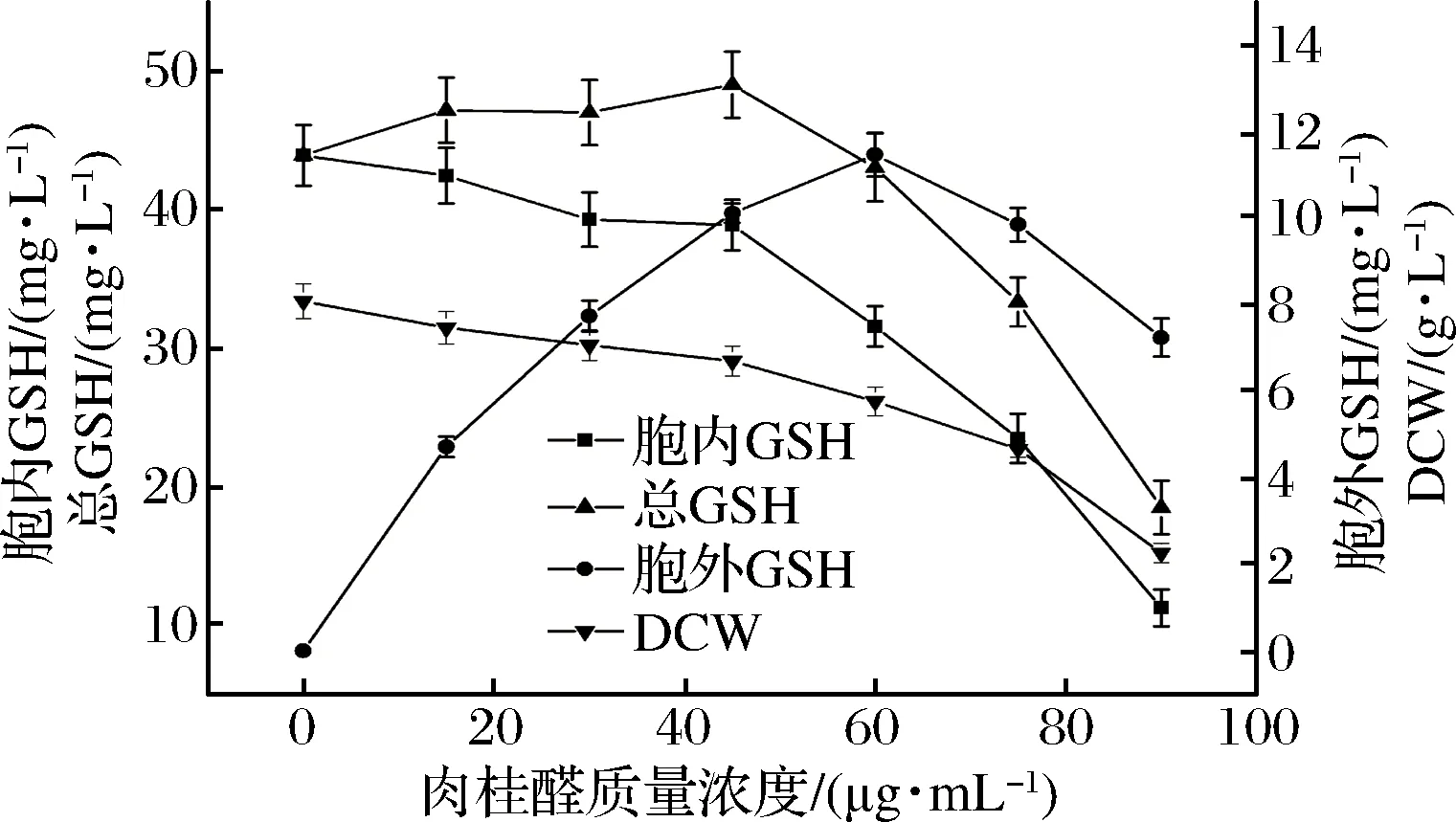
图2 不同浓度肉桂醛调控酵母的生长和GSH合成Fig.2 Different concentrations of cinnamaldehyde regulate the growth ofyeast and synthesis of GSH
从图2中可以看出,随着肉桂醛添加浓度的增加,细胞生长受到抑制,生长酵母细胞的干重逐渐降低;肉桂醛调控培养细胞合成GSH,随着其调控浓度的增加,胞内合成积累的GSH含量呈下降趋势,而细胞发酵液中合成的GSH含量逐渐增加,当肉桂醛浓度高于60 μg/mL后,发酵液中合成的GSH含量逐渐降低;在低浓度的肉桂醛浓度调控下培养的细胞合成GSH的总量有所提高,但不明显,继续提高肉桂醛的调控浓度,培养细胞的浓度和合成GSH的胞内外含量都呈现下降。这可能与细胞生长受到抑制,生长细胞膜合成受阻或结构过度破坏相关。同样从图3中可以看出,与肉桂醛相似,随着柠檬醛调控浓度的增加,培养细胞的浓度、胞内GSH含量都出现下降,而分泌到胞外的GSH浓度逐渐升高;当柠檬醛调控浓度高于140 μg/mL后,培养细胞合成GSH的分泌量快速下降,细胞生长受到抑制生物量明显下降;

图3 不同浓度柠檬醛调控酵母的生长和GSH合成Fig.3 Different concentrations of citral regulate the growth of yeast and synthesis of GSH
结果表明,利用肉桂醛或柠檬醛调控生长,对培养细胞合成GSH的分泌能力有一定促进作用,低浓度的肉桂醛对细胞进行调控后,细胞GSH合成总量没有明显提高,继续提高浓度,细胞GSH合成总量下降,而柠檬醛的调控,细胞GSH合成总量下降,这可能与细胞生长受到抑制,细胞浓度降低相关。
2.3 肉桂醛、柠檬醛调控生长对细胞酶催化合成GSH的影响
收集分别经过15、30、45、60、75、90 μg/mL浓度的肉桂醛,或20、40、60、80、100、120、140 μg/mL浓度的柠檬醛调控生长的培养酵母,取2 g湿细胞,加入10 mL酶反应液中,于37 ℃,180 r/min,进行酶催化合成GSH,反应6 h,检测细胞内外GSH的含量,结果如图4和图5所示。
从图4可以看出,经过一定浓度肉桂醛或柠檬醛调控生长的酵母,细胞酶催化合成反应液中GSH浓度逐渐提高,催化细胞胞内积累GSH量以及酶法合成反应得到的总GSH量也有所提高;当肉桂醛调控浓度高于60 μg/mL,培养细胞催化合成反应胞内积累GSH浓度明显下降,但合成反应生成的总GSH量趋于平稳;从图5看出,柠檬醛调控浓度高于40 μg/mL时,生长细胞催化合成反应分泌胞外反应液中的GSH量继续增长,而胞内积累的GSH量逐渐降低;柠檬醛调控浓度达到100 μg/mL时,生长细胞催化合成的GSH总量达到相对高值410 mg/L。综合考虑调控生长的细胞生物量和培养细胞的酶催化合成GSH的效率,45 μg/mL浓度肉桂醛调控细胞生长较为合理,培养细胞酶催化合成GSH达到446 mg/L。

图4 不同浓度肉桂醛调控生长细胞酶催化合成GSHFig.4 Enzymatic synthesis of GSH by yeast cells regulated with different concentration of cinnamyl aldehyde

图5 不同浓度柠檬醛调控生长细胞酶催化合成GSHFig.5 Enzymatic synthesis of GSH by yeast cells regulated with different concentration of citral
2.4 培养模式对细胞生长和合成GSH影响
选用葡萄糖作为碳源,初始发酵液葡萄糖的添加量为45 g/L,摇瓶装液量为70 mL/250 mL,在细胞生长到24 h后停止震荡、补糖及控氧发酵,研究不同模式发酵对细胞生长及其GSH合成能力的影响。实验操作按以下模式:1. 空白;2. 培养24 h后添加25 g/L的葡萄糖,摇床继续运转;3. 培养24 h后添加25 g/L的葡萄糖,静止培养;4. 培养24 h后添加25 g/L的葡萄糖,静止密封厌氧培养;5. 培养24 h后添加25 g/L的葡萄糖,低速(接近0)控温(30 ℃)培养。后期继续培养12 h,离心收集细胞,检测生物量和细胞GSH合成能力。实验结果如图6和图7所示。

图6 不同发酵模式对细胞生长和合成GSH能力的影响Fig.6 Effects of different fermentation modes on cell growth and synthesis of GSH
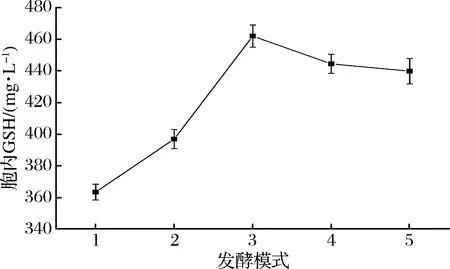
图7 不同发酵模式培养的细胞酶催化合成GSH的能力Fig.7 Enzymatic synthesis of GSH by yeast cells cultured in different fermentation modes
从图6和图7中可以看出,补加葡萄糖操作对培养细胞的生长及其GSH的合成都具有一定的促进作用;发酵过程摇床停止对细胞的生长一定的抑制,细胞发酵合成GSH的量有所降低,但培养细胞酶催化合成GSH的能力提高了,结果显示,发酵培养24 h后补加葡萄糖并静止培养,生长细胞进行酶催化合成GSH的能力相对明显较高,其合催化成量达GSH量达到461 mg/L。
2.5 佳选发酵模式结合肉桂醛或柠檬醛调控对细胞生长及其合成GSH的影响
酵母发酵之前,向培养液中分别加入30、45、60、75、90、105 μg/mL浓度的肉桂醛,或加入60、80、100、120、140、160 μg/mL浓度的柠檬醛,选择发酵模式3结合调控生长培养细胞,研究其对细胞的生长、培养细胞的GSH合成能力的影响。实验结果如图8和图9所示。
由图8和图9可以看出,肉桂醛或柠檬醛调控结合发酵模式3培养,随着调控试剂浓度的增加细胞生长生物量呈下降趋势,培养细胞的GSH分泌能力逐渐增强;当肉桂醛调控浓度高于75 μg/mL,或柠檬醛调控浓度高于120 μg/mL,发酵液中分泌的GSH浓度逐渐降低,培养细胞合成GSH量总体呈下降趋势,与生长细胞的生物量减少成正相关。因此综合优化前后发酵法合成GSH的情况,可以看出,通过利用肉桂醛、柠檬醛调控细胞壁、细胞膜的合成,从而提高细胞的传质能力的方法,由于细胞生物量的限制,对于促进发酵法合成GSH的效果不明显。

图8 肉桂醛调控结合模式3培养酵母细胞的生长和GSH合成Fig.8 The growth and GSH synthesis of yeast cells regulated by cinnamyl aldehyde cultured in mode 3

图9 柠檬醛调控结合模式3培养酵母细胞的生长和GSH合成Fig.9 The growth and GSH synthesis of yeast cells regulated by citral cultured in mode 3
2.6 佳选发酵模式结合肉桂醛、柠檬醛调控生长对细胞酶催化合成GSH的影响
收集分别经过15、30、45、60、75、90 μg/mL浓度的肉桂醛,或20、40、60、80、100、120、140 μg/mL浓度的柠檬醛在发酵模式三下培养的酵母细胞,取2 g湿细胞,加入10 mL酶反应液中,于37 ℃,进行酶催化合成GSH,反应6 h,检测细胞内外GSH的含量,结果如图10和图11所示。
从图10可以看出,在佳选模式下,经过一定浓度肉桂醛或柠檬醛调控生长的酵母,细胞酶催化合成反应液中GSH浓度逐渐提高,催化细胞胞内积累GSH量以及酶法合成反应得到的总GSH量也有所提高;当肉桂醛调控浓度达到60 μg/mL,培养细胞催化合成反应胞内积累GSH浓度明显下降,但合成反应生成的总GSH量趋于平稳;从图11看出,柠檬醛调控浓度达到60 μg/mL后,生长细胞催化合成反应分泌胞外反应液中的GSH量继续增长,胞内积累的GSH量变化不大,酶法合成反应的总GSH量有所提高;柠檬醛调控浓度超过100 μg/mL后,生长细胞催化合成反应胞内GSH积累量和总GSH量显著下降。在佳选模式下,选用肉桂醛或柠檬醛调控细胞的生长,综合考虑调控生长的细胞生物量和培养细胞的酶催化合成GSH的效率,45 μg/mL浓度肉桂醛或100 μg/mL的柠檬醛调控细胞生长较为合理,培养细胞酶催化合成GSH分别达到580 mg/L和551 mg/L,相较未处理细胞分别提高了107%和96.8%。

图10 肉桂醛调控结合模式3培养酵母细胞催化合成GSHFig.10 Enzymatic synthesis of GSH by yeast cells regulated by cinnamyl aldehyde and cultured in mode 3

图11 柠檬醛调控结合模式3培养酵母细胞催化合成GSHFig.11 Enzymatic synthesis of GSH by yeast cells regulated by citral and cultured in mode 3
3 结论
肉桂醛、柠檬醛对酵母细胞壁、膜的合成具有一定的调节作用。本研究利用肉桂醛和柠檬醛对酵母细胞进行生长调控,考察在肉桂醛或柠檬醛添加后,酵母细胞的生长和合成GSH的情况,以及经过肉桂醛或柠檬醛调控生长的细胞酶催化合成GSH的效率;选择发酵培养模式,结合肉桂醛、柠檬醛调控生长,考察细胞的生长和GSH的合成,以及调控生长细胞酶催化合成GSH的能力。结果显示,合适培养模式结合肉桂醛或柠檬醛调控生长培养细胞,其催化合成GSH的浓度分别达到580 mg/L和551 mg/L,相较未处理细胞的合成能力分别提高107%和96.8%。同时看到,进行调控生长细胞培养中,发酵液中细胞分泌GSH量有所提高,细胞的生长受到一定抑制;调控生长细胞酶催化合成GSH能力和分泌的反应液中的量明显高于对照细胞。这表明一定浓度的有机小分子化合物肉桂醛或柠檬醛,会影响酵母细胞的生长和细胞膜、壁的合成,导致生长酵母的细胞膜、壁结构发生变化,改善细胞的GSH分泌能力,从而影响细胞的GSH合成的效率。
[1] MEISTER A, ANDERSON ME . Glutathione[J]. Annual Review of Biochemistry, 1983,52(6):711-760.
[2] MEISTER A. Glutathione metabolism and its selective modification [J]. Journal of Biological Chemistry, 1988, 263(33):17 205-17 208.
[3] VMUSATTI A, MANZONI M, ROLLINI M. Post-fermentative production of glutathione by baker's yeast (S.cerevisiae) in compressed and dried forms[J].New Biotechnology, 2013, 30(2): 219-226.
[4] HARRIS IS, TRELOAR A E, INOUE S, et al. Glutathione and thioredoxin antioxidant pathways synergize to drive cancer initiation and progression[J]. Cancer cell, 2015, 27(2): 211-222.
[5] PENNINCKX M J, ELSKENS M T. Metabolism and functions of glutathione in micro-organisms [J]. Advances in microbial physiology, 1993, 34: 239-301.
[6] OZER H K. The role of intermembrane space redox factors in glutathione metabolism and intracellular redox equilibrium[D]. University of South carolina, 2015.
[7] KOJER K, BEIN M, GANGEL H, et al. Glutathione redox potential in the mitochondrial inntermembrane space is linked to the cytosol and impacts the Mia40 redox state [J]. Embo Journal, 2012, 31(14):3 169-3 182.
[8] 沈亚领,李爽,池莉丽等.谷胱甘肽的应用与生产[J].工业微生物,2000,30(2):41-45.
[9] 钱屹崟, 徐新才,.邵利坚等.还原型谷胱甘肽减轻化疗毒副反应的疗效观察[J].现代肿瘤医学, 2008,16(2):286-288.
[10] 高健, 吴显才, 李孝生等.还原性谷胱甘肽治疗酒精肝病研究[J]. 世界华人消化杂志, 002,10(7): 809-811
[11] 杜登学, 王珊珊, 周磊. 肽类在化妆品中的应用[J].山东轻工业学院学报,2012,26(1):35-39.
[12] RICHMAN PG,MEISTER A.Regulation of gamma-glutamy-cystein synthetase by nonallosteric feedback inhibition by glutathione[J].Journal of Biological Chemistry,1975,250(4): 1 422-1 426.
[13] 段学辉, 叶勤, 张嗣良. 啤酒酵母的通透性对ATP 生产活性的影响[J].华东理工大学学报,2000,26( 1) : 33-36.
[14] LI Wei, LI Zhi-min, YE Qin. Enzymatic synthesis of glutathione using yeast cells in two-stage reaction[J]. Bioprocess and Biosystems Engineering,?2010 , 33 (6) :675-682.
[15] 张帅帅, 王梦凡, 刑肖肖等.乳酸克鲁维酵母透性化细胞β-半乳糖苷酶催化合成低聚半乳糖[J]. 南开大学学报(自然科学版),2013,46(5):99-105.
[16] 王贵强, 孙莎莎, 范开.柠檬醛肉桂醛丁香酚抑制耐氟康唑白色念珠茵机理的试验[J].中国兽医杂志,2013,49(1):69-71.
[17] 谢小梅, 张文平, 付颖瑗等.肉桂醛与柠檬醛抗曲霉菌作用机制的研究[J].中草药,2004,35(4):430-432.
[18] BANG K H, LEE D W, PARK H M, et al. Inhibition of fungal cell wall synthesizing enzymes by trans-cinnamaldehyde.[J]. BioscienceBiotechnology and Biochemistry, 2000, 64(5):1061-1063.
[19] 汪琨, 徐峥, 朱廷恒等. 去氢木香内酯特异性抑制Saccharomycescerevisiae细胞壁中β-葡聚糖的合成[J]. 食品与发酵工业, 2013,39(10):29-33.
[20] 车斌, 谢为民.抗真菌药物的分类及研究进展概述[J]. 海峡药学.2008,20(12):111-114.
[21] CHUDZIK B,KOSELSKI M,CZURYO A,et al,A new look at the antibiotic amphotericin B effect onCandidaalbicansplasma membrane permeability and cell viability functions [J].Eur Biophys J,2015,44(1-2):77-90.
[22] LIU Juan, WANG Ya-qin, LIU Gang,et,al. Comparation of three methods for determination of glutathione[J]. Journal of Beijing University of Chemical Technology, Natural Science Edition,2004,31(3):35-38.
[23] 张倩, 段超, 牛书操等. 环境因子对发酵液中谷胱甘肽稳定性的影响[J].中国酿造,2016,35(8):48-52.
[24] CHEN Jia-li, XIE Liang, CAI Jing-jing, et al, Enzymatic synthesis of glutathione using engineeredSaccharomycescerevisiae[J]. Biotechnology Letters , 2013 , 35(8):1 259-1 264.
