545例新的、严重的药品不良反应报告
2018-03-14谢洁洁许鲁宁
谢洁洁,许鲁宁
(福建医科大学附属三明第一医院药学部,福建 三明 365000)
近年来,人们的健康意识不断加强,医疗机构对临床安全用药的重视度不断提高,我国的药品不良反应(adverse drug reaction,ADR)报告和监测工作也不断发展。新的、严重的ADR是影响公众用药安全的最重要信息。新的ADR可预见性差,发生后若不进行正确处理可能造成极大危害。严重的ADR可对患者身体健康和生命安全造成危害,应引起足够重视。本研究采用回顾性分析方法,对福建医科大学附属三明第一医院(以下简称“我院”)近年来上报的新的、严重的ADR进行汇总,并结合相关文献分析,探讨其发生特点,旨在为临床安全用药提供参考。
1 资料与方法
1.1 资料来源
2013—2016年我院上报至国家ADR/药品不良事件监测网,并经过福建省ADR监测中心评价确认的新的、严重的ADR报告共545例,其中新的ADR报告371例(占68.07%),严重的ADR报告174例(占31.93%)。
1.2 判定标准
国家食品药品监督管理总局2011年颁布实施的《药品不良反应报告和监测管理办法》规定:新的ADR是指药品说明书中未载明的不良反应;说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的ADR处理。严重的ADR是指因使用药品引起以下损害情形之一的反应:导致死亡;危及生命;致癌、致畸和致出生缺陷;导致显著的或者永久的人体伤残或者器官功能的损伤;导致住院或者住院时间延长;导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
1.3 方法
依据世界卫生组织ADR术语集,对ADR名称进行规范和完善,依据《中华人民共和国药典·临床用药须知:化学药和生物制品卷》(2010年版)[1]、《中华人民共和国药典·临床用药须知:中药卷》(2010年版)[2],规范化学药及中药名称并分类。将所筛选的新的、严重的ADR数据录入Excel软件,并根据性别、年龄、药物种类、给药途径、联合用药、累及器官和(或)系统及转归等进行归类统计、分析。
2 结果
2.1 ADR类型及联合用药情况分布
新的ADR报告371例(占68.07%),严重的ADR报告174例(占31.93%);22例存在联合用药情况,见表1。

表1 ADR类型及联合用药情况分布Tab 1 Distribution of types of ADR and drug combination
2.2 发生ADR患者的性别与年龄分布
545例ADR报告中,男性患者252例(占46.24%),女性患者293例(占53.76%);年龄36 d~89岁,≥70岁者最多,见表2。

表2 发生ADR患者的性别与年龄分布Tab 2 Distribution of gender and age in new/severe ADR cases
2.3 引发ADR的给药途径分布
静脉滴注致ADR病例数最多,有362例(占66.42%),其次为口服给药(95例,占17.43%),见表3。
2.4 引发ADR的药物种类分布
545例ADR主要由22类165种药品引起,其中,抗感染药、心血管系统药引发的ADR病例数最多,见表4。

表3 引发ADR的给药途径分布Tab 3 Distribution of ADR-inducing route of administration
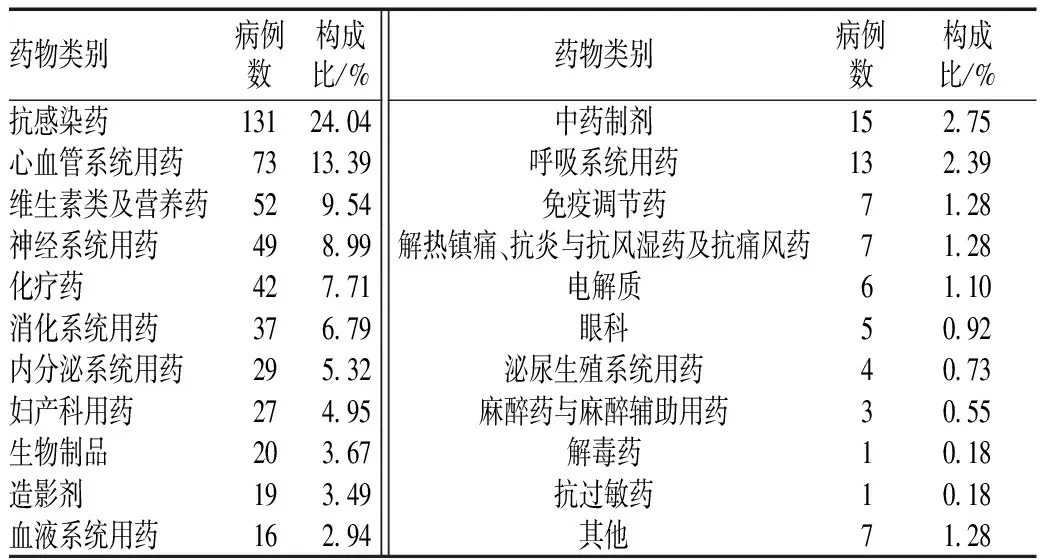
表4 引发ADR的药物种类分布Tab 4 Distribution of ADR-inducing drug categories
2.5 引发ADR的抗感染药种类分布
抗感染药引起131例ADR,主要涉及氟喹诺酮类,其次为头孢菌素类,见表5。

表5 引发ADR的抗感染药种类分布Tab 5 Distribution of ADR-inducing anti-infectious drugs categories
2.6 ADR累及器官和(或)系统及主要临床表现
ADR主要累及皮肤及其附件、呼吸系统及全身,见表6。
2.7 ADR转归及对原患疾病的影响
545例ADR报告中,痊愈16例(占2.94%),好转517例(占94.86%),导致后遗症1例(占0.18%),不详8例(占1.47%),未好转3例(占0.55%),无死亡病例。

表6 ADR累及器官和(或)系统及主要临床表现Tab 6 ADR involved organs and (or) systems and main clinical manifestations
3 讨论
3.1 ADR与患者年龄及性别的关系
由表2可见,我院女性ADR患者略多于男性,儿童发生ADR的比例未凸显,表明我院在儿童用药方面较谨慎。≥60岁人群所占比例最高,为51.92%。不同年龄的患者,其生理、病理特点不同,药物在体内的转化过程也有所不同,因而ADR的发生率不同。由于高龄患者的肝肾功能减退,对药物的代谢和排泄能力降低,易导致血药浓度升高,其ADR发生率较高。因此,对高龄患者应注重个体化给药,合理选择药物并制订合适的给药方案,且应参考药动学相关知识,确定给药剂量对肝肾功能的影响。
3.2 ADR与给药途径的关系
545例新的、严重的ADR 报告中,静脉给药致ADR病例数最多。其原因主要是:(1)静脉给药通常在医院进行,能对其ADR进行监测;而口服给药大部分为门诊患者,通常不在院内,无法监测其ADR,故报告例数与实际发生例数存在差异。(2)静脉滴注的药物直接进入血液循环,避免了肝脏首关效应,起效迅速,增加了ADR发生的可能性[3]。(3)注射剂的稳定性、pH及渗透压等诸多因素都可能导致ADR的发生。因此,临床在治疗过程中应遵循“能口服不肌内注射,能肌内注射不静脉用药”的原则,选择适当的剂型与给药途径。而对老年患者、婴幼儿等特殊人群更应予以重视,因其合并慢性疾病较多,联合用药种类多,生理机能已改变或不够完善,均有可能增加ADR的发生概率和程度。
3.3 ADR与药物种类的关系
545例ADR中,由抗感染药引起的ADR最多(131例,占24.04%)。其中氟喹诺酮类所占比例最大(38.93%),其次是头孢菌素类(25.95%),与张娟等[4]的研究结果一致。这2类抗感染药的使用量在我院抗感染药中一直居前列。其原因可能是:(1)我院应用这2类抗感染药的品种较多,且与就诊患者所患疾病有关。(2)患者本身对某些抗感染药过敏。(3)抗感染药几乎都有毒性,易引起不良反应。因此,临床中应用抗感染药前应特别注意患者的既往同类药物过敏史。应用抗感染药时要密切观察,特别是给药后的30 min内,并应持续观察1~3 d。
氟喹诺酮类抗菌药物从发现到合成已发展了几十年,其抗菌活性和药动学特点不断改善,毒性不断降低[5]。意大利的数据库统计发现,在氟喹诺酮类药物中莫西沙星的ADR发生率最高[6],与我院莫西沙星引起新的、严重的ADR病例数最多(32例)相符。莫西沙星属第4代氟喹诺酮类抗菌药物,抗菌谱广,临床上用于治疗急性窦腺炎、慢性支气管炎的急性发作、社区获得性肺炎及无并发症的皮肤感染和软组织感染等,应用广泛,但ADR也日趋增多[7]。我院莫西沙星引起新的、严重的ADR主要表现为中枢神经系统毒性(精神行为异常和意识障碍)、心血管系统损害、骨髓抑制(血小板计数降低、白细胞计数降低)及肝损害等。莫西沙星导致中枢神经系统毒性较为常见,是由于该药能拮抗大脑内部γ-氨基丁酸与受体的结合,而γ-氨基丁酸属抑制性的神经递质,当其含量降低或产生拮抗,易导致多种神经精神症状的发生。同时,莫西沙星的脂溶性强,具有很强的组织穿透力,能直接突破血-脑脊液屏障,进入大脑内部。若脑组织中的血药浓度高于正常水平,对γ-氨基丁酸与受体结合的拮抗作用增强,可加重神经精神症状[8]。我院莫西沙星致严重神经系统损害的患者均>70岁,这可能为老年人肝肾功能减退,药物在体内代谢、排泄速度减慢所致。因此,有神经系统疾病、肝肾功能减退者及高龄老年患者应慎用莫西沙星。莫西沙星可引起心血管系统损害,使心电图Q-T间期延长,且延长的程度随着药物浓度增大而增加。这可能是由于药物进入心肌细胞后,阻断心肌细胞中的钾离子通道,抑制延迟复极,从而延长Q-T间期,导致心律不齐[9]。因此,患有冠心病、心律失常等的老年患者应用莫西沙星时,应监测心电图和电解质水平,且给药期间应避免使用其他可影响Q-T间期的药物;若发现心电图异常,应立即停药[10]。同时,既往病史有Q-T间期延长、反复的低血钾及接受Ⅱ或Ⅲ类抗心律失常药治疗的中老年患者,需慎用莫西沙星,应注意剂量合理,并严格控制滴注时间[11]。此外,由于氟喹诺酮类抗菌药物中活性基团极易与高价金属阳离子结合,使药物活性下降,在临床治疗中也应尽量避免与含有高价金属阳离子药物联合应用[12]。
头孢菌素类属于β-内酰胺类抗菌药物,我院以注射剂居多,头孢唑肟致ADR病例数最多,其次是头孢哌酮舒巴坦,主要表现为胸闷、血小板计数降低及过敏性休克等。其中,胸闷可能是发生心血管不良反应的表现。而药物导致血小板计数降低的机制目前仍不明确。药源性血小板减少症可能的发病机制主要有3种:免疫性血小板减少症、非免疫性血小板减少症和骨髓抑制性血小板减少症,其中免疫介导机制的较为常见[13]。头孢菌素类药物可能是通过免疫机制引起血小板计数降低,即药物进入体内作为半抗原,产生免疫性抗原抗体复合物,非特异性地吸附在血小板膜上,破坏血小板;或药物进入体内作为半抗原,结合血小板形成全抗原,导致血小板抗体产生,破坏血小板,进而导致血小板计数降低[14]。过敏性休克,一方面可能是药品成分混有其他杂质,或其代谢产物与体内蛋白等大分子载体发生不可逆的结合,引起抗原-抗体反应;另一方面,患者用药的过程中联合应用其他能使药物pH升高的药物时,也能加快内源性聚合的速度,发生过敏反应[15]。过敏性休克是头孢菌素致死的主要原因,也是抗菌药物导致药源性死亡的首要原因[16]。有文献报道[17],在临床上未根据患者实际情况给药、对药理药性掌握不够和不合理用药等是头孢菌素类抗菌药物引发ADR的原因。因此,临床上应全面掌握各类抗菌药物的适用范围;注意患者有无用药过敏史,对无过敏史、无用药史的患者应做皮试;对于通过静脉滴注给药的患者,给药前10 min是防范与发现过敏性休克的重点时段,应注意做好防范。
3.4 ADR与联合用药的关系
545例新的、严重的ADR报告中,22例(占4.04%)存在联合用药的情况。联合用药易引起药物相互作用,例如肝药酶抑制剂可导致其他药物代谢减慢,导致血药浓度升高而引发ADR。临床由于患者情况需联合用药时,应注意间隔给药,尽量避免药物相互作用。在临床查房过程中发现很多ADR均存在联合用药的情况但上报时未作详尽描述,还需进一步加强ADR上报的详尽程度。
3.5 ADR累及器官和(或)系统
545例新的、严重的ADR主要累及皮肤及其附件、呼吸系统、全身及消化系统。皮肤及其附件损害最为常见且易于观察,有的药物本身为全抗原,有的为半抗原,进入人体后经抗原-抗体反应易引起变态反应,但一些隐藏的不良反应如肝肾损害只有在造成严重损害并出现症状之后才被发现,这些更应引起注意。严重的ADR多表现为过敏性休克、过敏样反应、呼吸困难、寒战、发热、胃肠道出血和骨髓抑制等。严重的ADR大多突然发生,尤其是许多注射给药患者易在给药5 min内发生过敏性休克。因此,医务人员要提高警惕,加强用药监测和护理,及时发现,及早干预和处理。
3.6 ADR的转归
545例新的、严重的ADR中,好转及治愈533例(占97.80%),表明如果处理及时,严重的ADR转归较好。另一方面也说明我院对新的、严重的ADR的处理积累了大量的经验,操作已经比较规范,在很大程度上提高了ADR中的好转率及治愈率。
4 结论
本研究采用统计学手段,对我院2013—2016年收集的新的、严重的ADR进行回顾性分析。结果显示:所有引起ADR的药物中抗感染药所占比例最大,并且以氟喹诺酮类及头孢菌素类居前列;静脉给药和口服给药是最主要的给药途径;临床表现涉及最多的是皮肤及其附件损害、呼吸系统损害。应根据上述特点,针对性地开展ADR监测工作,即进一步加强对抗感染药的安全性监测;注意药物剂型及用药途径的选择等。虽然本调查仅包含我院近4年新的、严重的ADR数据,具有一定的局限性,但也应引起高度重视。临床医师在选择抗菌药物时,应遵循《抗菌药物临床应用指导原则(2015年版)》及《抗菌药物临床应用管理办法》,并结合药动学和药效学、患者生理病理情况及检验结果等制订合理的给药方案,注意药物的用法与用量,静脉用药时应控制滴速,不宜过快。对于老年人、婴幼儿等特殊患者,应综合考虑,给予个体化用药,尽量避免和减少ADR的发生。
综上所述,新的、严重的ADR是监测的重点,其不断完善需要广大医务工作者的共同努力。
[1]国家药典委员会.中华人民共和国药典临床用药须知:中药卷[S].2010年版.北京:人民卫生出版社,2010.
[2]国家药典委员会.中华人民共和国药典临床用药须知:化学药和生物制品[S].2010年版.北京:人民卫生出版社,2010.
[3]徐晓华.2012年我院173例药物不良反应报告分析[J].中国实用医药,2014,9(34):11-13.
[4]张娟,熊永山,王登峰,等.武汉市2010年5252例药品不良反应报告分析[J].中国药房,2012,23(2):153-156.
[5]Kaminski N,Allard J,Heller RA.Use of oligonucleotide arrays to ana-lyze drug toxicity[J].Ann N Y Acad Sci,2000,919:1-8.
[6]Lapi F,Tuccori M,Motola D,et al.Safety profile of the fluoro-quinolones:analysis of adverse drug reactions in relation to presc-ription data using four regional pharmacovigilance databases in Italy[J].Drug Saf,2010,33(9):789-799.
[7]Knowles SR, Uetrecht J,Shear NH.Idiosyncratic drug reactions: the reactive metabolite syndromes[J].Lancet,2010,356(9241):1587-1591.
[8]刘宪军.1824例莫西沙星不良反应报告分析[J].中国药业,2015,24(13):56-58.
[9]陈国英.莫西沙星药物不良反应分析[J].中国药业,2011,20(5):58-59.
[10] 苏克剑,金冠钦,孙黎.莫西沙星不良反应文献分析[J].药物流行病学杂志,2012,21(7):349-351.
[11] 陈崇泽.长乐市医院莫西沙星致心血管不良反应分析[J].现代药物与临床,2013,28(6):988-991.
[12] 王希斌,黄振光,刘滔滔,等.我院776例药品不良反应报告分析[J].中国药房,2013,24(30):2850-2852.
[13] 杨九一,顾健.药源性血小板减少症机制研究进展[J].中国医院药学杂志,2013,33(22):1874-1877.
[14] 朱颖辉.头孢唑肟钠引起急性血小板减少[J].中国药物应用与监测,2011,8(6):389-390.
[15] 黄雅珍.头孢菌素类药物不良反应发生原因分析[J].世界最新医学信息文摘:连续型电子期刊,2015,15(91):146.
[16] 范铭.头孢菌素类药物不良反应文献分析[J].中国药物警戒,2012,9(2):119-123.
[17] 万里,李彩云,贾凤彬,等.第3代头孢类抗生素治疗老年细菌性感染126例效果观察[J].临床合理用药杂志,2012,5(22):78-79.
