顶空气相色谱法测定生脉注射液中乙醇残留量
2018-03-14龚源,吴杰
龚 源,吴 杰
(复旦大学附属金山医院药剂科,上海 201508)
生脉注射液由红参、麦冬和五味子的提取物配制而成,是临床常用补益类中药制剂,具有扩张血管、增加冠状动脉流量、强心、升高血压、抗休克、抗心绞痛及对化疗药进行增效减毒等作用[1-2]。在制备过程中,药味经水提醇沉、溶剂回收等步骤,乙醇难以避免地残留在制剂中,并随着临床使用进入患者静脉,增加不良反应发生概率,并可能对患者造成严重毒害[3]。生脉注射液中乙醇残留量的检测方法未见相关文献报道,本研究根据国际人用药品注册技术协调会指导原则[4]及《中华人民共和国药典》[5]的相关要求,采用顶空气相色谱法测定生脉注射液中乙醇残留量,现报告如下。
1 材料
1.1 仪器
Agilent 7890A气相色谱仪,FID检测器;Agilent 7694型顶空进样器;Agilent Chemstation工作站;均购自安捷伦科技(中国)有限公司。
1.2 药品与试剂
生脉注射液(上海和黄药业有限公司,批准文号:国药准字Z31020241,批号:SM120601、SM120602、SM120603、SM120604、SM120605和SM120606);无水乙醇(上海凌峰化学试剂有限公司,色谱纯,批号:090625);水为去离子水。
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱为HP-5柱(30 m×0.32 mm,0.25 μm);载气为氮气,流速为1 ml/min;分流比为1 ∶1;氢气40 ml/min,空气40 ml/min;检测器温度250 ℃;进样口温度200 ℃;恒温50 ℃保持6 min。顶空进样:平衡温度80 ℃,平衡时间10 min,进样量1 ml。对照品乙醇峰理论塔板数≥160 000,样品乙醇峰与相邻峰的分离度≥3.0。
2.2 溶液的制备
2.2.1 对照品溶液的制备:精密量取无水乙醇,加去离子水配制成浓度为0.01%(V/V)的对照品溶液。移取该溶液1 ml,置于20 ml顶空瓶中,密封。
2.2.2 供试品溶液的制备:精密量取生脉注射液1 ml,置于20 ml顶空瓶中,密封。
2.3 色谱条件考察
2.3.1 顶空平衡时间:按“2.1”项下色谱条件,选用0.01%乙醇对照品,在不同顶空平衡时间(5、10、20和30 min)下进行测定,记录色谱图,考察顶空平衡时间对乙醇色谱响应的影响。结果表明,平衡时间5 min不足以令乙醇在气液两相中分配平衡,而10、20和30 min时乙醇响应值相近,10 min足以令乙醇在两相中分配平衡,故顶空平衡时间选择10 min,见表1。

表1 不同顶空平衡时间对响应值的影响Tab 1 Effects of different headspace equilibrium time on chromatographic response
2.3.2 分流比:按“2.1”项下色谱条件,选用0.01%乙醇对照品,在不同分流比条件下(1 ∶1、1 ∶2、1 ∶10和1 ∶20)进行测定,记录色谱图,考察分流比对乙醇响应值的影响。结果表明,分流比在1 ∶1~1 ∶20之间的乙醇响应值基本一致,但本方法适用于样品中残留溶剂微量的检测,故选择更高进样量的1 ∶1,见表2。

表2 不同分流比对响应值的影响Tab 2 Effects of different split ratio on chromatographic response
2.3.3 柱温:按“2.1”项下色谱条件,选用供试品溶液,在不同柱温条件下(40、50和80 ℃)进行测定,记录色谱图,考察柱温对乙醇与相邻易干扰峰的分离比的影响。结果表明,柱温40 ℃时,乙醇与相邻两峰的分离度高,但后出峰的峰形较差且运行时间偏长,而柱温80 ℃时,乙醇峰与相邻两峰不能基线分离,故选择50 ℃作为柱温,见图1、表3。

表3 不同柱温对色谱分离度的影响Tab 3 Effects of different column temperature on chromatographic resolution
2.3.4 载气流速:按“2.1”项下色谱条件,选用供试品溶液,在不同载气流速条件下(1.0、2.0和2.5 ml/min)进行测定,记录色谱图,考察载气流速对乙醇与相邻易干扰峰的分离度的影响。结果显示,载气流速越大,乙醇峰形越尖锐,运行时间越短,但过高的载气流速会降低乙醇与邻近易干扰组分色谱峰的分离度,故选择1.0 ml/min的载气流速,见图2、表4。
2.4 线性关系考察与检测限测定
精密移取无水乙醇1 ml,置于100 ml容量瓶中,加去离子水稀释定容配制成浓度为1%(V/V)的母液,再精密移取母液适量,置于容量瓶中,加去离子水稀释定容,分别配制成浓度为0.020%、0.010%、0.005%、0.002%和0.001%的系列对照品溶液。精密移取上述系列对照品溶液1 ml,分别置于20 ml顶空瓶中,密封。按“2.1”项下色谱条件进样测定,记录色谱图。以对照品峰面积为纵坐标(Y),以对照品浓度(%,V/V)为横坐标(X),进行线性回归。回归方程为Y=77 000X+5.404 4,

A. 恒温40 ℃;B.恒温50 ℃;C.恒温80 ℃A. constant temperature 40 ℃; B. constant temperature 50 ℃; C. constant temperature 80 ℃图1 不同柱温对色谱分离度的影响Fig 1 Effects of different column temperature on chromatographic resolution

A.流速1.0 ml/min;B.流速1.5 ml/min;C.流速2.0 ml/minA. flow rate 1.0 ml/min; B. flow rate 1.5 ml/min; C. flow rate 2.0 ml/min;图2 不同载气流速对乙醇分离度的影响Fig 2 Effects of different flowing rate of carrier gas on chromatographic resolution

载气流速/ml/min101520乙醇保留时间/min313822271771与相邻峰的分离度325/336343/347342/336
r=0.998 1。结果表明,乙醇浓度在0.001%~0.02%范围内线性关系良好。按3倍信噪比计算,检测限为0.000 06%(V/V)。
2.5 加样回收率试验
配制0.008%、0.010%、0.012%的乙醇对照品溶液,分别移取该溶液1 ml,置于20 ml顶空瓶中,密封,制备标准对照品溶液;分别精密移取0.5 ml上述标准对照品溶液,置于20 ml顶空瓶中,另加0.5 ml生脉注射液,摇匀密封,制备加标样品溶液;再取生脉注射液1 ml置于顶空瓶中,密封,制备供试品溶液。按“2.1”项下色谱条件进样,记录色谱图。按如下公式计算加样回收率:加样回收率(%)=(A加×2-A样)/A标×100%;A加为加标样品检出的峰面积;A样为生脉注射液供试品检出的峰面积;A标为标准对照品检出的峰面积。结果表明,乙醇在高、中及低3个浓度下的加样回收率分别为96.26%、101.42%及91.37%,平均回收率为96.35%,RSD为4.26%。
2.6 精密度试验
取对照品溶液1 ml,置于顶空瓶密封,配制6份,按“2.1”项下色谱条件进样,计算峰面积的相对标准偏差为4.8%<5.0%,符合要求。
2.7 生脉注射液中乙醇残留量测定结果
对6批生脉注射液样品进行测定。结果显示,乙醇的理论塔板数>160 000,分离度>3.00,检出量均不超过《中华人民共和国药典》(2015年版)的限度,表明本方法用于测定生脉注射液中的乙醇残留量可行,见表5。
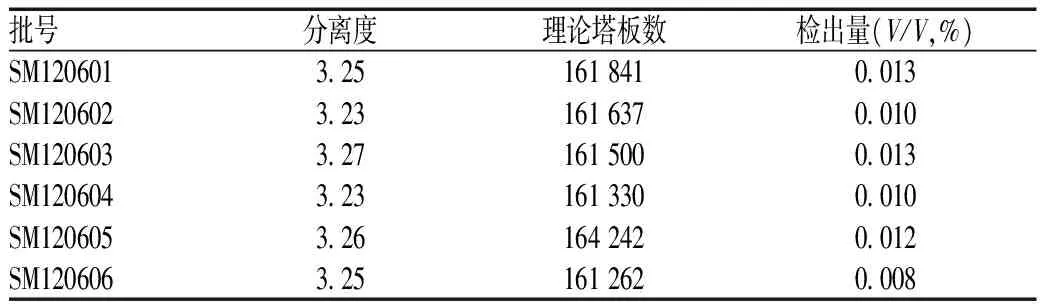
表5 生脉注射液中乙醇残留量测定结果Tab 5 Determination of alcohol residue in shengmai injections
3 讨论
3.1 测定方法的选择
中药注射液中有机溶剂残留的检测较繁琐,原因在于中药注射液成分复杂,含有大量不可挥发成分,水溶性差。而采用气相色谱直接进样容易污染进样口和色谱柱,长期使用会对色谱仪器造成不可逆的损害。有机溶剂一般无紫外吸收,故不宜使用常用的液相色谱-紫外检测方法进行检测[6]。顶空进样法在中药的有机溶剂残留检测中应用较广泛[7-13],用于测定中药注射液的挥发性成分已有较多文献报道,方法较成熟。本方法采用顶空进样法检测生脉注射液中乙醇残留,干扰少,分离度、理论塔板数较高。
3.2 顶空参数的选择
本方法采用静态顶空进样法,为获得真实可靠的检测结果,对顶空体积、平衡时间进行了优化,最终确定了样品体积1 ml、平衡时间10 min的参数。水在生脉注射液中占大部分,故本研究采用去离子水作为空白对照[14]。本方法的总运行时间为15 min,比较适合制药工业大批量样品的质量控制,其检测结果可为生脉注射液的质量标准提供数据支持。
3.3 乙醇残留监测的意义
中药注射液在生产过程中常用有机溶剂提取法进行提取,乙醇以其价格低廉、易去除及对人体的安全性较好等优点被广泛应用。《中华人民共和国药典:三部》(2015年版)关于化学残留物的测定中,规定乙醇为第3类溶剂残留,不得超过0.5%[5]。本研究检测结果显示,生脉注射液的乙醇残留量较低,临床安全性较好。
[1]李勤,刘宏.生脉注射液的药理作用及临床应用[J].医学综述,2005,11(10):950-952.
[2]吴嘉瑞,杨树谊,张晓朦,等.基于Meta分析的生脉注射液治疗冠心病心绞痛系统评价[J].中国实验方剂学杂志,2015,21(22):222-225.
[3]程民,蒋春海,黄萍.1012例生脉注射液不良反应/事件分析[J].安徽医药,2011,15(2):250-253.
[4]International Conference on Harmonization.Technical Requirements for Registration of Pharmaceuticals for Human Use:The ICH Process[N].[2003-02-26].http://www.ich.org/fileadmin/Public _Web_Site/ICH_Products/Guidelines/Quality/Q3C/Q3C_R6_Step_4.pdf.
[5]国家药典委员会.中华人民共和国药典:三部[S].2015年版.北京:中国医药科技出版社,2015:通则67-通则72.
[6]何小稳.药物中挥发性成分样品前处理方法的研究与应用[D].石家庄:河北医科大学,2011.
[7]窦晓蓉,王振华,杜勤,等.顶空气相色谱法测定中药酒剂中甲醇、乙酸乙酯、正丙醇、正丁醇、仲丁醇、异丁醇和异戊醇[J].中药新药与临床药理,2017,28(2):227-231.
[8]关晓娟.顶空进样气相色谱法测定薄荷药材中薄荷脑的含量[J].中华中医药学刊,2011,29(5):1160-1161.
[9]郭青,伍乃英,吴晓燕.顶空进样气相色谱法筛选并测定脉络宁注射液中有机溶剂残留量[J].中国药学杂志,2011,46(4):300-303.
[10] 梁选革,冯俊富,张若燕,等.顶空气相色谱法测定清开灵注射液中乙醇的残留量[J].医药导报,2013,32(12):1627-1630.
[11] 梁选革,张若燕,刘莉丽.顶空气相色谱法测定红花注射液中乙醇残留量[J].中国药事,2012,26(1):28-30.
[12] 张赟赟,严赟,罗佚.顶空毛细管气相色谱法测定血栓通注射液中有机溶剂残留量[J].中医药信息,2014,31(4):67-69.
[13] 邹义栩,刘月,吴春敏.顶空毛细管气相色谱法测定苦参素注射液中乙醇和丙酮的残留量[J].药物分析杂志,2012,32(3):447-450.
[14] 柴欣生,付时雨,莫淑欢,等.静态顶空气相色谱技术[J].化学进展,2008,20(5):762-766.
