薏苡仁谷蛋白源ACE抑制肽的分离纯化
2018-03-13李开陈佩瑶刘露王灵芝
李开,陈佩瑶,刘露,王灵芝
(北京中医药大学生命科学学院,北京 102400)
高血压是心血管疾病的重要影响因素之一,常伴随中风及肾衰竭的发生,严重威胁着人类健康[1]。ACE(血管紧张素转化酶)抑制剂为临床常用降压类药物,它通过阻断无活性的血管紧张素Ⅰ转化为具有升压活性的血管紧张素Ⅱ及抑制缓激肽的降解来达到降压作用[2]。目前临床上此类常用药物有卡托普利、依那普利、赖诺普利等,然而却存在着咳嗽,味觉失常,皮疹等明显副作用[3]。天然来源的ACE抑制肽因其安全性高,毒副作用小,易吸收的特点逐渐引起人们的重视[4-6]。
薏苡仁为禾本科植物薏苡(Coixlarchryma-jobiL.var.ma-yuenStapf)的干燥成熟种仁,主产于福建、河北、辽宁等地,味甘淡,性寒, 归脾、胃、肺经,可利水渗湿、健脾、除痹、排脓[7]。薏苡仁主要含有甘油三酯、薏苡内酯、薏苡多糖、甾醇类化合物、生物碱类化合物以及蛋白质,氨基酸等有效成分[8-9],有抗炎、抗癌、抗肿瘤、降血糖及降压等功效[10-14]。本课题前期工作表明薏苡仁谷蛋白酶解物具有ACE抑制活性[15],本研究进一步采用超滤和色谱方法对其分离纯化,以期获得新型结构降压肽,从而提供新型中医药源降压候选药物。
1 材料与方法
1.1 材料
薏苡仁(北京同仁堂药店);胃蛋白酶(Sigma公司);ACE(Sigma 公司);马尿酰-组氨酰-亮氨酸(HHL,Sigma 公司);马尿酸(HA,Sigma 公司);卡托普利(中国药品生物制品检定所);BCA蛋白定量试剂盒(美国Biomiga公司)。
1.2 仪器
SHA-B双功能水浴恒温振荡器(金坛市华立实验仪器厂);Biofugestratos 高速冷冻离心机(Thermo Fisher Scientific);德国CPA2250 型万分之一电子分析天平(Sartorius Weighing Technology Gmbh);85-2型恒温磁力搅拌器(巩义市予华仪器有限责任公司);Waters 1525 高效液相色谱仪(Waters 公司);EPOCH 全波长酶标仪( 美国伯腾仪器有限公司);PHS-3C型pH计(上海佑科仪器仪表有限公司);HD-4核酸蛋白检测仪(上海沪西分析仪器厂有限公司)。
1.3 方法
1.3.1 薏苡仁谷蛋白酶解物的制备
参照课题组Yuan[14]报道的方法进行薏苡仁谷蛋白酶解物的制备。准确称取薏苡仁谷蛋白冻干粉,按照底物浓度2%(w/v),胃蛋白酶与底物比1∶10(w/w),pH=2.0(溶于0.01 mol/L HCl)37 ℃恒温水浴48 h,反应结束后,100 ℃水浴5 min终止反应,冰浴至10 min,10 000 rpm 4 ℃离心,过G4漏斗,取收集液,置于卷式超滤机中进行超滤,截留分子量为3 KDa,超滤压力0.1 MPa,温度25 ℃,循环15 min后,收集滤出液,冷冻干燥。
1.3.2 离子交换色谱分离
将DEAE Sepharose Fast Flow填装玻璃层析柱(2 cm×15 cm),采用二乙醇胺缓冲液(pH=8.8)平衡。取上述多肽组分溶于缓冲液,过0.45 μm微孔滤膜,上样,流速为1 mL/min,用0~0.2 M浓度梯度的NaCl-二乙醇胺缓冲液进行洗脱,HD-4核酸蛋白检测仪于220 nm波长下检测组分,根据峰形收集流出液组分,定量后进行ACE抑制活性评价,选择较高活性组分进行下步分离纯化。
1.3.3 反相高效液相色谱分离
样品溶于质谱级水,经0.45 μm微孔滤膜过滤,滤液上RP-HPLC(反相高效液相)系统进行分离纯化,色谱柱为:TIAN-1825 Kromasil C18 column(250 mm×4.6 mm),色谱条件:柱温30℃,流速1 mL/min,检测波长220 nm;流动相A:乙腈(含0.1%TFA,v/v),流动相B:超纯水(含0.1%TFA,v/v);洗脱条件:0~5 min 5% A,5~85 min 5%~25% A。根据洗脱峰收集各组分,冷冻干燥,蛋白定量后对各组分进行ACE抑制活性评价。
1.3.4 ACE抑制活性测定
采用RP-HPLC法进行ACE抑制活性测定[15]。将定量后的样品采用硼酸缓冲液溶解,以硼酸缓冲液作为空白对照,卡托普利为阳性对照。总反应体系为50 μL,其中样品溶液10 μL、ACE溶液20 μL(2 mU)以及HHL溶液20 μL(2 mM)。样品与ACE溶液充分混匀,37 °C恒温水浴10 min,加入底物HHL溶液充分混匀37 ℃保温90 min,100 μL乙腈终止反应。采用C18色谱柱(250 mm×4.6 mm,5 μm,Tianhe)对反应液进行分析,色谱条件:柱温30 ℃,流速1 mL/min,流动相为乙腈∶水(0.05%三氟乙酸)=25∶75等度洗脱,上样体积10 μL,检测波长228 nm,根据HA的峰面积计算ACE抑制率,公式如下:
ACE抑制率(%)=(A-B)/A×100%
式中,A为空白对照条件下所产生的HA峰面积,B为样品或卡托普利作用条件下所产生的HA峰面积。
1.3.5 多肽含量测定
采用BCA法测定多肽含量[16]。
2 结果与分析
2.1 薏苡仁谷蛋白酶解物(≤3KD组分)ACE抑制活性评价
薏苡仁谷蛋白经胃蛋白水解,超滤后,收集≤3 KD组分,进行ACE抑制活性评价,色谱图如图1所示,其中a、b分别为对照品HHL和HA的色谱图,出峰时间分别为9.0和5.5 min,c为空白对照( 硼酸缓冲液) ,生成了较大的HA峰面积;d和e分别为薏苡仁谷蛋白酶解物(≤3 KD多肽组分,0.01 mg/mL)和卡托普利 (2×10-9mol/L) 。与空白对照相比,≤3 KD组分的ACE 抑制率为(16.9±1.29)%,说明薏苡仁谷蛋白酶解物具有一定的降压潜力。

图1 样品及对照品的RP-HPLC色谱图 注:(a)HHL标准品;(b)HA标准品;(c)空白对照;(d)薏苡仁谷蛋白酶解物(≤3 KD组分,终浓度0.01 mg/mL);(e)卡托普利(2×10-9 mol/L)。色谱条件:流动相25%乙腈(含0.05% TFA),流速1 mL/min,检测波长228 nm
2.2 离子交换色谱分离
薏苡仁谷蛋白酶解物(≤3 KD组分)经离子交换色谱分离后一共收集到了7个组分A1~A7(图2),其中A1 0M NaCl洗脱出峰,A2~A5为0.02M NaCl洗脱,A6为0.05M NaCl洗脱,A7为0.2M NaCl洗脱,在终浓度0.01 mg/mL下,测定各组分ACE抑制活性见表1,其中A2组分活性最高,抑制率为(50.48±1.93)%,与其他组分显著性差异(P<0.05),较上一步组分活性提高约34%,因此选择A2组分进行下一步分离纯化。
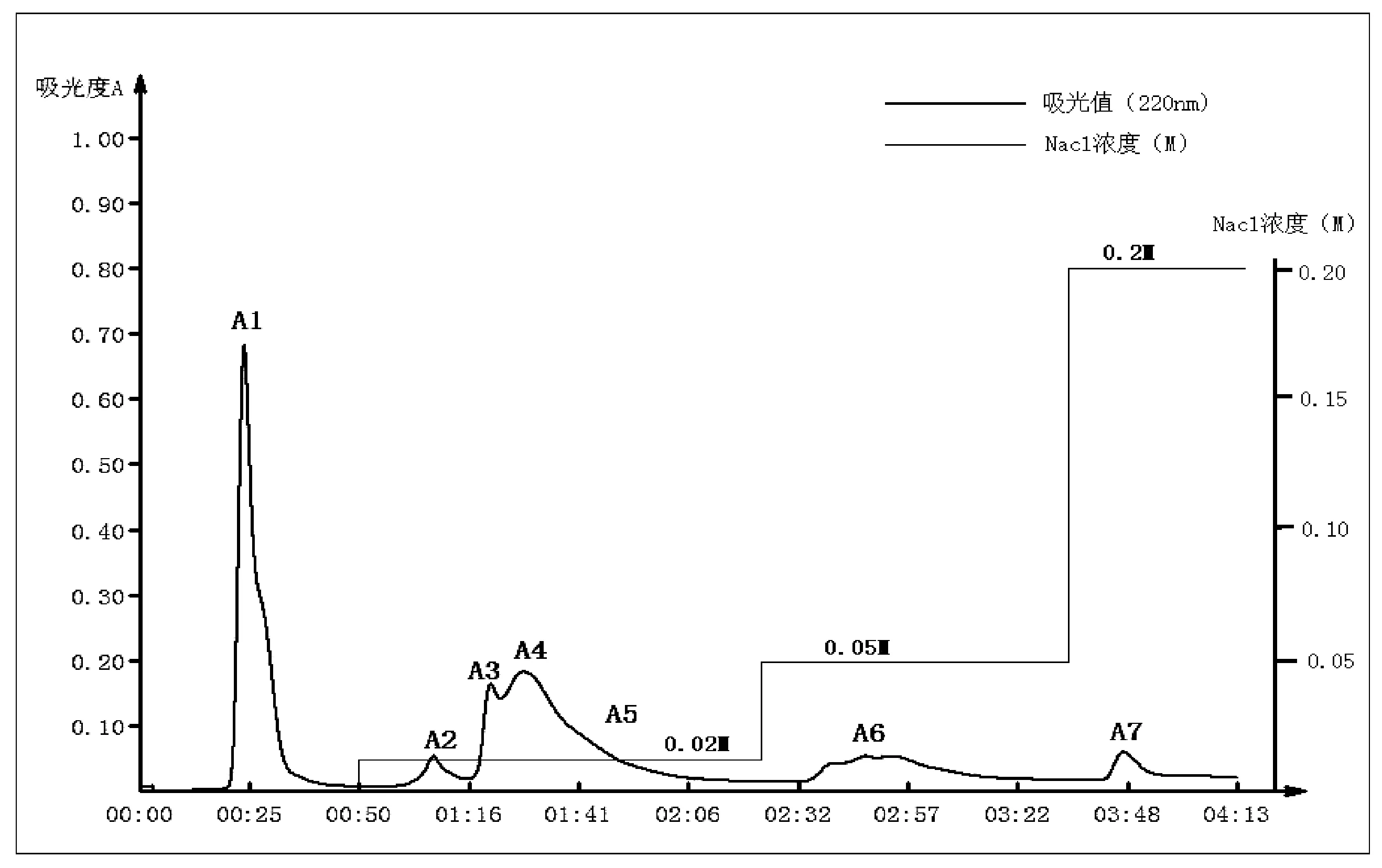
图2 离子交换色谱图 注:色谱条件:0~0.2 M Nacl-二乙醇胺缓冲液洗脱,检测波长220 nm

组分ACE抑制率(%)A130.39±0.49A250.48±1.93A336.45±0.07A426.83±4.59A540.14±0.09A623.00±0.52A71.49±0.27
注:各组分终浓度为0.01 mg/mL
2.3 RP-HPLC色谱分离纯化
A2多肽组分经RP-HPLC分离纯化后共收集到11个组分(图3),冷冻干燥后,经BCA定量在0.01 mg/mL同等浓度下,测定各组分的ACE抑制活性如表2所示,其中组分B2表现出了较高的ACE抑制活性,抑制率为(73.41±1.05)%,显著高于其他组分(P<0.05),与上一步离子交换组分A2相比抑制率提高约23%,与初始的≤3 KD组分相比,抑制率提高了约57%,说明薏苡仁谷蛋白酶解物经系列分离纯化后获得了高活性的ACE抑制肽。

表2 RP-HPLC分离纯化后各组分ACE抑制率
注:各组分终浓度为0.01 mg/mL
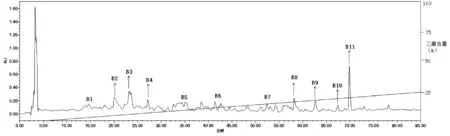
图3 A2组分RP-HPLC色谱分离结果 注:柱温30℃,流速1 mL/min,检测波长220 nm
3 讨论
薏苡仁谷蛋白酶解物经过超滤,离子交换色谱以及RP-HPLC等方法分离纯化后,获得了活性逐步提高的组分。超滤获得的≤3KD酶解物表现出一定的ACE抑制活性(16.9±1.29)%,最终获得组分B2,在相同浓度(0.01 mg/mL)下抑制率为(73.41±1.05)%,活性提高了约57%,有望从中获得高活性ACE抑制肽单体。ACE抑制肽的获得通常以动植物蛋白作为原材料,通过酶解或者发酵的方式获得肽段,进一步采用超滤和多种色谱技术对其进行分离纯化,经质谱鉴定其氨基酸序列[17-21]。Liu等[22]对胡桃蛋白进行酶解后通过超滤、葡聚糖凝胶色谱、离子交换色谱以及高效液相色谱分离纯化,获得ACE抑制肽Trp-Pro-Glu-Arg-Pro-Pro-Gln-Ile-Pro,其IC50为25.67 μg/mL。Li等[23]从泥鳅蛋白水解物中获得了Ala-His-Leu-Leu,可使SHR(原发性高血压大鼠)血压下降22.1 mmHg。Abraham等[24]从火麻仁蛋白酶解物中获得了降压肽Pro-Ser-Leu-Pro-Ala,单次灌胃给药(30 mg/kg body weight)SHR,4 h后血压下降了40 mmHg。天然来源的ACE抑制肽类药物与合成药物相比具有安全性高,毒副作用小的优点,引起人们的重视[25-26]。薏苡仁作为我国传统中药,有健脾渗湿的功效,中医上认为脾虚湿浊内阻,继而湿浊上犯,为高血压病的重要病机之一,健脾渗湿是治疗高血压的重要法则[27],也是薏苡仁用于高血压治疗的中医药基础理论,本工作及课题组工作[15]表明,薏苡仁谷蛋白经胃蛋白酶消化后最终获得具有较高ACE抑制活性的B2组分,可为该药临床应用提供新的科学依据,同时为中医药源多肽类降压新药的研发提供新的候选材料。
[1] WHO (World Health Organization).A Global Brief on Hypertension:silent killer, global public health crisis[M].Geneva:World Health Organization,2013:1-39.
[2] Pyung Chun Oh,Ichiro Sakuma,Toshio Hayashi,et al.Angiotensin converting enzyme inhibitors remain the first treatment of choice[J].Korean J Intern Med,2016,31(2):237-241.
[3] 张丽霞,赵海燕,张石革,等.血管紧张素转换酶抑制剂的研究与应用进展[J].中国药房,2007,18(35):2784-2787.
[4] Rotimi E Aluko.Antihypertensive Peptides from Food Proteins[J].Annu Rev Food Sci Technol,2015,6:235-262.
[5] 操德群,何艳丽,余虹,等.海洋生物ACE抑制肽研究进展[J].核农学报,2017,31(5):927-937.
[6] 何海伦,陈秀兰,孙彩云,等.血管紧张素转化酶抑制肽的研究进展[J].中国生物工程杂志,2004,24(9):7-11.
[7] 国家药典委员会.中国药典[M].北京:中国医药科技出版社,2015:419-420.
[8] Fan Zhu.Coix: Chemical composition and health effects[J].Trends in Food Science &Technology,2017,61:160-175.
[9] 金黎明,刘垠孜,赵晓蕾,等.薏苡仁有效成分研究进展[J].安徽农业科学,2011,39(10):5734-5750.
[10] Goeun Choi,Ah-Reum Han,Joo Hee Lee,et al.A Comparative Study on Hulled Adlay and Unhulled Adlay through Evaluation of Their LPS-Induced Anti-Inflammatory Effects, and Isolation of Pure Compounds[J].CHEMISTRY & BIODIVERSITY,2015,12(3):380-387.
[11] Manosroi A,Sainakham M,Chankhampan C,et al.Potent in vitro anti-proliferative, apoptotic and antioxidative activities of semi-purified Job’s tears (Coix lachryma-jobi Linn.) extracts from different preparation methods on 5 human cancer cell lines[J].J Ethnopharmacology,2016,187:281-292.
[12] Chao Chen,Yiyi Zhang,Yulong Gaoabc,et al.Identification and anti-tumour activities of phenolic compounds isolated from defatted adlay (Coix lachryma-jobi L. var. ma-yuen Stapf) seed meal[J].Journal of Functional Foods,2016,26:394-405.
[13] 徐梓辉,周世文,黄林清.薏苡仁多糖的分离提取及其降血糖作用的研究[J].第三军医大学学报,2000,22(6):578-581.
[14] Yuan J,Liang Y,Cui S,et al.Angiotensin I converting enzyme inhibitory and antioxidant activity of adlay (Coix lachrymal-jobi L.var. ma-yuen Stapf) glutelin hydrolysate [J].Ital J Food Sci,2014,26(3):282-288.
[15] 李斌,李玲玲,冀会方,等.薏苡仁谷蛋白源降压肽稳定性研究[J].中医药学报,2015,43(6): 53-57.
[16] Lau CC,Abdullah N,Shuib AS,et al.Novel angiotensin I-converting enzyme inhibitory peptides derived from edible mushroom Agaricus bisporus(J.E.Lange)Imbach identified by LC-MS/MS[J].Food Chemistry,2014,148(3):396-401.
[17] Pihlanto A, Akkanen S,Korhonen HJ,et al.ACE-Inhibitory and Antioxidant Properties of Potato (Solanum Tuberosum)[J].Food Chem,2008,109(1):104-112.
[18] Ahn CB,Jeon Y-J, Kim YT,et al.Angiotensin I converting enzyme (ACE) inhibitory peptides from salmon byproduct protein hydrolysate by alcalase hydrolysis [J].Process Biochem,2012,47(12):2240-2245.
[19] Chen J,Liu S,Ye R,et al.Angiotensin-I converting enzyme (ACE) inhibitory tripeptides from rice protein hydrolysate: purification and characterization [J].Journal of Functional Foods,2013,5(4):1684-1692.
[20] Malomo S A,Onuh J O,Girgih AT,et al.Structural and Antihypertensive Properties of Enzymatic Hemp Seed Protein Hydrolysates[J].Nutrients,2015,7(9):7616-7632.
[21] Vallabha V, Tiku P K.Antihypertensive Peptides Derived from Soy Protein by Fermentation[J].Int J Pept Res Ther,2014,20(2):161-168.
[22] Liu M,DuM,Zhang Y,et al.Purification and Identification of an ACE-Inhibitory Peptide from Walnut Protein[J].Agric Food Chem,2013,61(17):4097-4100.
[23] Ying Li,Jianzhong Zhou,XiaoXiong Zeng,et al.A Novel ACE Inhibitory Peptide Ala-His-Leu-Leu Lowering Blood Pressure in SpontaneouslyHypertensive Rats[J].J Med Food,2016, 19(2):181-186.
[24] Abraham T Girgih,Rong He,S Malomo ,et al.Structural and functional characterization of hemp seed (Cannabis sativa L.) protein-derived antioxidant and antihypertensive peptides[J].Journal of Functional Foods,2014,6(1):384-394.
[25] Ceren Daskaya-Dikmen,Aysun Yucetepe,Funda Karbancioglu-Guleret,et al.Angiotensin-I-Converting Enzyme(ACE)-Inhibitory Peptides from Plants[J].Nutrients,2017, 9(4):316.
[26] 许金光,杨智超,刘长江,等.血管紧张素转化酶(ACE)抑制肽的研究进展[J].食品工业科技, 2011,32(5):425-427.
[27] 张芝兰.高血压病古今中医文献的整理与研究[D].北京:北京中医药大学,2006.
