基于Nrf2/HO-1 信号通路探讨豨莶草对 尿酸钠诱导的滑膜细胞作用机制
2018-03-13孙冠男于雪峰陈水林徐轶尔孙贵才
孙冠男,于雪峰,陈水林,徐轶尔,孙贵才*
(1.道外区人民医院,黑龙江 哈尔滨 150020;2.南昌大学第四附属医院,江西 南昌 330003; 3.哈药集团药物研究院,黑龙江 哈尔滨 150025)
豨莶草为常用中草药,是一年生草本植物豨莶(SiegesbeckiaorientalisL),腺梗豨莶(S.pubescensMak)或毛梗豨莶(S.glabrescensMak)的全草;又名豨莶、稀莶草、火莶、猪膏莓等。豨莶草味辛、苦、寒,具有祛风湿、利关节和解毒之功效,主要用于治疗风湿痹症,关节疼痛,筋骨无力,腰膝酸软等[1]。我们前期研究发现以豨莶草为主药的复方豨莶草胶囊能够明显降低痛风性关节炎模型大鼠血清中肿瘤坏死因子水平、明显降低炎性因子的释放,降低NF-κB的转录,明显改善痛风性关节症状[2-3]。
急性痛风性关节炎发作是尿酸钠(monosodium urate,MSU)微晶体在关节内及关节周围组织沉积引起的急性炎症反应,是出现痛风的临床症状的直接原因[4]。沉积的关节周围的尿酸钠微晶体在人体内能够与中性粒细胞、单核巨噬细胞、T淋巴细胞和关节滑膜细胞等发生反应,释放IL-1、IL-8和TNF-α等炎性因子,炎性因子之间相互作用进一步影响痛风性关节炎的发生发展[5-6]。研究发现最新研究发现氧化应激在急性痛风性关节炎发生发展过程中也扮演着重要的作用[7]。大量氧自由基(ROS)和脂质过氧化物的产生均能够导致关节的损伤,进而出现剧烈疼痛和功能障碍,丙二醛(MDA)是脂质过氧化产物,含量的变化能过代表脂质过氧化水平和对机体的损伤程度,超氧化物歧化酶(SOD)是一种超氧阴离子和氧自由基清除剂,具有明显的抗炎症、抗感染和抑制脂质过氧化作用,在疾病和炎症的发生和发展中发挥着重要作用[8]。并且临床研究发现痛风性关节炎患者体内存在SOD含量降低,是多方面因素共同影响的结果,说明SOD的表达失调参与了痛风性关节炎的发病过程[9]。
以往的研究发现尿酸钠结晶沉积在关节后,能够激活多种信号通路参与GA炎症的发生发展,其中抗氧化能力动态失衡也是痛风性关节炎发病因素之一。核转录因子E2相关因子2(NF-E2-relatedfactor2,Nrf2)作为重要的转录因子[10],能够与核内ARE结合,进一步调控抗氧化基因 HO-1)表达,研究发现Nrf2-ARE是调节细胞内抗氧化防御体系的重要信号通路,抵抗氧化应激损伤方面发挥着重要的作用[11-12]。机体内源性抗氧化信号通路最近被发现:Nrf2/HO-1 信号通路具有抵抗内外界氧化和化学物质刺激所产生的氧化应激损伤,使生物体抵抗各种外来损伤中起着非常重要的作用,是生物体内最重要的内源性抗氧化信号通路,是现今氧化应激研究领域的热点内容[13]。因此,本实验以Nrf2/HO-1信号通路为基础,探讨痛风性关节炎的发生发展与Nrf2/HO-1信号通路之间的关系及中药豨莶草干预机制影响。
1 材料与方法
1.1 实验试药与动物
豨莶草购于哈尔滨市同仁堂大药房;青霉素和链霉素、DMEM培养基、胎牛血清和胰酶购于Hyclone公司, 尿酸钠( Uric acid sodium salt,U2875-5G) 购自美国Sigma 公司;大鼠白细胞介素IL-1、白细胞介素IL-8和肿瘤坏死因子TNF-α酶联免疫试剂盒购于美国R&D公司;ROS、SOD和MDA试剂盒购于DECO;PCR引物由上海生工生物工程有限公司合成;实验动物由黑龙江中医药大学实验动物中心提供。
1.2 滑膜细胞的分离和培养
将SD大鼠脱臼处死,置于75%的乙醇中浸泡15 min,沿膝关节正中纵向切开,剥离肌肉和膝盖骨,可见平滑光亮的滑膜组织,分离滑膜组织并去除脂肪组织,用含青霉素200 kU/L和链霉素200 mg/L的D-Hank’s液漂洗3次,将滑膜组织用眼科剪刀剪碎1 500 r/min,离心10 min,离心洗涤2次,去除上清液,加入100 μL的FBS混匀,将混匀的滑膜组织平铺培养瓶中,放入培养箱培养15 min,使之自然贴壁,在加入3 mL含20%FBS的DMEM培养液,37℃,5% CO2培养5~7 d,更换培养液继续培养,传代培养第三代用于本实验的研究,倒置显微镜下观察细胞生长状况。
1.3 豨莶草提取物及含药血清制备
将豨莶草药材40℃烘干,粉碎成干粉,然后加入10倍水于80℃提取2次,每次提取30 min。过滤,弃去滤渣,合并滤液,过滤,将溶液浓缩至100 mL,离心2 000 r/min ,10 min,取上清液,将浓度调整为250 mg/mL备用。取24只SD健康大鼠,随机分为4组,每组6只。依据《药理实验方法学》[14]中不同物种间给药剂量换算公式,大鼠灌胃给予豨莶草低、中、高剂量分别为1 g/kg,2 g/kg,4 g/kg,对照组灌胃给予同体积的生理盐水;每日分2次,连续给药14 d。各组均于末次给药后1 h采集静脉血浆,室温静置2 h,离心,取上清,将同一组的血浆混合后56℃水浴30 min灭活补体,0.22 μm无菌滤器过滤除菌、分装,制备高、中、低的剂量豨莶草含药血清及大鼠空白血清。以上血清均-70 ℃保存备用。
1.4 滑膜细胞中ROS、SOD和MDA测定
将第三代滑膜细胞平铺于24孔培养板,待细胞融合至80%左右,加入相应浓度的豨莶草。对照组、模型组、豨莶草高剂量组(4 g/kg)、豨莶草中剂量组(2 g/kg)和豨莶草低剂量组(1 g/kg)除对照组外各实验组中加入尿酸钠(0.1 mg/mL)继续培养24 h,培养结束后,弃上清液,按照DECO试剂盒说明书要求对滑膜细胞进行处理,测定滑膜细胞中ROS、SOD和MDA含量。
1.5 实时PCR检测滑膜细胞中Nrf2、HO-1mRNA表达
将第三代滑膜细胞平铺于24孔培养板,待细胞融合至80%左右,加入相应浓度豨莶草。对照组、模型组、豨莶草高剂量组(4 g/kg)、豨莶草中剂量组(2 g/kg)和豨莶草低剂量组(1 g/kg)的滑膜细胞,除对照组外各实验组中加入尿酸钠(0.1 mg/mL)继续培养24 h,弃上清液,PBS洗两次,收集不同组别的滑膜细胞加入Trizol裂解液,提取总RNA,并按照逆转录试剂盒说明将提取的总mRNA逆转录成cDNA,并应用cDNA用于实时定量PCR检测,引物序列有上海生工生物工程有限公司合成,引物序列:HO-1上游引物:5′-AGCCCCACCAAGTTCAAACA-3′,下游引物:5′-TGCCAACAGGA AGCTGA GAG-3′,Nrf2上游引物:5′-CCATTCCCAGTTACAGTGTCTT-3′, 下游引物:5′-GATCGATGAGTAAAAATGGTA′, β-actin上游引物:5′-GAGACCTTCAACAC CCCAGC-3′,下游引物:5′-CCACAGGATTCCATACCCAA-3′。
1.6 统计分析
采用SPSS19.0进行统计学分析,所有数据用χ2表示,P<0.05表示具有显著性差异,P<0.01具有极显著性差异。
2 结果
2.1 滑膜细胞形态
滑膜细胞贴壁5~7 d,在光学显微镜下观察,可见组织块周围有少量细胞生长,细胞形态不规则,但都以长梭形为主;9~11 d,可见大量细胞生长,以长梭形细胞为主,但仍有少量圆形和多角形的细胞存在;继续培养至90%细胞融合时,用胰酶消化,传代继续培养,传至第三代可见成纤维细胞样细胞,呈长梭形均匀分布,见图1。

图1 光镜下滑膜细胞形态注:A表示培养5~7 d的滑膜细胞;B表示培养9~11 d的滑膜细胞;C表示传至第三代的滑膜细胞
2.2 滑膜细胞中ROS、SOD和MDA含量变化
如表1所示,与对照组比较,尿酸钠处理滑膜细胞中ROS和MDA含量明显增加,豨莶草高、中、低组都能够明显降低ROS和MDA含量,且豨莶草高、中、低组均可以使SOD含量明显升高,且呈剂量依赖性,表明豨莶草能够抑制滑膜细胞发生氧化应激从而起到保护滑膜细胞正常生理功能的作用。
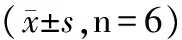
表1 豨莶草对尿酸钠处理滑膜细胞氧化应激损伤影响
注:与空白组比较,#P<0.05;与模型组比较,*P<0.05
2.3 滑膜细胞中Nrf2和HO-1mRNA表达结果
如表2所示,与对照组比较,不同浓度豨莶草处理的滑膜细胞中Nrf2和HO-1 mRNA的表达明显增加(P<0.05),且随着豨莶草浓度的增加Nrf2和HO-1表达也逐渐增加。
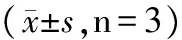
表2 豨莶草对尿酸钠处理滑膜细胞中Nrf2 和HO-1表达影响
注:与空白组比较,#P<0.05;与模型组比较,*P<0.05
3 讨论
痛风性关节炎是一种以剧烈疼痛为特点的无菌性炎症反应,发病率逐年升高,给社会和患者带来了严重的经济负担,痛风性关节炎的发病机制十分复杂,关节腔内尿酸钠析出,触发机体固有免疫反应,导致关节及周围组织的急性反应,但具体的发病机制还不清楚。
生理状态下机体组织内自由基的产生与消除维持在动态平衡,有效的抗氧化防御系统能够使自由基的浓度控制在一定范围内,当机体组织过度产生自由基或抗氧化系统功能受损,机体发生氧化应激[15]。氧化应激损伤主要由活性氧物质(ROS)所致,有害的活性氧自由基可通过脂质过氧化诱导细胞损伤。超氧化物歧化酶(SOD)含量变化间接反映机体清除氧自由基的能力,丙二醛(MDA)是脂质过氧化的产物,MDA含量可以表明脂质过氧化水平,本研究发现不同浓度的尿酸钠处理滑膜细胞后ROS和MDA的含量明显增加,SOD的含量明显降低,表明尿酸钠诱导滑膜细胞发生氧化应激。正常生理状态下,生物体内产生和消除活性氧自由基的能力处于动态平衡状态,病理状态下,生物体内生成过量的活性氧自由基由此抑制抗氧化防御系统,继而激发活性氧自由基的生成和消除的动态平衡受到破坏,继而产生大量的活性氧,发生脂质过氧化,改变生物大分子的结构和功能,引起氧化应激损伤。
当机体受到氧化应激刺激时能够激活Keap1-Nrf2/ARE 信号,激活下游靶蛋白表达[16]。靶蛋白被激活后调节生物体内抗氧化能力,使体内从氧化应激状态恢复到正常的生理状态。核因子E2相关因子 2调控的目的蛋白主要有血红素加氧酶-1(heme oxygenase-1,HO-1)、超氧化物歧化酶(superoxidedismutase,SOD)。今年研究发现外源性有毒的物质和ROS能促进核因子E2相关因子 2入核。SOD是生物体中最重要的酶之一,是机体内氧自由基的头号杀手, SOD 与疾病的发生发展都有着密切联系,具有抗炎、抗病毒及抗衰老等作用[17]。实验研究表明激活的核因子E2相关因子 2能够促进SOD的表达,从而可降低体内的氧化应激损伤,表明促进核因子E2相关因子2下游的抗氧化蛋白的表达,对滑膜细胞具有一定的保护作用。研究发现Nrf2诱导激活HO-1表达被认为是抗氧化应激最重要机制之一[18]与本实验结果相符。
本实验研究发现:模型组滑膜细胞中ROS和MDA含量明显增加,SOD含量明显降低,豨莶草高、中、低组都能够明显降低ROS和MDA含量,SOD含量明显升高; 表明豨莶草具有抗氧化作用,且可以通过调节Nrf2/HO-1通路促进下游抗氧化基因 HO-1 的表达起到抗氧化作用,从而减少氧化应急对滑膜细胞损伤,使生物体内产生和消除活性氧自由基的能力处于动态平衡状态进而维持正常滑膜细胞生理功能。
[1] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药出版社,2010:345.
[2] 于雪峰,李登宇,孙贵才,等.复方豨莶草胶囊降血尿酸及对肾损害的保护作用[J].中医药学报,2007,35(2):18-20.
[3] 徐轶尔,孙贵才,郑春雨,等.豨莶草对尿酸钠引起痛风性关节炎IL-1β、TNF-α、NF-κB表达的影响[J].风湿病与关节炎,2015,4(1):9-13.
[4] 佟颖,陈德欣,李延,等.痹宁汤治疗急性痛风性关节炎的临床研究[J].中医药学报,2016,44(3):64-66.
[5] 李宝龙,韩玉生,刘旭,等.丹溪痛风加减方对MSU致家兔急性痛风性关节炎的防治作用[J].中医药学报,2011,39(3):45-47.
[6] Masseoud D, Rott K, Liu-Bryan R, et al. Overview of hyperuricaemia and gout[J].Current pharmaceutical design,2005(11):4117-4124.
[7] Zamudio-Cuevas Y, Hernandez-Diaz C, Pineda C, et al. Molecular basis of oxidative stress in gouty arthropathy[J].Clin Rheumatol,2015,34(10):1667-1672.
[8] Harijith A, Ebenezer DL, Natarajan V . Reactive oxygen species at the crossroads of inflammasome and inflammation[J].Front Physiol,2014,5352.
[9] 宋倩,刘健,忻凌,等.痛风性关节炎患者超氧化物歧化酶的变化及关联规则挖掘[J].中国临床保健杂志,2017,20(1):77-80.
[10] González Del Alba Aránzazu,Arranz Joséngel,Puente Javier, et al. Recent advances in genitourinary tumors: A review focused on biology and systemic treatment[J].Crit Rev Oncol Hematol,2017(113):171-190.
[11] Kaspar JW, Niture SK, Jaiswal AK. Nrf2:INrf2(Keap1) signaling in oxidative stress[J]. Free Radic Biol Med, 2009,47(9):1304-1309.
[12] Wang Tuanjie,Zhang Jian,Xiao Aiju, et al. Melittin ameliorates CVB3-induced myocarditis via activation of the HDAC2-mediated GSK-3β/Nrf2/ARE signaling pathway[J].Biochem Biophys Res Commun,2016,480(1):126-131.
[13] Batliwala Shehzad,Xavier Christy,Liu Yang, et al. Involvement of Nrf2 in Ocular Diseases[J].Oxid Med Cell Longev,2017,2017:1703810.
[14] 徐叔云.药理实验方法学[M].北京:人民卫生出版社,2010:56-68.
[15] Zamudio-Cuevas Y, Hernandez-Diaz C, Pineda C, et al. Molecular basis of oxidative stress in gouty arthropathy[J]. Clin Rheumatol,2015,34(10):1667-1672.
[16] Krajka-Kužniak Violetta,Paluszczak Jaroslaw,Baer-Dubowska Wanda. The Nrf2-ARE signaling pathway:An update on its regulation and possible role in cancer prevention and treatment[J].Pharmacol Rep,2017,69(3):393-402.
[17] Vnukov V V,Gutsenko O I,Milyutina N P, et al. SkQ1 Regulates Expression of Nrf2, ARE-Controlled Genes Encoding Antioxidant Enzymes, and Their Activity in Cerebral Cortex under Oxidative Stress[J].Biochemistry Mosc,2017,82(8):942-952.
[18] Huang Ting-Ting,Hao Dong-Lin,Wu Bo-Na,et al. Uric acid demonstrates neuroprotective effect on Parkinson's disease mice through Nrf2-ARE signaling pathway[J].Biochem Biophys Res Commun,2017,493(4):1443-1449.
