理冲生髓饮有效组分对卵巢癌组织的 相关基因表达与血管生成影响
2018-03-13郭滢张艳韩凤娟
郭滢,张艳,韩凤娟*
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040; 2. 黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150010)
卵巢癌是女性死亡率极高的女性生殖器恶性肿瘤,严重的影响女性的生活,现在对卵巢癌的标准治疗是手术加化疗,但是存活率仍不乐观,越来越多的人们开始关注靶向治疗以及基因方面治疗,本课题就理冲生髓饮对卵巢癌裸鼠的实验研究其基因层面,基于基因芯片结果分析中药复方理冲生髓饮对卵巢癌血管生成影响及抑制肿瘤血管生成的作用机制。目前基因芯片具有信息量大、可比性强、标准化等特点,并且采用基因芯片方法筛选中药复方有效组分作用生物学基础,为临床应用及后续研究提供科学依据。
1 材料和方法
1.1 材料来源
1.1.1 实验动物
Balb/c裸鼠,雌性,40只,体质量(15±2)g,无特定病原体级实验动物,鼠龄4~6周,购自北京维通利华生物技术有限公司,饲养于黑龙江中医药大学药物安全性评价中心(属于清洁级动物实验室隔离屏障系统),并且严格控制的裸鼠饲养环境。
1.1.2 细胞株
人卵巢癌SKOV3 细胞株,来自于齐氏生物科技。
1.1.3 实验药物以及药物试剂
中药复方理冲生髓饮的组成:人参30 g,仙灵脾50 g,三棱10 g,莪术10 g,鹿茸10 g,黄芪50 g,水蛭10 g,浙贝母20 g。由黑龙江中医药大学附属第一医院中药局提供。
PRMI-1640(HyClone)、胎牛血清(HyClone)、0.25%胰蛋白酶(HyClone)、二甲基亚枫(二甲基亚枫)、贝伐单抗(瑞士罗氏制药公司)、实时定量PCR试剂盒购自Thermo;STAT3兔抗人多克隆抗体、CD34兔抗人多克隆抗体和beta-actin兔抗人多克隆抗体Vegf兔抗人多克隆抗体均购自武汉三鹰公司、JAK2兔抗人多克隆抗体购自于Abcam;辣根酶标记山羊抗兔IgG(H+L)来自美国 中杉金桥(Zb-2301);免疫组化检测试剂盒购自北京中山生物技术有限公司。
1.1.4 主要仪器
扫描仪、杂交炉、程序降温仪、研究级倒置显微镜、2100振荡器、PCR仪、离心机、电热恒温培养箱、CO2细胞恒温培养箱、-70℃低温冰箱、SDS电泳仪、红外微定量分析、生物组织包埋机、转轮式组织切片机。
1.2 实验方法
1.2.1 有效组分的提取
理冲生髓饮有效组分由黑龙江中医药大学药学院药理研究室人员提取供给。提取方法[1]:称取一定处方量中药复方,分别进行超临界萃取获得组分Ⅰ,组分Ⅱ是用药渣经过75%乙醇浸泡,加热回流提取液,将其蒸干;组分Ⅲ由滤渣继续经蒸馏水加热回流获得滤液,经95%乙醇达到醇沉,上清蒸干获得;最后收集沉淀,干燥后获得组分Ⅳ。
保存方法是将提取组分Ⅰ密封在-20℃保存,有效组分Ⅱ、Ⅲ、Ⅳ密封在干燥室温保存待用。中药复方理冲生髓饮提取有效组分由:9.9 g组分Ⅰ、33.69 g组分Ⅱ、4.05 g组分Ⅲ以及12.5 g组分Ⅳ组成,混合在一起应用于动物实验研究。各组剂量为,中药高剂量组:11.28 g/(kg·d),中药中剂量组:7.52 g/(kg·d),中药低剂量组:3.76 g(/kg·d)。
1.2.2 卵巢癌细胞株SKOV3的培养
细胞悬浮培养于含10%胎牛血清、青霉素和链霉素各100 U/mL 的RPMI-1640培养液中,置于37 ℃、饱和湿度5%的CO2培养箱中培养,隔2~3 d传代。取对数生长期细胞进行造模。
1.2.3 卵巢癌裸鼠模型建立及评估
建立裸鼠应用1 mL的无菌注射液,皮下肌注造模方法,将SKOV-3单细胞悬液0.1 mL注射于裸鼠左上肢以及右上肢腋下疏松部位。
待造模成功,对裸鼠每日的食量以及饮水情况进行观察,需要记录小鼠的肿瘤标本体积,隔日一测。计算方法为:V=(a×b2)/2(a为长径,b为短径)。
模型评估:皮下肿瘤长至直径3 mm时即为造模成功;分离2只裸鼠皮下肿瘤,进行病理分析评估造模是否成功。
1.2.4 分组及给药
将裸鼠随机分为模型组(生理盐水)和中药中剂量组,每组8只。以中剂量7.52 g/(kg·d)剂量灌胃给药,连续给药21 d,观察裸鼠的变化。
1.2.5 实验取材及观察指标
断颈处死,分离皮下卵巢癌肿瘤组织,冻存管分装,快速置于液氮中保存,并且留取部分组织固定在中性福尔马林液中。
1.2.6 基因芯片检测中药治疗后差异表达基因
在空白对照组与中药中剂量组中随机选取4个肿瘤组织标本,应用人4×180KAffymetrix OElncRNA芯片技术的方法,对组织样本进行检测和分析。
1.2.7 数据采集和标准化
杂交芯片扫描得到原始图像。再利用AGCC软件技术。将原始数据导入Expression Console软件,应用RMA算法可以进行标准化分析。
1.2.8 统计方法
基因表达分析使用Genespring软件。差异基因进行GO和KEGG富集分析,利用T检验进行筛选。
2 实验结果
2.1 理冲生髓饮有效组分用药后差异基因筛选
芯片杂交后的原始图像采用Affymetrix GeneChip Command Console软件处理,将原始数据,用Expression Console软件其芯片进行了gene level的标准化。再采用Genespring软件进行基因表达分析。讲差异基因通过T检验的P值和倍数变化值进行筛选,筛选出以标准为上调或者下调倍数变化值≥2.0且P值≤0.05。
MicroRNA芯片初步筛选差异基因的结果提示上调基因3个,下调9个,共有12个表达差异的基因(见表1)。
2.2 聚类分析结果
将差异microRNA应用非监督层次聚类。计算多个样品两者之间的距离,用挑选的差异microRNA的表达情况计算样品的相关性,并且用Heatmap展示结果如图1显示。
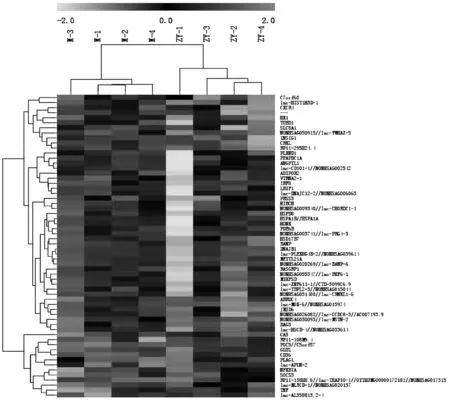
图1 两组间的差异基因非监督层次聚类
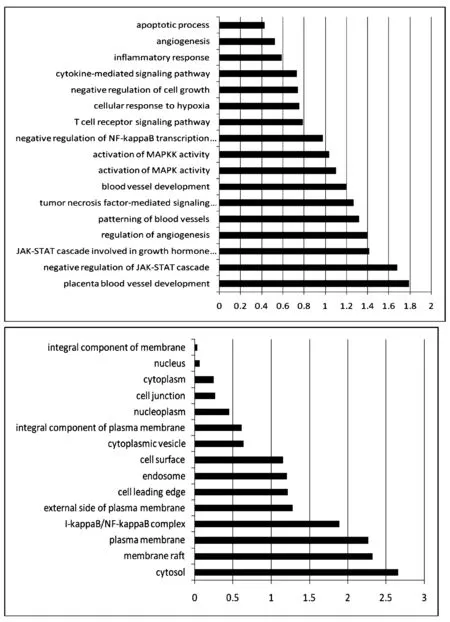
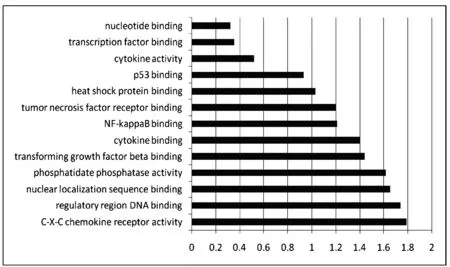
图2 GO分析
从差异基因中筛进行两组间的非监督层次聚类,计算差异基因中两两之间的距离,将其构成距离矩阵,合并距离最近的两类为一新类,并且计算出新类和当前各类的距离,再进行合并和计算,以此方法直到只有一类为止,再用Heatmap展示,可以见到两组间有明显不同的表达谱。
结果显示:与模型组比较,显示中药复方理冲生髓饮组差异表达基因上调的13个,下调的47个。
2.3 GO分析
将差异基因进一步进行GO分析,是描述基因主要影响的生物学功能,并用统计检验的进行计算,观察靶基因富集性。结果见图2。
2.4 Pathway分析
通过靶基因Pathway进行分析,得到富集靶基因Pathway 条目,再应用KEGG数据库对进行pathway的分析,统计pathway条目的差异基因显著性的差异(用P值代表),结果见图3。
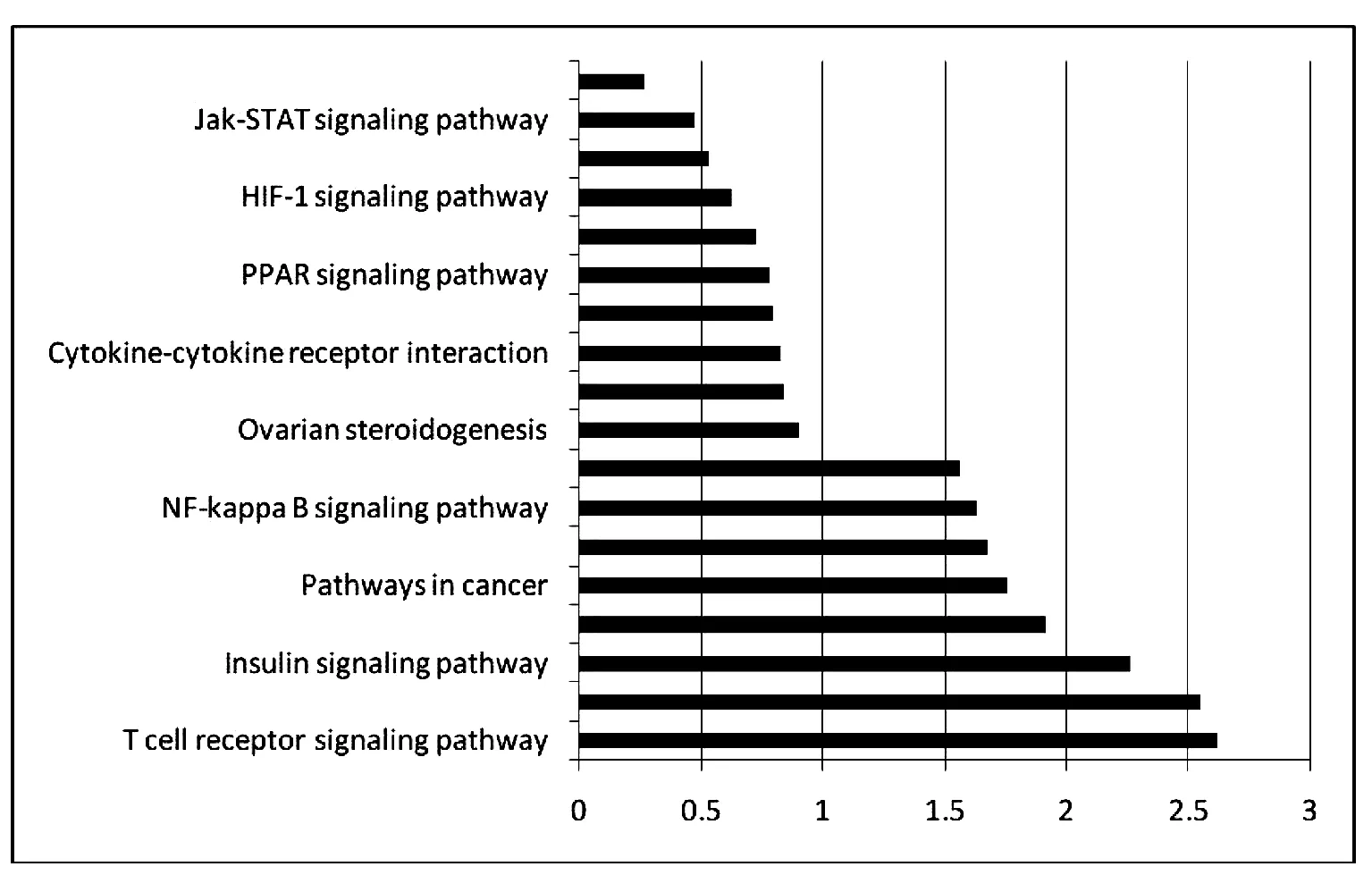
图3 Pathway分析
从实验结果上对用中药复方理冲生髓饮作用后的基因差异表达显示可能涉及的信号通路有27条信号通路,但是再进一步GO分析和pathway分析结合的结果可以看出最终影响卵巢癌的差异基因主要的存在的生物学途径集中在JAK-STAT信号通路,HIF-1信号通路,NF-κB信号通路;TNF信号通路;t细胞受体信号通路;BAG信号通路;干扰素调节因子以及一些趋化因子上,并且相关的差异通路具体作用如下见表2。
3 讨论
基因芯片又被称为DNA微阵列或DNA芯片, 应用已知核酸序列与互补的靶序列杂交,根据杂交信号进行定性与定量分析,专门用于核酸检测的生物芯片,目前的研究中主要是将“疾病-正常”的差异基因的表达进行分析和比较,而中药往往是由于所含有效成分复杂及作用机制多靶点、多途径的双重复杂性的特点,目前研究中重点是将中药复方的成分理清,将中药复方组成的分子配体与靶点(疾病)间存在的复杂关系(如“一对多、多对一”)理清,这是目前研究中药作用机制的关键,并且这种复杂关系制约了中药复方的国际化发展。故本课题团队在中药复方研究中,采用了以基因芯片技术为基础的基因表达差异比较,在理冲生髓饮有效组分的提取下,我们又将中药复方的有效组分与基因表达差异相结合,观察理冲生髓饮是否能改变基因的某个差异表达,甚或者是对通路的某位点或趋化因子有改变,对基因表达进行研究,为中药复方作用机制提供有效依据[2-3]。

表2 差异信号通路的主要作用
我们筛查的结果上可以看出,中药复方理冲生髓饮在作用靶点上可以通过以上几个通路,并且有8条差异信号通路与卵巢癌的血管生成有密切关系,对血管生成,细胞活化,以及参与细胞侵袭和转移上均有一定的作用,在对中药分子配体与靶点间的“一对多、多对一”的复杂关系网络研究体系下,我们可以看出,中药复方理冲生髓饮能够改变应用后卵巢癌组织的相关通路,这正是目前我们研究中药复方理冲生髓饮的作用机制研究的关键。鉴于基因表达谱芯片主要用于研究转录水平上基因的变化,可以证实理冲生髓饮参与卵巢癌的细胞再生以及转移通路,并且是对JAK-STAT信号通路下调的作用,NF-κB转录因子的负向调节作用,利用基因芯片的技术来阐明中药复方理冲生髓饮有效组分在疾病以及药物或者其它因素的干扰下,其基因的表达差异情况,应用生物信息学技术分析差异基因,进一步明确致病基因或药物的作用靶点[8],为我们在今后的实验过程中,可以更加有说服依据,在这些差异基因的表达下进行更进一步研究,找到理冲生髓饮作用于卵巢癌的机,为临床提供更有利的生物学基础。
[1] 王艳宏,尚冬雪,李洋,等.HPLC-DAD法同时测定理冲生髓饮中7种亲脂性成分[J].中成药,2015,37(8):1713-1717.
[2] Kortylewski M,Yu H.Role of Stat3 in suppressing antitumor immunity[J].Curr Opin Immunol,2008(20)228-233.
[3] Yu H,Pardoll D,Jove R.STATs in cancer inflammation and immunity: a leading role for STAT3[J].Nat Rev Cancer,2009(9):798-809.
[4] Laskov R, Berger N, Scharff MD, et al. Tumor necrosis factor-alpha and CD40L modulate cell surface morphology and induce aggregation in Ramos Burkitt’s lymphoma cells[J].Leuk Lymphoma,2006,47(3):507-519.
[5] 陈明红,李美欣,刘宝琴,等.BAG3蛋白Ser187位点磷酸化诱导人甲状腺癌FRO细胞上皮间质转化[J].中国生物化学与分子生物学报,2015,31(11):1213-1219.
[6] 孙银华,张瑞,裴善良.基因表达差异比较在中药研究中的应用[J].中国实用医药,2009,4(30):218-220.
[7] 杨义强,王春艳.基因芯片技术在药学研究中的应用[J].齐鲁药事,2009,28(5):293-295.
[8] 刘庆山,陈小玉,庄述娟.基因表达谱芯片技术进展及其在中药网络药理学研究中的应用[J].时珍国医国药,2014,25(2):502-504.
