金匮肾气丸对12月龄雄性小鼠脾组织代谢组 学增龄改变的影响
2018-03-13梁华刘丽玮马艳春王燕隋雨桐李奇伟闫起
梁华,刘丽玮,马艳春,王燕,隋雨桐,李奇伟,闫起
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
代谢组学自20世纪90年代提出开始,近三十年得到了广泛的研究与应用,其作为一门新兴的组学学科,与基因组学、蛋白质组学、转录组学等一起成为系统生物学的重要组成部分。代谢组学运用精准的仪器和数据通过对机体代谢物的计量分析,找到代谢物与机体病理生理变化之间的联系,对相关疾病的探索研究提供科学的理论支持[1]。以小见大,从局部分析整体,与中医基础理论不谋而合,代谢组学有效地将中医与现代科学手段相结合,为中医药现代研究奠定了坚实的基础。
金匮肾气丸是治疗肾阳虚证的经典方剂,由附子、肉桂、熟地黄、山药、泽泻等组成。大量实验研究表明,金匮肾气丸可使血液中的SOD升高,MDA降低,明显改善肾虚症状[2],抑制自由基生成并降低MDA水平,显著降低细胞凋亡率,这些作用被认为是金匮肾气丸抗衰老作用的重要的机制[3]。补肾中药通过多种靶点的综合作用,对抗衰老发挥作用,因此补肾与抗衰老之间存在密切联系[4]。朱明雪等[5]人对金匮肾气丸的免疫调节作用进行了系统的归纳总结,发现金匮肾气丸对老龄机体、阳虚机体和荷瘤机体有重要的免疫调节作用,为研究抗衰老与免疫学机制之间的作用关系提供了理论基础。另有研究表明,金匮肾气丸可有效改善老年前列腺增生患者的临床症状,提高患者的生活质量,对老年性疾病的研究和治疗具有重要意义[6]。
本实验运用代谢组学技术,对金匮肾气丸干预下的增龄小鼠的脾组织代谢物质的变化进行分析,探索与增龄密切相关的生物标志物及代谢通路,以及金匮肾气丸的调节作用,为今后研究金匮肾气丸干预生长发育相关的生物学基础提供理论依据。
1 材料与方法
1.1 仪器
美国Waters公司ACQUITY UPLCTM液相色谱仪,美国Waters公司Waters LCT Premier XETOF 质谱仪,KDC-160HR高速冷冻离心机(中国科大创新股份有限公司中佳分公司),MassLynx V4.1工作站,Progenesis QI 2.1软件,P80MX超速冷冻离心机,超纯水纯化系统,-80℃冰箱。
1.2 药品与试剂
金匮肾气丸汤剂(黑龙江中医药大学国医堂);生理盐水(哈尔滨三联药业有限公司);屈臣氏蒸馏水(广州屈臣氏食品饮料有限公司);色谱甲醇(美国赛默飞世尔公司);色谱乙腈(美国赛默飞世尔公司);甲酸(北京迪马科技欧泰科技发展中心)。
1.3 动物
SPF级ICR雄性小鼠,3月龄10只,12月龄20只,由辽宁长生生物技术有限公司提供(许可证号:SCXK(辽)2010-0001)。实验室饲养温度(22±2)℃,湿度55%±15%,空气新鲜,12 h避光,12 h光照,自由饮食饮水,喂食固体饲料(购自哈尔滨市南岗区玉英养殖场)。
1.4 药品的制备
金匮肾气丸配方:干地黄24 g,山药12 g,山茱萸12 g,泽泻9 g,茯苓9 g,牡丹皮9 g,桂枝3 g,附子3 g,共81 g。加水煎煮两次,每次1 h,合并药液,制成生药浓度为0.81 g/mL的药液。
1.5 样品采集与制备
3月龄小鼠10只为空白对照组,12月龄小鼠20只随机分为模型组和金匮肾气丸组各10只,并分别标记。金匮肾气丸组给药量为13 mL/(kg·d),空白组和模型组对照同体积比生理盐水。每天上午8:30—9:30之间给药,共计30 d。小鼠在第30天禁食,不禁水,次日处死小鼠,取脾组织,测重标记后液氮冻存,后存入-80℃冰箱备用。采用甲醇有机溶剂沉淀蛋白法,在脾组织中加入10倍甲醇匀浆(冰浴条件下),匀浆液在12 000×g,4℃条件下离心15 min,取上清液重复以上离心,最后取200 μL供UPLC-TOP/MS分析。
1.6 分析条件
1.6.1 超高液相色谱条件
色谱柱ACQUITY UPLCTMBEH C18(1.7 μm,2.1 mm×50 mm);流速0.4 mL/min;柱温40℃;样品仓温4℃;流动相A:0.1%甲酸—乙腈溶液;流动相B:0.1%甲酸—超纯水溶液;梯度洗脱条件:0 min,2%A,98%B;15 min,100%A,0%B。
1.6.2 质谱条件
电喷雾离子源(ESI):毛细管电压正离子模式下1 300 V;负离子1 500 V;正离子样本锥孔电压60 V;负离子70 V;脱溶剂温度350℃;离子源温度110℃;脱溶剂气体流速750 L/h;锥孔气体流速20 L/h;碰撞能60 V;采用美国Waters公司Lockspray校正系统进行在线质量校正,正离子模式下校正液为亮氨酸—脑啡肽(Leucine—Enkephalin,[M+N]+556.2771)溶液,负离子模式下校正液为亮氨酸—脑啡肽(Leucine—Enkephalin,[M+N]-554.2615)溶液;浓度为1 ng/mL,流速20 μL/min;校正频率为15 s;全扫描方式,质量扫描范围:m/z100—1 500。
1.6.3 数据处理
本实验运用Progenesis QI 2.1软件进行色谱峰识别及峰匹配,采用主成分分析法(PCA)和正交偏最小二乘-判别分析法(OPLS-DA)分析青年对照组与12月模型组的代谢差异物,选取潜在生物标志物。
2 结果
利用代谢组学研究技术,对实验结果进行数据分析,从三组样本的PCA得分图(图1、图2)可见:正负离子条件下,3月对照组,12月模型组和金匮组所有样本有明显区分,而金匮组于Y轴上位于3月对照组与12月模型组之间,并更接近于3月对照组。表明三组样本的内源性代谢物存在显著差异,而金匮组对于12月模型组有显著回调作用。对3月对照组和12月模型组小鼠进行OPLS-DA(图3、图4)分析,可见在正负离子条件下,3月对照组与12月模型组沿Y轴区分明显,说明两组样品有明显区分。在S-Plot图(图5、图6)和VIP散点图(图7、图8)中,碎片离子呈S型、V型排列,并且远端更为分散,说明对代谢轨迹产生较大影响,本实验对VIP 值大于2且P值小于0.05作为筛选条件,找到对代谢轮廓变化起关键性作用的内源性生物标记物。采用 UPLC-HDMS 的方法检测标记物,利用HMDB及KEGG等数据库检索并结合Progenesis QI 2.1软件进行化合物鉴定,确定出与增龄相关的潜在生物标记物26个(图9-1、9-2),如表1所示,其中11个代谢差异物表现为不同程度的上调(2-Octenoic acid、Xanthine、Lactosylceramide (d18:1/12:0)、Taurine、Pyruvic acid、Threonic acid、6,8-Dihydroxypurine、Lipoxin A4、Monoethylhexyl phthalic acid、Canrenone、Isodeoxycholic acid),15个代谢差异物表现为不同程度的下调(Stearoylcarnitine、Glycocholic acid、9-Hexadecenoylcholine、N-Acetylserine、Uric acid、Pyroglutamic acid、17-alpha,20-alpha-Dihydroxypregn-4-en-3-one、Taurodeoxycholic acid、Homoanserine、20-Hydroxyeicosatetraenoic acid、Varanic acid、Dodecanoylcarnitine、Phosphoribosyl-ATP、Docosahexaenoic acid、Arachidonic acid)。如图9所示,在确定的26个标记物中,金匮组对其中的9个具有调节作用,分别是Taurodeoxycholic acid、Glycocholic acid、Xanthine、9-Hexadecenoylcholine、Lactosylceramide (d18:1/12:0)、Threonic acid、Homoanserine、6,8-Dihydroxypurine、Monoethylhexyl phthalic acid。将鉴定得到的与增龄相关的26个标记物输入METPA数据库中,得到以下代谢通路(图10),将临界值设定为0.10,主要得到以下代谢通路:a牛磺酸和牛磺酸代谢(Taurine and hypotaurine metabolism)、b花生四烯酸代谢(Arachidonic acid metabolism)、c、丙酮酸代谢(Pyruvate metabolism)。以上结果说明金匮肾气丸对增龄性相关生物标记物及代谢通路有一定的调节作用。

图1 正离子条件下3月对照组、12月模型组、 金匮组PCA分析后Scores plot图

图2 负离子条件下3月对照组、12月模型组、 金匮组PCA分析后Scores plot图
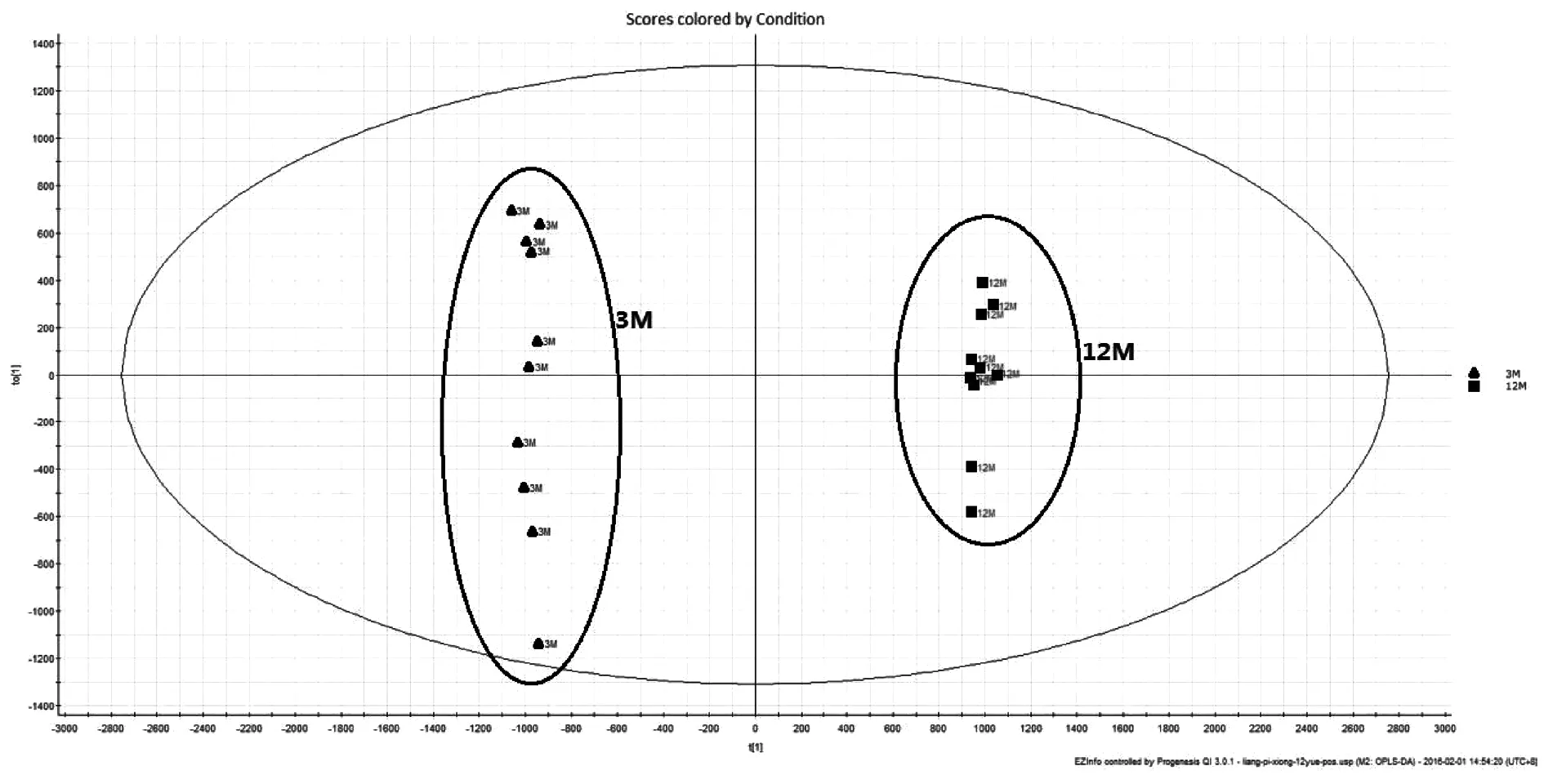
图3 正离子条件下3月对照组、12月模型组OPLS—DA图
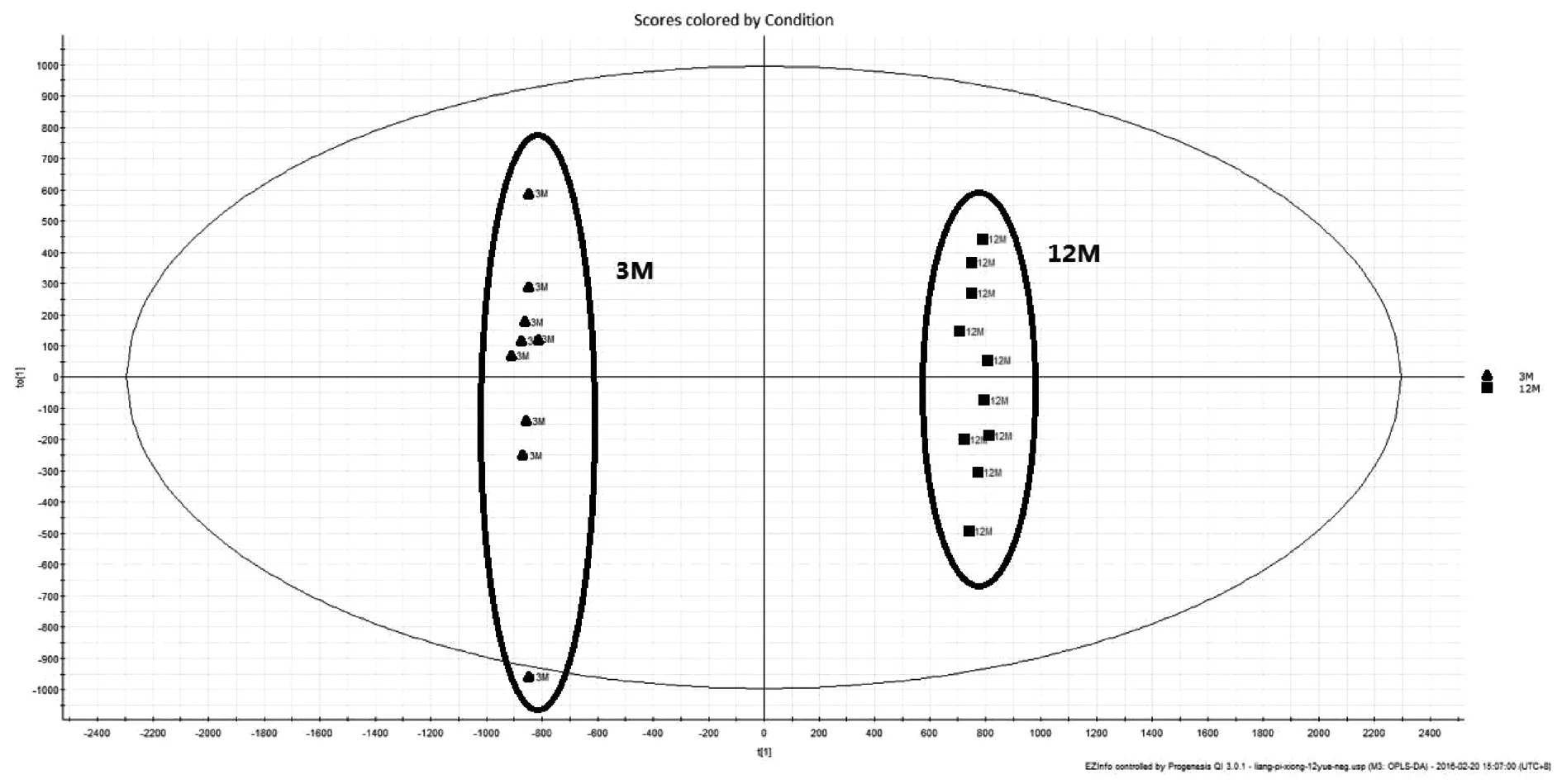
图4 负离子条件下3月对照组、12月模型组OPLS—DA图

图5 正离子条件下12月模型组S-Plot图
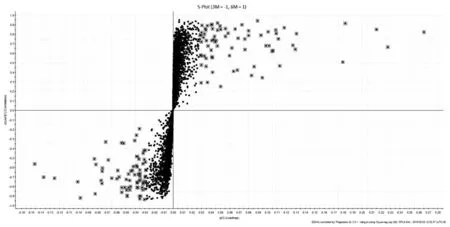
图6 负离子条件下12月模型组S-Plot图
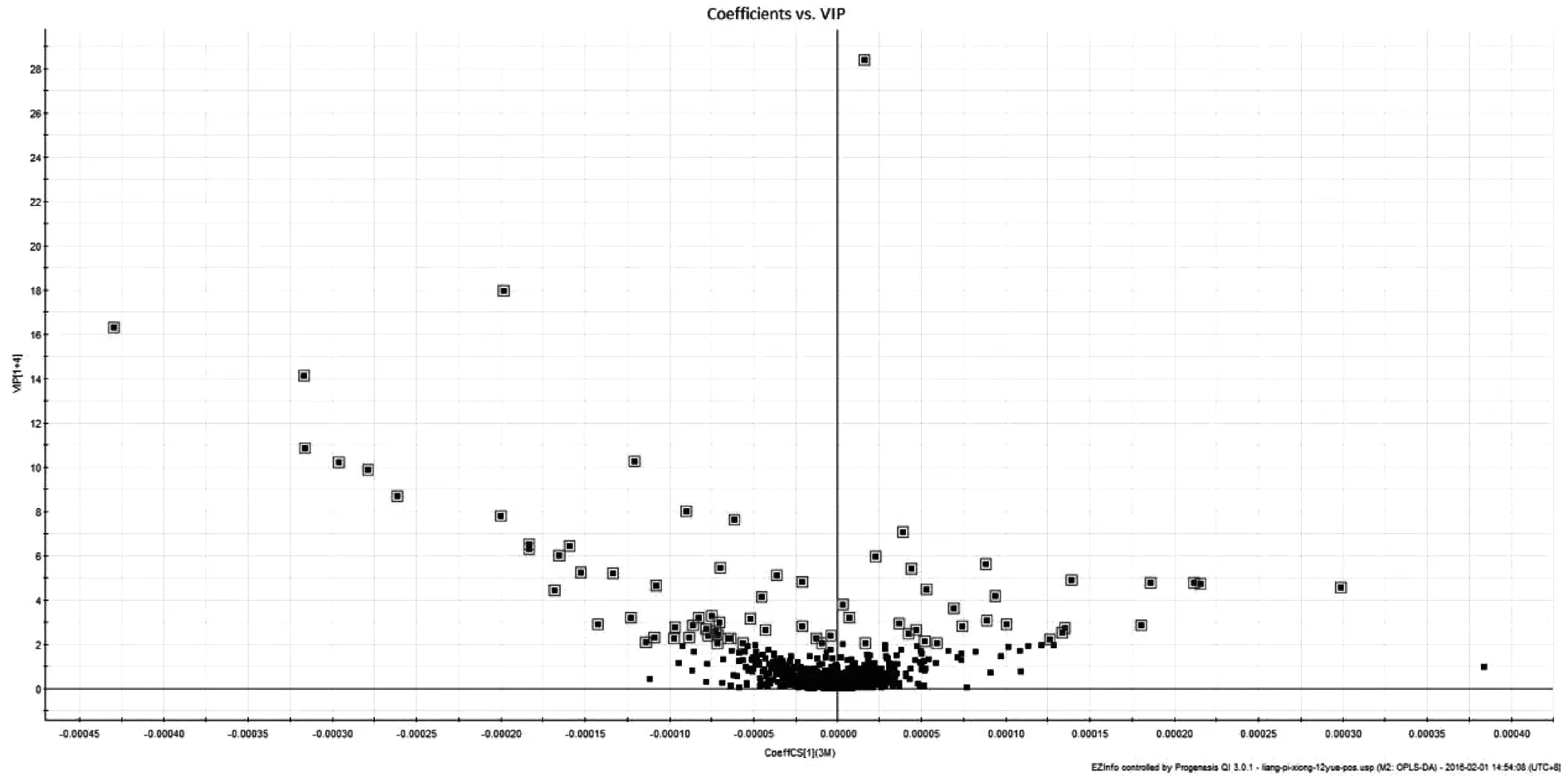
图7 正离子条件下12月模型组VIP散点图

图8 负离子条件下12月模型组VIP散点图

注:↑表示与空白组相比,模型组表达水平呈上升趋势;↓表示与空白组相比,模型组表达水平呈下降趋势
3 讨论
本实验采用自然增龄小鼠模型,利用代谢组学研究方法分析金匮肾气丸对12月龄雄性小鼠的内源性代谢差异物的调节作用,初步判定9个生物标记物:Taurodeoxycholic acid、Glycocholic acid、Xanthine、9-Hexadecenoylcholine、Lactosylceramide (d18:1/12:0)、Threonic acid、Homoanserine、6,8-Dihydroxypurine、Monoethylhexyl phthalic acid。
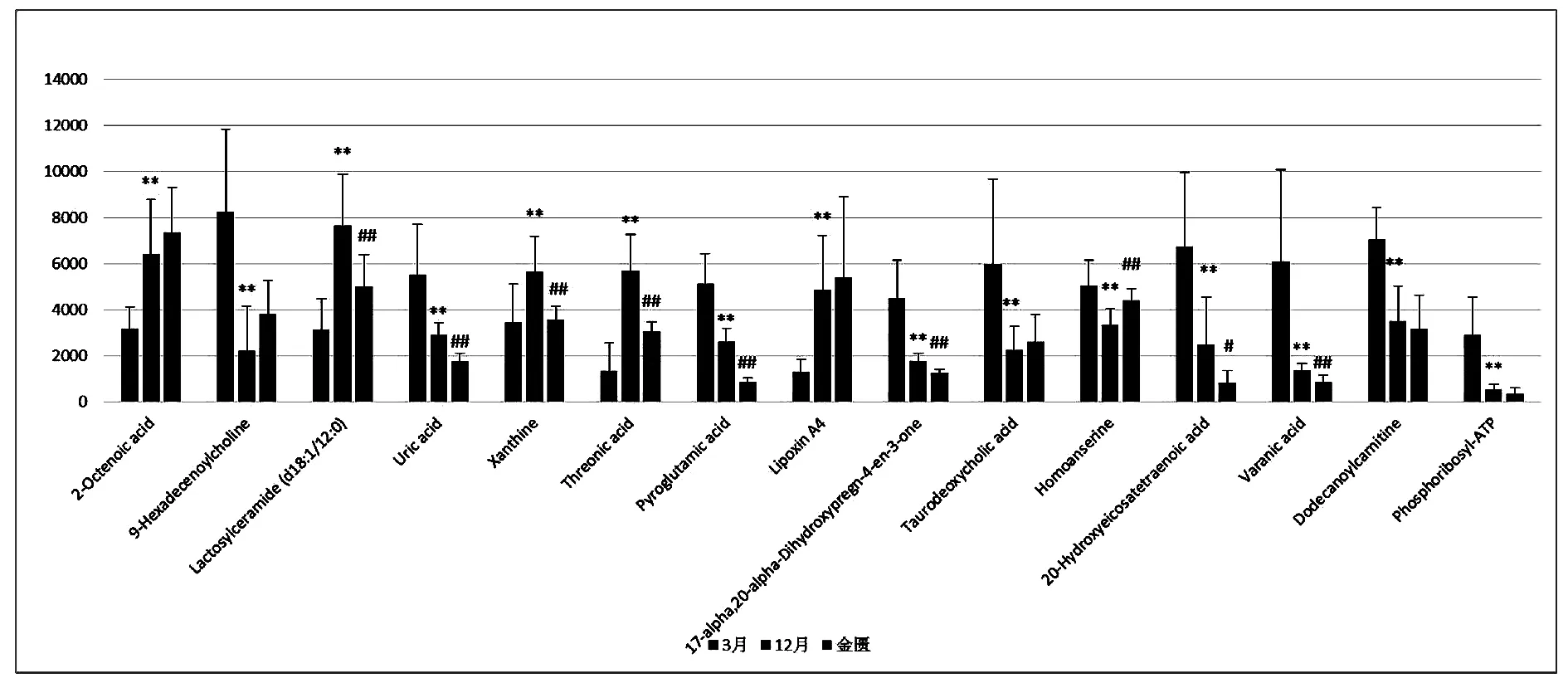
图9-1 生物标记物在3月空白组、12月模型组、 金匮组中的水平表达注:与空白组比较,*P<0.05;**P<0.01;与模型组比较,#P<0.05;##P<0.01
牛磺去氧胆酸(Taurodeoxycholic acid)是肝脏中的胆盐,由脱氧胆酸与牛磺酸结合而成,能够促进肝脏的排泄和吸收,并能够调节内分泌。牛磺酸作为机体组织细胞中一种重要的小分子含硫氨基酸,具有广泛的生理调节作用。大量实验证明牛磺酸具有增强免疫、抗氧化抗衰老、保护心血管、降血糖血脂、减轻脂肪肝、降转氨酶等诸多作用[7]。有研究证实,牛磺酸能够有效减少高糖环境下线粒体呼吸链中活性氧ROS生成,降低ROS活性,从而提高机体抗氧化能力[8]。牛磺酸对老年雄性大鼠的实验研究表明,其作用机制是增强机体清除氧自由基的能力,从而达到抗氧化目的,维持细胞内环境的稳定,从而起到保护细胞,延缓衰老的作用[9]。同时,牛磺酸对降低心肌梗死面积,改善心肌细胞,促进血管新陈代谢,保护心脏起到重要作用[10]。本实验模型组牛磺酸含量较空白组显著降低,表明牛磺酸随增龄而减少,而在金匮肾气丸给药后,含量有所上升。
甘氨胆酸(Glycocholic acid)是胆汁酸酰基甘氨酸,胆汁酸是胆固醇在肝内分解以及在肠-肝循环中的一组代谢产物,胆酸在肝内与甘氨酸结合生成甘氨胆酸,然后随胆汁排入肠道,胆汁酸是一种生理性的清洁剂,能促进脂肪和固醇在肠道和肝脏中的排泄、吸收和运输。有研究表明,高、低剂量不同的甘氨胆酸均能够不同程度的提高小鼠血浆、脑组织中T-AOC活性,以及小鼠脑组织中GSH活性,表明甘氨胆酸具有重要抗氧化作用[11]。本实验中模型组甘氨胆酸较空白组明显降低,推测机体随增龄而抗氧化能力减弱,而金匮肾气丸给药后,含量上升,说明金匮肾气丸具有提高抗氧化能力的作用。
黄嘌呤(Xanthine)是嘌呤衍生物,是嘌呤降解途径的产物。现代研究表明黄嘌呤氧化酶对于炎症、组织修复以及多种肿瘤的发展有密切关系[12]。有学者研究联合黄嘌呤氧化酶抑制剂治疗慢性心力衰竭,结果显示患者的心功能指标有改善[13]。本实验中金匮肾气丸组能显著降低模型组黄嘌呤的含量,可以推断其能够提高机体免疫力,减少炎症的发生。
单乙基己基邻苯二甲酸(Monoethylhexyl phthalic acid,MEHP)是一种活性代谢产物,邻苯二甲酸二(2-乙基已基)酯(DEHP)的主要代谢产物是邻苯二甲酸单(2-乙基已基)酯(MEHP),有实验表明,低剂量的MEHP能刺激MLTC-1细胞睾酮合成,促进相关酶基因和蛋白基因表达[14]。而睾酮作为一种重要的雄性激素,对蛋白质合成,免疫功能,抗骨质疏松等有重要影响。本实验对金匮肾气丸组中的含量进行检测发现较模型组有所回落,表明其能够促进蛋白合成,提高免疫力。
综上所述,本实验采用代谢组学研究方法,鉴定出在增龄过程中与生长发育相关的26个潜在生物标记物,在给予金匮肾气丸干预后,9个生物标志物得到调节,表明了金匮肾气丸对12月雄鼠增龄性变化的干预作用,为今后研究金匮肾气丸干预生长发育及其方证相关的生物学基础研究提供科学依据。
[1] 黄张杰,施旭光,王闽予,等.代谢组学技术在中医药研究中的应用进展[J].中药材,2013,36(12):2055-2058.
[2] 王新玲,徐希国,张桂.金匮肾气丸抗衰老作用临床观察[J].山东医药,2006,46(16):82.
[3] 王新玲,李月彩,侯颖春.金匮肾气丸抗自由基和细胞凋亡的作用[J].医学争鸣,2000,21(10):1209-1211.
[4] Jiang Q,Zheng M,Yang X,et al.Analysis of molecular networks and targets mining of Chinese herbal medicines on anti-aging[J].Bmc Complementary & Alternative Medicine,2016,16(1):520.
[5] 梁华,朱明雪,孙燕佩,等.六味地黄丸、金匮肾气丸的免疫调节作用研究进展[J].中医药学报,2012,40(2):97-99.
[6] 廖茜珣,侯伯南,罗晓光,等.金匮肾气丸治疗老年前列腺增生的临床效果观察[J].中药药理与临床,2016(5):96-98.
[7] 李大庆,吴明均,胡晓华,等.牛磺酸研究进展[J].现代生物医学进展,2011,11(2):390-392.
[8] 高亚,郭俊霞,张艳贞,等.牛磺酸降血糖作用研究进展[J].中国食品学报,2016,16(1):202-210.
[9] 杨建成,冯颖,吕秋凤,等.牛磺酸对老年雄性大鼠抗衰老作用的研究[J].中国老年学,2007,27(11):1020-1022.
[10] 王亚霓.牛磺酸的心脏保护作用及机制研究[D].天津:天津医科大学,2014.
[11] 乌云夫.甘氨胆酸对小鼠的抗氧化作用研究[D].呼和浩特:内蒙古农业大学,2013.
[12] 马文涛.黄嘌呤氧化酶、脂氧化酶和环氧化酶抑制剂的筛选及其体外抗肿瘤活性研究[D].武汉:湖北中医药大学,2016.
[13] 徐莉.黄嘌呤氧化酶抑制剂治疗慢性心力衰竭的Meta分析[D].重庆:重庆医科大学,2016.
[14] 周庆红,张静姝,陈曦,等.DBP/MBP,DEHP/MEHP影响睾丸间质细胞睾酮合成相关机制[J].中国药理学与毒理学杂志,2013,27(1):246.
