不同时间电针介入对痛记忆模型大鼠的干预效应*
2018-03-13佘丽娇何俏颖方剑乔邵晓梅
佘丽娇 孙 晶 沈 醉 何俏颖 方剑乔 邵晓梅
(浙江中医药大学第三临床医学院,杭州310053)
当个体受到外界刺激引起了组织损伤或潜在损伤都可能产生疼痛,许多病人在疾病过程中承受持续的疼痛,甚至当初始病灶痊愈后疼痛仍然存在,这一现象被称为“痛记忆”[1,2]。以痛觉过敏和痛觉超敏为特征的疼痛状态在大脑中逐渐形成相关记忆与负面情绪,这一过程由疼痛的获得、巩固以及恢复组成[3]。疼痛的最初记忆可因情绪成分的夹杂而加重,进而形成更多更复杂的记忆[3]。这一特别现象的发现引起了众多研究者的兴趣。部分研究提出痛觉神经元获得并将疼痛信号传递至大脑相关核团,例如前扣带皮层 (anterior cingulate cortex,ACC)、前额叶皮层、海马体、杏仁核和岛叶皮层,并通过短期记忆情绪环境下的反复和持续刺激继而形成长期记忆[4,5]。另有研究表明,痛记忆可能是由于首次炎症疼痛恢复后,大脑中枢神经系统突触可塑性的改变引起的[4]。针对痛记忆现象的改善目前还没有明确的治疗手段。临床上用于治疗和改善长期疼痛和慢性疼痛常用的非甾体抗炎药 (non-steroid anti-in flammatory drugs, NSAIDs),例如水杨酸类的阿司匹林、吲哚类的吲哚美辛以及丙酸类的布洛芬及芬必得等,虽然具有一定的抗炎镇痛疗效[5],但未有研究明确其对痛记忆是否有干预作用,且由于非甾体抗炎药物的胃肠道不良反应[6],很大程度上限制了这类药物在疼痛类疾病治疗中的长期应用。因此,寻求改善痛记忆现象的有效方法显得尤为必要。
电针广泛应用于中医针灸临床镇痛,且疗效确切[7~9]。研究者从外周、中枢等多个水平应用现代科学技术与方法阐述了针刺镇痛的部分机制,并取得了较大的进展[10~12]。但鲜有关于探讨电针对痛记忆干预效应的研究,本研究以角叉菜胶足跖二次交叉注射诱发痛记忆模型,观察不同时间电针和吲哚美辛干预痛记忆的效应差异,筛选治疗痛记忆的最佳介入时间和方案,为临床治疗该类疾病提供理论依据。
方 法
1.实验动物及分组
清洁级雄性Sprague-Dawley大鼠,体重180 ±200 g,购自中国科学院上海实验动物中心[许可证号:SCXK(沪)2013-0016],实验中操作均遵照中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导意见》。实验前进行适应性喂养4~5天,饲养期间自由摄食及饮水,分笼饲养,12 h昼夜循环光照,室内温度控制在(22±2)℃。实验动物分为六组,每组10只,分别为对照组(Control组)、角叉菜胶炎性痛模型组(Model组)、角叉菜胶首次造模加电针组(EA1组)、角叉菜胶二次造模加电针组(EA2组)、角叉菜胶首次造模加吲哚美辛灌胃组(Indo1组)以及角叉菜胶二次造模加吲哚美辛灌胃组(Indo2组)。
2.实验方法
(1)痛记忆模型制备
实验中Model组、EA1组及EA2组大鼠均采用Igor Kissin[13]等人提出的角叉菜胶足跖二次交叉注射诱导的痛记忆模型。首次造模,在大鼠左后足跖皮下注射2%角叉菜胶0.1 ml(美国SIGMA公司批号:1408463V);14天后,各组大鼠痛阈恢复至基础痛阈水平,在大鼠右侧足跖皮下二次注射同剂量的角叉菜胶。观察二次注射后大鼠左侧足跖的痛阈变化,痛阈降低则表明痛记忆造模成功。相同时间点,Control组大鼠则注射相同剂量的0.9%生理盐水(杭州民生药业集团有限公司批号:11210283)。
(2)电针治疗及其他处理
角叉菜胶首次注射后,EA1组选取大鼠双侧后肢“足三里”穴,采用韩式穴位神经刺激仪(HANS-200E)连接针灸针(0.25 mm×13 mm,苏州医疗用品厂)进行电针干预。电针分别连接左右两侧的“足三里”穴和参考电极(足三里后下1 cm)。刺激参数为疏密波2/100 Hz,强度1~2 mA(每10 min增加0.5 mA),时间30 min。干预时间分别为一次注射后4 h、1~5 d行为学检测前进行干预,连续6次。EA2组大鼠于角叉菜胶二次注射后进行电针干预,选穴和刺激参数与EA1组相同,干预时间为二次注射后4 h、1~3 d行为学检测前,连续4次。Model组大鼠于相同时间点作与电针干预组大鼠相同的固定处理。Indo1组大鼠与EA1组大鼠于相同时间点,以吲哚美辛(山西云鹏制药有限公司批号:H14020771)按3 mg/kg剂量灌胃,连续6次。Indo2组大鼠采用相同方法与EA2组大鼠同时间点操作,连续4次,观察其痛阈的变化。
(3)机械痛阈检测
采用据经典von Frey丝法[14]改良的动态足底触觉仪(意大利UGO BASIL公司型号:37450)在一次和二次注射前检测大鼠双侧后足跖缩足阈(paw withdrawal thresholds, PWTs)作为基础痛阈值。然后分别检测一次注射后4 h、1 d、3 d、5 d及二次注射后4 h、1 d、2 d、3 d的机械痛阈值。检测时,将大鼠单独放入底面为铁丝网的有机玻璃盒中,室内温度保持23~25℃,湿度45%~55%,噪音40 dB以下,休息约20 min左右,待大鼠安静后开始检测。不锈钢探针(直径0.5 mm)垂直上升至大鼠后足掌底中部(避开足垫)后,以2.5 g/s的速度逐渐增大刺激强度,以大鼠缩足或刺激量达到最大值(50 g)为准,仪器自动记录缩足时探针触力。大鼠双侧足跖连续检测5次,每次间隔约5 min,计算其后4次平均值。检测时间置于上午9点至下午3点间。各组大鼠于基础痛阈测量前进行两天适应性痛阈的检测,以减少实验环境对大鼠痛阈的影响。
5.统计方法与分析
采用SPSS软件统计分析,所有数据以均数±标准误(x±SEM)表示。PWTs数据多组间比较采用单因素方差分析(ANOVA),组间两两比较,方差齐性时采用LSD检验,方差不齐时采用Dunnett' s T3检验;每组间造模前后比较采用配对t检验。P< 0.05为差异有统计学意义。
结 果
1.痛记忆模型
如图1示,图1A和图1B为各组大鼠角叉菜胶首次注射前后左侧(注射侧)和右侧(未注射侧)足跖各时段的痛阈变化。从图1A可见首次造模前,各组大鼠造模侧(左侧)足跖基础痛阈无统计学差异。造模后4 h、3 d及5 d测得大鼠痛阈,与Control组相比,Model组大鼠痛阈明显降低(P< 0.05)。从图1B可见各组大鼠未造模侧(右侧)各时段足跖痛阈均无统计学差异。图1C和1D为各组大鼠角叉菜胶二次造模前后大鼠双侧足跖的痛阈变化。14 d后各组大鼠双侧足跖基础痛阈已恢复正常,此时开始对之前未造模侧(右侧)足跖进行角叉菜胶二次造模。如图1C所示,与Control组相比,Model组大鼠未造模侧(左侧)足跖痛阈在二次造模后1~3 d明显下降(P< 0.05)。如图1D所示,与Control组相比,Model组大鼠造模侧(右侧)足跖痛阈在4 h、1~3 d明显下降(P< 0.05)。二次未注射角叉菜胶足跖痛阈下降的现象,被认为是痛记忆发生的证据[15],因此本研究主要观察了各组大鼠二次未造模侧足跖痛阈的变化情况。
2.电针早期干预与吲哚美辛对痛记忆模型大鼠PWTs的干预效应比较
电针和吲哚美辛于首次造模后干预如图2所示,图中可见Model组、EA1组及Indo1组大鼠两次造模前后双侧足跖的痛阈变化。如图2A所示,与模型组相比,EA1组及Indo1组大鼠在首次造模后3~5 d造模侧(左侧)足跖痛阈明显上升(P< 0.05),未造模侧无明显差异。二次造模前各组大鼠痛阈恢复至正常值,如图2C所示,与Model组相比,EA1组大鼠未造模侧(左侧)足跖痛阈在1~3 d明显增高(P< 0.05);Indo1组大鼠未造模侧足跖痛阈仅于1 d有明显增高(P< 0.05)。与Indo1组相比,EA1组大鼠未造模侧足跖在2 ~3 d痛阈明显增高(P< 0.05)。
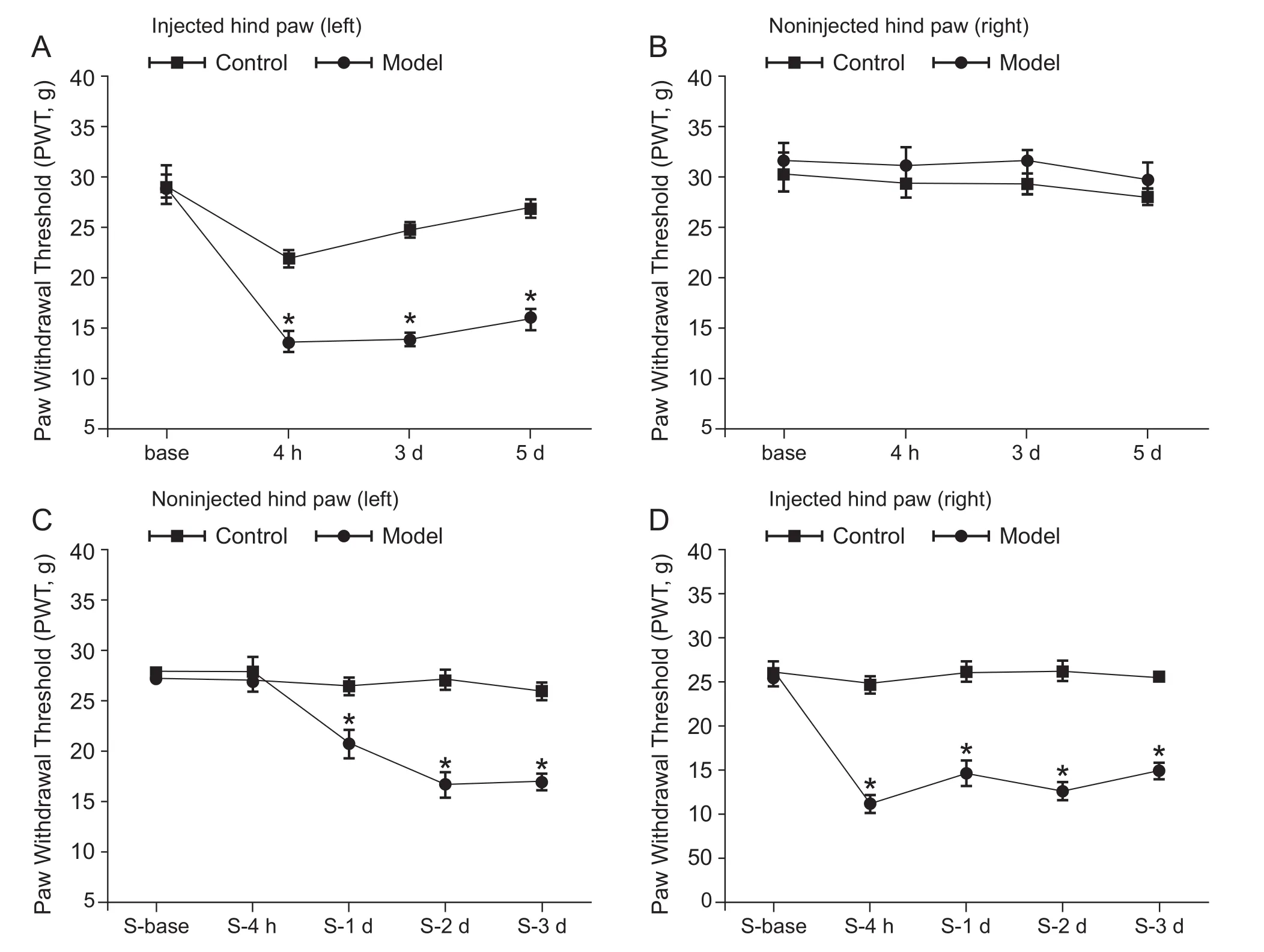
图1 各组大鼠首次及二次造模前后双侧足跖PWTs的变化(x±SEM)与Control组相比,*P < 0.05Fig.1 The changes of bilateral PWTs before and after the first or secondary injection of all groups (x±SEM)*P < 0.05,compared Control group.
3.电针后期干预与吲哚美辛对痛记忆模型大鼠PWTs的干预效应比较
电针和吲哚美辛于二次造模后干预如图3所示,图中可见Model组、EA1组及Indo1组大鼠二次造模前后未造模侧(左侧)足跖的痛阈变化。从图3A及图3B中可看出,各组大鼠在首次造模前后双侧足跖痛阈均无统计学差异(P> 0.05)。14 d后大鼠足跖痛阈恢复至基础水平,进行二次造模。从图3C中可看出,与Model组及Indo2组相比,EA2组大鼠未注射侧(左侧)足跖痛阈在2~3 d均有明显增高(P< 0.05);图3D中,与Model组相比,EA2组和Indo2组大鼠注射侧(右侧)足跖痛阈在1~3 d均明显增高(P< 0.05)。
3.不同时间电针介入对痛记忆模型大鼠机械痛阈的干预效应比较
图4为电针在首次及二次造模后介入对痛记忆模型大鼠未造模侧(左侧)足跖痛阈的影响。如图所示,二次造模前各组大鼠基础痛阈均无统计学差异。造模后与EA2组相比,EA1组大鼠未造模侧(左侧)足跖痛阈在2~3 d有明显增高(P< 0.05)。
讨 论
Igor Kissin等人在2006年建立的角叉菜胶足跖二次交叉注射痛记忆模型,由于大鼠造模后的行为学表现与人类炎性疼痛表现相似,被广泛应用于痛记忆的研究中。痛记忆的形成机制可能与大脑中枢的疼痛信息传输与储存相关[16]。当机体曾经经历的痛苦或不愉快情绪及其他相关的疼痛信息传输至大脑中枢并储存于记忆中,当类似情景再次发生便会再次唤醒痛记忆并引发逃避厌恶的现象[17,18]。近期有研究表明[19,20],小鼠脑中存在多种类型的记忆,并且这些记忆可能发生重叠,其中不愉快的部分则会影响行为表现。因此,如何有效擦除痛记忆痕迹以及其相关机制研究显得尤为必要[21,22]。本次实验成功复制了“痛记忆”模型,14 d后Model组二次造模,未注射侧足跖痛阈明显下降,提示造模成功,痛记忆被唤醒。

图2 不同疗法早期干预对模型大鼠痛记忆的影响(x±SEM)与Model组相比,#P < 0.05; 与Indo1组相比,*P < 0.05Fig.2 The effects of early intervention on pain memory of the model rats (x±SEM)#P < 0.05, compared with Model group; *P < 0.05, compared with Indo1 group.
电针应用广泛且镇痛效果明显有效,其在疾病发生发展的不同时段介入也会产生不同的效应。电针参与下行抑制通路,将大脑中的化学物质传输至脊髓细胞中,阻碍疼痛受体产生的疼痛信号从而达到镇痛效果[23]。之前有研究表明,电针的早期干预可以有效缓解大鼠痛记忆现象的唤醒,其机制可能与脊髓背角 (spinal cord dorsal horn, SCDH) 星形胶质细胞相关[24]。电针可能影响神经营养因子的释放,例如脑源性营养因子(BDNF)、神经胶质细胞型营养因子(GDNF)等,进而产生镇痛作用[25]。此外有研究证明,重复电针可明显改善慢性痛大鼠的痛感觉及痛情绪,其机制可能与大鼠杏仁核GluA1蛋白相关[26]。而早期干预与痛记忆形成后再干预之间的镇痛效应差异鲜有研究。本实验在痛记忆模型大鼠一次造模和二次造模各时段介入电针治疗,首次造模时介入的EA1组大鼠注射侧痛阈明显上升,且在二次造模痛记忆唤醒后,大鼠未注射侧足跖仍然明显高于Control组。此外,与EA2组相比,EA1组在首次造模与痛记忆唤醒后的痛阈也明显增高。提示电针的介入能有效阻断痛记忆现象的唤醒,且早期干预比痛记忆形成之后再介入治疗更具有效性。NSAIDs的消炎、镇痛以及解热作用明确且广泛应用于多种急慢性疼痛甚至癌性痛中[27],但副作用不容忽视[28,29],这使得对针灸的研究显得更为必要,便于为临床提供更优质的治疗方式。实验中,我们采用吲哚美辛灌胃的方式与电针组进行比较,结果提示首次造模时介入的Indo1组大鼠注射侧足跖痛阈较Model组明显升高,而痛记忆形成后,其痛阈并无明显变化。这表明NSAIDs能有效缓解疼痛现象,但对痛记忆的唤醒并没有明显阻断效应。

图3 不同疗法后期干预对模型大鼠痛记忆的影响(x±SEM)与Model组相比,#P < 0.05; 与Indo1组相比,*P < 0.05Fig.3 The effects of later intervention on pain memory of the model rats (x±SEM)#P < 0.05,compared with Model group; *P < 0.05,compared with Indo1 group.
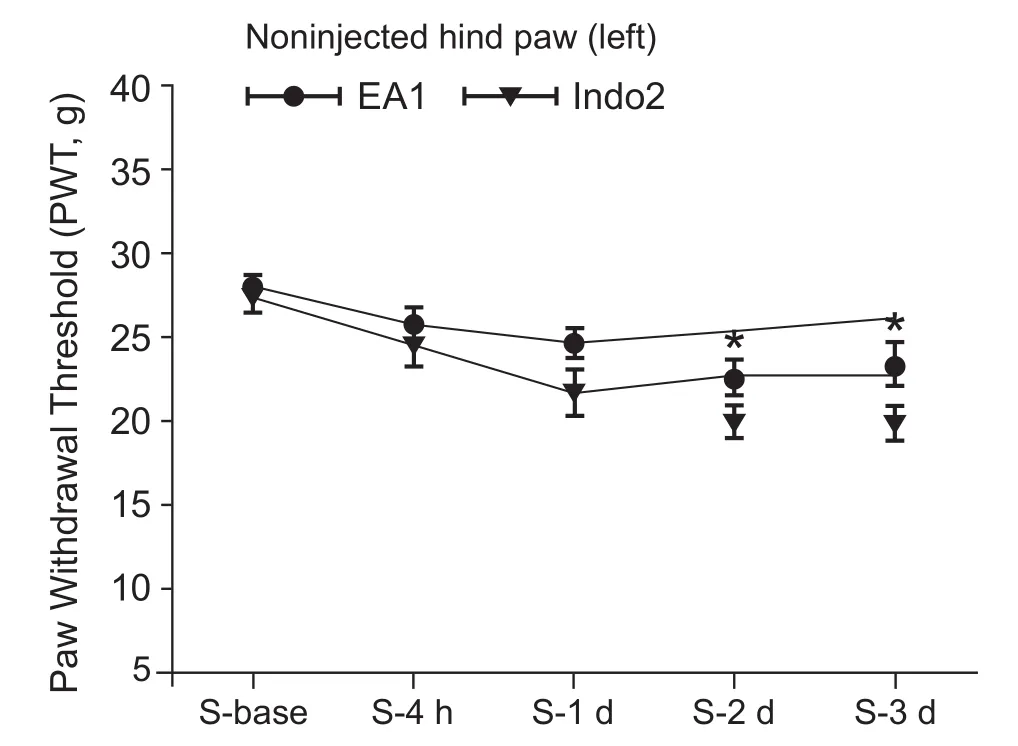
图4 不同时间电针干预对模型大鼠痛记忆的影响(x±SEM)与EA2组相比,*P < 0.05Fig.4 The effect of EA at different intervention time on pain memory of the Model rats (x±SEM)*P < 0.05, compared with EA2 group.
本研究结果揭示了电针对痛记忆有抑制作用,且早期干预优于晚期干预,这为临床应用针灸治疗疼痛类疾病提供良好的理论研究基础。常用NSAIDs对痛记忆无明显干预效应,提示电针和NSAIDs虽可能均有相似镇痛机制,但对痛记忆的干预作用不尽相同。
[1]Theodore JP, Kufreobong EI.Commonalities between pain and memory mechanisms and their meaning for understanding chronic pain.Prog Mol Biol Transl Sci,2015, 131: 409~ 434.
[2]Jaymin U, Julia G, Thomas B,et al.Detection of central circuits implicated in the formation of novel pain memories.J Pain Res, 2016:9 671~ 681.
[3]Tajerian M, Leu D, Zou Y,et al."Brain neuroplastic changes accompany anxiety and memory deficits in amodel of complex regional pain syndrome," Anesthesiology, 2014, 121( 4): 852~ 865.
[4]Morris KA, Gold PE.Age-related impairments inmemory and in CREB and pCREB expression in hippocampus and amygdala following inhibitory avoidance training, Mech Ageing Dev, 2012, 133(5):291~ 299.
[5]Navratilova E, Xie JY, Meske D,et al."Endogenous opioid activity in the anterior cingulate cortex is required for relief of pain," J Neurosci, 2015, 35(18):7264~ 7271.
[6]Choi D, Whittington R, Nedeljkovic S.Sudden amnesia resulting in pain relief: the relationship between memory and pain.Pain, 2007, 132(1-2):206~ 210.
[7]Ji R, Kohno T, Moore K,et al.Central sensitization and LTP: do pain and memory share similar mechanisms?Trends Neurosci, 2003, 26(12):696~ 705.
[8]FINE M.Quantifying the impact of NSAID-associated adverse events.Am J Manag Care, 2013,19 (Suppl 14):S267~ S272.
[9]Kangwan N, Park JM, Hahm KB.Development of GI-safe NSAID; progression from the bark of willow tree to modern pharmacology.Curr Opin Pharmacol, 2014,19:17~ 23.
[10]Becerra L, Navratilova E, Porreca F,et al.Analogous responses in the nucleus accumbens and cingulate cortex to pain onset (aversion) and offset (relief) in rats and humans.J Neurophysiol, 2013, 110:1221~ 1227.
[11]Xu J, Zheng X, Cheng KK,et al.NMR-based metabolomics RevealsAlterations of Electro-acupuncture Stimulationson Chronic Atrophic Gastritis Rats.Sci Rep-UK, 2017, 30(7):45580.
[12]Lewis J, Sim J, Barlas P.Acupuncture and electro-acupuncture for people diagnosed with subacromial pain syndrome: A multicentre randomized trial.Eur J Pain,2017, 21(6):1007~ 1019.
[13]Tu WZ, Chen WC, Xia W,et al.The regulatory effect of electro-acupuncture on the expression of NMDA receptors in a SCI rat model.Life Sci, 2017, 15(177):8~ 14.
[14]余晓佳, 詹睿, 黄红,等.手针与电针“足三里”穴镇痛效应的穴位传入机制差异性分析.针刺研究,2008, 33(5):310~ 316.
[15]黄诚,王韵,石玉顺,等.小鼠低频和高频电针镇痛阿片机制的探讨.中国疼痛医学杂志, 2000, 6(2):96~103.
[16]Kissin I, Freitas CF, Bradley EL,et al.Memory of Pain:The Effect of Perineural Resiniferatoxin.Anesth Analg,2006, 103(3):721~ 728
[17]Chaplan SR, Bach FW, Pogrel JW,et al.Quantitative Assessment of Tactile Allodynia in the Rat Paw.J Neurosci Methods, 1994, 53(1):55~ 63
[18]Terry R, Brodie EE, Niven CA.Exploring the phenomenology of memory for pain: is previously experienced acute pain consciously remembered or simply known?J Pain, 2007, 8 (6):467~ 475.
[19]张玉秋.痛情绪和相关记忆产生的神经机制.自然科学进展, 2005, 15(12):1409~ 1415.
[20]Yokose J, Okubo-Suzuki R, Nomoto M,et al.Overlapping memory trace indispensable for linking, but not recalling, individual memories.Science, 2017,355(6323):398~ 403.
[21]Choi DS, Choi DY, Whittington RA,et al.Sudden amnesia resulting in pain relief: the relationship between memory and pain.Pain, 2007,132(1-2):206~ 210.
[22]Sandkühler J, Lee J.How to erase memory traces of pain and fear.Trends Neurosci, 2013, 36(6):343~ 352.
[23]Han JS.Acupuncture analgesia and its related neural pathways and neurotransmitter.生理科学进展, 1984,15(4):294~ 300.
[24]李介义,方芳,孙晶,等.电针预处理对痛记忆模型大鼠的干预效应及脊髓背角p-CREB 的相关性研究.浙江中医药大学学报, 2016, 5:40 (5):339~ 347.
[25]Wang JY, Gao YH, Chen SP,et al.The effect of repeated electroacupuncture analgesia on neurotrophic and cytokine factors in neruopathic pain rats.Evid Based Complement Alternat Med, 2016, 5:1~ 12.
[26]闫娅霞,冯秀梅,王俊英,等.电针对慢性痛大鼠痛感觉和情绪成分相关杏仁核内μ-阿片受体等蛋白表达的影响.针刺研究, 2016, 40(1):3~ 10.
[27]Nalamachu S.An Overview of pain management: the clinical efficacy and value of treatment.Am J Manag Care, 2013,19 (Suppl 14):S261~ S266.
[28]Lewis SC, Langman MJ, Laporte JR,et al.Dose-response relationships between individual nonaspirin nonsteroidal anti-in flammatory drugs (NANSAIDs) and serious upper gastrointestinal bleeding: a meta-analysis based on individual patient data.Br J Clin Pharmacol,2002, 54(3):320~ 326.
[29]FINE M.Quantifying the impact of NSAID-associated adverse events.Am J Manag Care, 2013,19 (Suppl 14):S267~ S272.
