Parkin基因与恶性肿瘤的相关性研究进展
2018-03-12彭星辰
孙 羽,彭星辰
SUN Yu,PENG Xing-chen
(四川大学华西医院头颈部肿瘤科,四川 成都 610000)
从二十世纪九十年代末期发现Parkin基因以来,各国学者针对该基因展开了大量的研究,迄今为止,许多的研究证实了Parkin的作用广泛,除了AR-JP之外,它与2型糖尿病、阿茨海默病、多发性硬化症等多种疾病有关[1,2]。最近的研究发现:Parkin的丢失或功能异常与多种恶性肿瘤存在一定的关系,多数学者认为Parkin是一种抑癌基因。本文总结了Parkin、线粒体自噬,并讨论了目前在癌症中Parkin的相关研究成果。
1 Parkin基因、Parkin蛋白及功能
1.1Parkin基因的发现于二十世纪九十年代末期日籍学者Asakawa等在研究AR-JP病因的过程中发现了Parkin基因[1]。Matsumine等分析了AR-JP家族病人的DNA,该基因定位在6号染色体的长臂上(6q25-q27),具有1395个碱基对的开放阅读框架。Parkin基因在基因库中编号为AB009973,它具有12个外显子,它们编码的蛋白质,被称为Parkin 蛋白,包含了465个氨基酸,分子量大约为 52 kDa。
1.2Parkin蛋白的结构Parkin蛋白是具有RBR结构的E3泛素连接酶。Parkin蛋白从N端到C端,分别由UBL、RING0、RING1、IBR、REP、RING2组成。其中的UBL和RING1-IBR-RING2(RBR)是Parkin蛋白区别与其他蛋白的标志性结构,见图1。

图1 Parkin蛋白的二维结构
Parkin蛋白的三维结构:在生理情况下,Parkin处于一种不活跃的状态,这是因为Parkin存在两种自身抑制机制:一是RING1区域的泛素结合酶E2的结合位点被UBL和REP遮蔽。二是RING2区域中的催化点被RING0遮蔽。RING0隐藏了具有催化作用的半胱氨酸431(C431),阻止了泛素结合酶E2由RING1向RING2的转移。值得注意的是,Parkin的催化点C431与E2的结合点有一定距离,表明了在生理条件下,Parkin蛋白需要保持着一种紧密的类似蛇形的结构(如图2),从而抑制自身的活性,而Parkin的激活需要大量的构象变化。
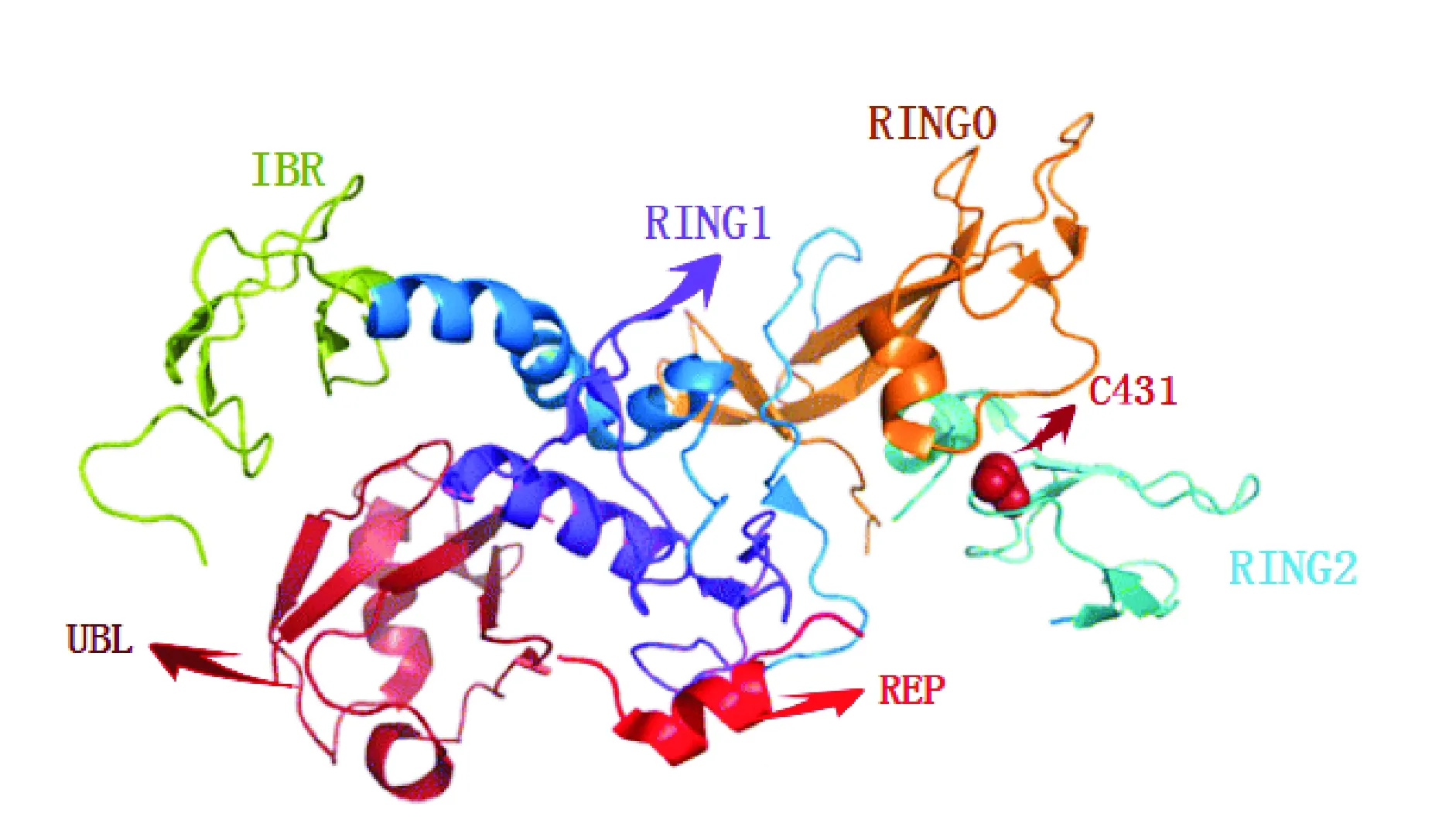
图2 Parkin蛋白的三维结构图
1.3Parkin的功能Parkin的功能广泛,包括对泛素蛋白酶体途径(UPP)及线粒体自噬的调节,它还参与了多个信号通路和细胞生理过程[3]。除了帕金森病外,迄今为止许多的研究证实,Parkin的突变还与2型糖尿病、阿茨海默病、多发性硬化症及多种癌症的发生有关[1,2,4]。
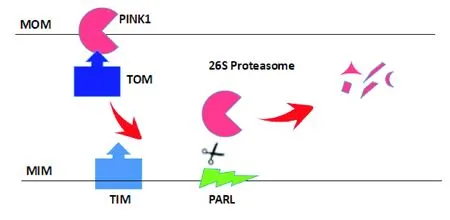
图3 健康的线粒体中PINK1的降解
1.4线粒体自噬近期的研究发现Parkin是通过调节线粒体自噬,来控制线粒体的数量和质量。线粒体自噬是在自噬体内通过降解途径清除掉受损的或过多的线粒体的一个生理过程。该过程用于维护线粒体的功能,细胞的新陈代谢,防止线粒体DNA (mtDNA) 的突变和活性氧(ROS)的积累。线粒体自噬的靶点是磷酸酶PTEN诱导的激酶 (PINK1),损伤的线粒体及细胞的压力反应为线粒体自噬的触发因素。①在健康的线粒体中,PINK1由线粒体外膜及内膜转移酶的复合体导入线粒体内,线粒体膜内相关的PARL蛋白酶将PINK1分解及降解。如图3。②在受损的线粒体中,线粒体膜发生去极化,导致PINK1固定在线粒体外膜上并通过自体磷酸化而激活。激活的PINK1还会磷酸化许多底物,包括Parkin及泛素,同时有实验表明磷酸泛素化(p-Ub)与磷酸化的Parkin高亲和力地结合在一起,使Parkin产生了一种构象的变化,促进了E2的募集,从而激活了Parkin[5]。Parkin能迅速催化大量的线粒体蛋白泛素化,随后泛素化的线粒体蛋白质组与自噬机构连接,并开始选择性自噬。线粒体自噬的详细过程如下图4。

图4 线粒体自噬
2 Parkin基因与肿瘤
越来越多的证据表明,Parkin基因的丢失或突变可能与癌症存在一定的关系(如图5)。而最近的研究发现Parkin突变的频率较高的是宫颈癌(5.6%)、肺鳞状细胞癌(5.6%),结肠直肠癌(2.4~5.6%)、胃癌(4.6%)、皮肤黑色素瘤(3.5%)、肺腺癌(2.7%~3.1%)和子宫内膜样癌(2.1%)[6]。已经发现Parkin表达异常的癌症有:卵巢癌、乳腺癌、子宫内膜癌、宫颈癌、胰腺癌、肾癌、肺癌、肝癌、结直肠癌、黑素瘤、胶质母细胞瘤、B细胞非霍奇金淋巴瘤伯基特淋巴瘤、急性淋巴细胞白血病和慢性粒细胞白血病。

图5 Parkin的缺失对肿瘤的影响
2.1原发性肝细胞癌(HCC) 既往实验表明:与野生型小鼠相比,Parkin-/-的高龄(72周以上)小鼠更容易发生HCC,这表明Parkin基因的缺失可能不足以驱动肝细胞快速转化成肝癌细胞[7]。在Parkin基因缺乏的小鼠中肝脏自发性肿瘤形成,也许与长期毒性底物的累积、线粒体自噬功能缺陷有关,这需要进一步的研究。
2.2乳腺癌在某些乳腺癌细胞中,发现了Parkin基因在六号染色体上的脆性位点 FRA6E 消失,导致了Parkin蛋白的表达减少[8]。另有研究报道,Parkin蛋白的两种底物,细胞周期蛋白D和细胞周期蛋白E,在乳腺癌中被上调,这表明Parkin蛋白的功能是受到抑制的[9]。这可能与 Parkin蛋白的异常影响了UPS(泛素-蛋白酶体系统)有关。有趣的是,研究表明Parkin蛋白通过调节线粒体的代谢来影响乳腺癌[10]。在癌症的进展过程中,癌细胞将线粒体的有氧呼吸转化为糖酵解来维持癌细胞对能量的需求(称为Warburg效应)。Parkin蛋白通过负向调节能量代谢,减轻Warburg效应[11]。将Parkin基因转移至原本无该基因的乳腺癌细胞中,发现乳腺癌的进展及转移的速度明显降低。这些都支持Parkin基因在乳腺癌中,有可能起到抑制肿瘤的作用。同时微管在近几十年来一直是癌症治疗的靶点。Parkin蛋白促进微管的聚合,从而增加微管的稳定,与紫杉醇治疗起协同作用,同时拮抗解聚药物[12]。
2.3肺癌Parkin基因的缺失及突变在肺癌中常见。cBioPortal对癌症基因组的研究显示,2.7%~3.5%的肺腺癌、5.6%的肺鳞状细胞癌和4.8%的非小细胞肺癌中都发现了Parkin基因的体细胞突变[6]。另有研究显示,在家族性肺癌中发现了一些的Parkin基因的失活突变,它是独立于吸烟的肺癌易感因素,Parkin基因失活突变增加了肺癌的易感性[13]。
2.4结直肠癌在Apcmin老鼠模型中:Parkin +/-;APC +/min的小鼠与同窝出生的Parkin +/+;APC +/min的小鼠相比,表现出较高的腺瘤发病率和肿瘤发生的时间更早,提示Parkin基因具有抑制肿瘤的功能[14]。另一项研究发现,在已经确诊为结肠直肠癌的患者中,在部分患者的肝脏转移病灶中发现有Parkin基因的灶性缺失,而原发病灶中没有发现,进一步推测Parkin基因的缺失或功能丧失与某些肿瘤的转移有关[15]。
2.5胶质母细胞瘤通过分析癌症基因组图谱,我们发现大约有四分之一的胶质母细胞瘤样本中,存在Parkin基因的杂合子或纯合子丢失,以及Parkin基因的点突变[16]。由于蛋白在大脑中为高水平表达,胶质母细胞瘤的发生可能对Parkin基因的损失特别敏感。研究证实预后差的神经母细胞瘤,它的一种细胞亚型是通过扩增癌基因N-Myc来表现的。N-Myc 和Parkin蛋白的水平在神经细胞瘤细胞中呈反向关系,染色质免疫实验表明,N-Myc 直接通过与Parkin基因的启动子区域的结合来抑制Parkin基因的转录[17]。
2.6卵巢癌研究显示,卵巢癌一般与线粒体自噬机构的下调有关,化学诱导线粒体自噬抑制卵巢肿瘤的扩散,但是自噬反应是通过内质网的压力,这表明了线粒体自噬触发的部位有所不同[18]。在卵巢癌和神经母细胞瘤、乳腺癌的研究中,发现了它们的一些共同特征,即N-Myc和细胞周期蛋白E在这些肿瘤细胞及其子代细胞中都有上调[19]。由此推断N-Myc抑制了Parkin基因的转录,而当Parkin蛋白失去了功能时,细胞周期蛋白E就会积累增多,Parkin蛋白可能会间接地调节卵巢癌的细胞周期。
2.7胰腺癌实验发现缺乏Parkin基因的老鼠更容易发生胰腺癌,Parkin基因的减少促进了胰腺癌细胞的增殖和扩散的能力,而Parkin基因的过度表达又抑制了多个癌细胞的迁移和入侵,上述实验提示Parkin基因有抑制胰腺癌的可能,其表达水平与胰腺癌的恶性程度呈正相关,与淋巴结转移呈负相关[20]。
3 展望
Parkin基因的作用广泛,其编码的蛋白为E3,参与及调节了线粒体自噬,并以此来控制线粒体的质量及数量。近年来的研究表明,Parkin基因的缺失及功能紊乱可能与癌症存在一定的联系,但目前尚未查明其具体的作用机制,需要进一步的研究。希望通过对 Parkin基因在癌症方面进一步的研究及探索,可以发现相关癌症的致病因素以及防治方案。
[1] Kitada T,Asakawa S,Hattpri N,et al.Mutation in the parkin gene cause autosomal recessive juvenile parkinsonism[J].Nature,1998,392:605-608.
[2] Klimczak PF,Ventury DH,Faucz FR,et al.Association of a PARK2 germline variant and epithelial ovarian cancer in a Southern Brazilian population[J].Oncology,201,91(2):101-5.
[3] Manzanillo PS,Ayres JS,Watson RO,et al.The ubiquitin ligase parkin mediates resistance to intracellular pathogens[J].Nature,2013,501:512-516.
[4] Cerami E,Gao J,Dogrusoz U,et al.The cBio cancer genomics portal:an open platform for exploring multidimensional cancer genomics data[J].Cancer Discov,2012,2:401-404.
[5] Sauve V,Lilov A,Seirafi M,et al.A Ubl/ubniquitin switch in the activation of Parkin[J].EMBO,2015,34:2492-2505.
[6] Cerami E,Gao J,Dogrusoz U,et al.The cBio cancer genomics portal:an open platform for exploring multidimensional cancer genomics data[J].Cancer Discov,2012,2:401-404.
[7] Fujiwara M,Marusawa H,Wang HQ,et al.Parkin as a tumor suppressor gene for hepatocellular carcinoma[J].Oncogene,2008,27:6002-6011.
[8] Noviello C,Courjal F,Theillet C.et al.Loss of heterozygosity on the long arm of chromosome 6 in breast cancer:possibly four regions of deletion[J].Clin Cancer Res,1996,2:1601-1606.
[9] Courjal F,Louason G,Speiser P,et al.Cyclin gene amplification and overexpression in breast and ovarian cancers:evidence for the selection of cyclin D1 in breast and cyclin E in ovarian tumors[J].Int J Cance,1996,69:247-253.
[10]Santidrian AF,Matsuno-Yagi A,Ritland M,et al.Mitochondrial complex I activity and NAD+/NADH balance regulate breast cancer progression[J].J Clin Investig 2013,123:1068-1081.
[11]Zhang C,Lin M,Wu R,et al.Parkin,a p53 target gene,mediates the role of p53 in glucose metabolism and the Warburg effect[J].Proc Natl Acad Sci U S A,2011,108:16259-16264.
[12]Ren Y,Jiang H,Yang F,et al.Parkin protects dopaminergic neurons against microtubule-depolymerizing toxins by attenuating microtubule-associated protein kinase activation[J].J Biol Chem 2009,284:4009-4017.
[13] Xiong D,Wang Y,Kupert E,et al.A Recurrent Mutation in PARK2 Is Associated with Familial Lung Cance[J].The American Journal of Human Genetics,2015,96(2):301-308.
[14]Poulogiannis G,McIntyre RE,Dimitriadi M,et al.PARK2 deletions occur frequently in sporadic colorectal cancer and accelerate adenoma development in Apc mutant mice[J].Proc Natl Acad Sci USA,2010,107:15145-15150.
[15]Vakiani E,Janakiraman M,Shen R,et al.Comparative genomic analysis of primary versus metastatic colorectal carcinomas[J].J Clin Oncol 2012,30:2956-2962.
[16]Mulholland PJ,Fiegler H,Mazzanti C,et al.Genomic profiling identifies discrete deletions associated with translocations in glioblastoma multiforme[J].Cell Cycle,2006,5:783-791.
[17]West AB,Kapatos G,O'Farrell C,et al.N-myc regulates parkin expression[J].J Biol Chem,2004,279:28896-28902.
[18]Kandala PK,Srivastava SK.Regulation of macroautophagy in ovarian cancer cells in vitro and in vivo by controlling glucose regulatory protein 78 and AMPK[J].Oncotarget 2012,3:435-449.
[19]Helland A,Anglesio MS,George J,et al.Deregulation of MYCN,LIN28B and LET7 in a molecular subtype of aggressive high-grade serous ovarian cancers[J].PLoS One,2011,6(4):18064.
[20]Sun XD,Liu M,Hao JH,et al.Parkin deficiency contributes to pancreatic tumorigenesis by inducing spindle multipolarity and misorientatio[J].Cell Cycle,2013,12:1133-1141.
