肝硬化腹水继发急性肾损伤患者相关因素分析
2018-03-12李良平
雷 蕾,李良平,张 虎
(1.四川省医学科学院·四川省人民医院消化内科,四川 成都 610072;2四川大学华西医院消化内科,四川 成都 610041)
肝硬化是临床常见的进行性、慢胜肝病,病理上以再生结节和假小叶的形成为特征。肝硬化一旦出现严重并发症,病死率极高[1],急性肾损伤(acute kidney injury,AKI)是其中较为严重的并发症之一,主要表现为肾小球滤过率(GFR)进行性下降,血肌酐(SCr)和尿素氮迅速升高,伴电解质紊乱及水钠潴留[1]。有报道在肝硬化住院患者中AKI的发生率约19%[2],这也是肝硬化患者死亡的主要因素以及不良预后的独立因素[1]。肝硬化合并AKI提示预后不良,30 d的病死率是未合并AKI患者的10倍[3],患者病死率高,预后极差。AKI的诊断每延误12 h,其住院病死率增加2.7倍[2]。肝硬化腹水患者继发AKI常常有诱因,因此了解这些诱因,及时纠正以及治疗这些危险因素,为早期干预、预防该病的发生提供临床参考依据。
1 资料与方法
1.1一般资料2015年1月至2016年6月四川省人民医院住院的肝硬化腹水患者105例。纳入标准:肝硬化合并腹水,符合2012年美国肝病学会发布的《成人肝硬化腹水诊疗指南》诊断标准;AKI组纳入标准采用2012年发布的KDIGO标准[4]:48 h内SCr增高≥26.5 μmol/L;或7 d内SCr升至≥1.5倍基线值。排除标准:①在治疗前后使用了明确具有肾毒性的药物,造成肾损伤的患者;②具有其他基础性肾病或肝癌及其他癌症患者;③合并有高血压、糖尿病等全身综合性疾病或其他容易引起肝肾损伤的疾病,如冠心病、风湿免疫性疾病等。根据血肌酐值动态变化将患者分为AKI组56例和非AKI组49例。AKI组男35例,女21例;年龄[(62.4±9.0)]。非AKI组男31例,女18例;年龄[(61.4±10.0)岁]。两组年龄、性别和肝硬化病程等差异均无统计学意义(P> 0.05)。本研究患者均知情同意并通过本院伦理委员会批准。
1.2观察指标设计临床登记表并记录相关临床资料及实验室指标,临床资料包括年龄、性别、病程、病因及相关并发症等。实验室指标包括白细胞计数、血小板计数、血氨、血钠、凝血酶原活动度、总胆红素、血清白蛋白。
1.3指标测定及设备血常规采用Sysmex全自动血液分析流水线、生化检验采用Abbote全自动生化流水线,凝血功能采用Sysmex全自动血凝分析仪,试剂均为其配套试剂。正常参考值范围:总胆红素:5~22(μmol/L),血钠:135~145 mmol/L,凝血酶原活动度(PTA):70~120%,白细胞计数:3.5~9.6(109/L),血小板计数:101~320(109/L),血氨(NH3+):18~72 μmol/L。
1.4统计学方法采用SPSS 19.0统计学软件分析数据。正态分布计量资料以均数±标准差表示,两组比较采用t检验,多组比较使用单因素方差分析,非正态分布计量资料采用中位数和四分位数范围表示,组间比较采用非参数统计;计数资料比较采用卡方检验;危险因素分析采用Logistic回归分析。P< 0.05为差异有统计学意义。
2 结果
2.1两组实验室指标比较两组血钠水平、总胆红素水平、血氨水平、凝血酶原活动度及白细胞计数比较,差异均有统计学意义(P< 0.01);血清白蛋白和血小板计数比较,差异无统计学意义(P> 0.05)。见表1。

表1 两组相关实验室指标比较
2.2两组常见并发症比较AKI组自发性腹膜炎、肝性脑病及其他部位感染情况均高于AKI组(P< 0.05),见表2。
2.3肝硬化腹水患者继发AKI的危险因素分析Logistic分析发现,自发性腹膜炎、总胆红素、白细胞计数、PTA、低血钠、高血氨是继发性AKI的独立危险因素(P< 0.05),见表3。

表2 两组常见并发症比较 [n(%)]
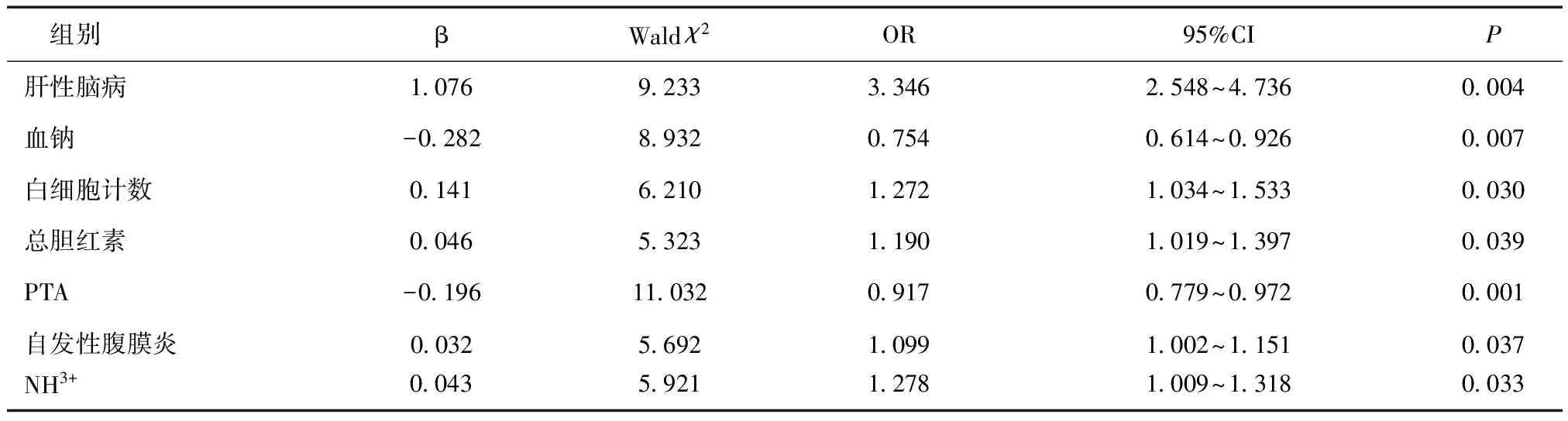
表3 肝硬化腹水患者发生AKI的危险因素分析
2.4预后AKI组死亡11例(19.6%),非AKI组死亡2例(4%),两组预后比较差异有统计学意义(χ2=4.92,P< 0.05)。
3 讨论
肝硬化是常见的并且病程呈进行性发展的慢性疾病,随着病情发展,肝脏在失代偿后机体就可能出现相关并发症,累积多个器官[2]。在我国,大多数肝硬化患者的发病原因是因为感染乙肝病毒,另外还有丙肝肝硬化、血吸虫肝硬化、原发性胆汁性肝硬化、酒精性肝硬化等。AKI是这类患者较为严重且常见的并发症之一,以肾小球滤过率进行性下降、血肌酐、尿素氮迅速升高,伴水钠潴留,酸碱平衡紊乱为特点,患者病死率高,预后极差[3]。相关文献显示,大约有35%~40%的终末期肝硬化腹水患者出现了肝肾综合征[5,6]。目前,肝肾综合征发病的病理生理机制是内脏血管床扩张,引起有效循环血容量减少、动脉血压下降,致使血管活性系统激活,最终导致肾血管收缩,引起肝肾综合征[7~9]。
本研究发现肝硬化腹水患者继发AKI与肝性脑病、感染、血钠水平、总胆红素水平、血氨升高及血浆凝血酶原活动度相关,多因素分析显示肝性脑病、自发性腹膜炎、白细胞计数、血钠水平、总胆红素水平、血氨水平、PTA是其发生的独立危险因素。
终末期肝病可以造成肝性脑病,其主要的临床表现是意识障碍、行为失常或昏迷。目前临床中比较认可的肝性脑病学说仍然是氨中毒学说[10]。随着肝脏的解毒能力逐渐减弱或降低,使肠道内的毒素以及药物等代谢产物在体内积累,致使体内的血氨明显升高,肾脏有吸收氨的功能,故可能引起肾脏功能的损伤,另外,随着患者门静脉压力的不断升高,肾脏分泌的内皮素-1不断增加,造成肾脏有效血流的明显减少,引起肾脏损害。有相关文献报道[11,12],肝性脑病可以造成中枢神经系统受损,肾脏的代谢能力和调节能力又依赖于中枢神经系统的调控,所以在肝性脑病出现继发肾功能不全。综上所述,肝性脑病与肾损伤互为因果,相互影响。肝硬化患者常常出现低钠血症,这与机体神经内分泌失调有关[13]。另外,肝硬化患者对于游离水的清除率常常远低于健康人,所以表现为稀释性低血钠症[14,15]。有研究证明[15],肝肾综合征的灵敏预测因子是低血钠水平,本研究结论与此相符。另外肝硬化还能引发高胆红素血症,血液在流经肾脏的时候会将大量的胆红素结晶沉积在肾小管的上皮细胞中,使肾小管的重吸收作用受到阻碍,同时在扩张的肾小管可发现胆汁栓子,多种因素造成肾功能异常[16]。此外,有相关研究结果对肝肾综合征的危险因素进行分析,结果显示凝血酶原的活动程度可以作为最主要的危险因素[17],本研究也发现PTA降低是发生AKI的危险因素。临床上,肝硬化腹水患者容易合并感染,特别是自发性腹膜炎(SBP),感染引起炎症介质及内毒素大量释放,引起肾血管收缩,出现急性肾损伤[18,19],本研究结果也提示白细胞升高是肝硬化腹水患者诱发AKI的危险因素。上消化道出血容易引起有效血容量的大量减少,从而诱发肾损伤,但本次研究因为未将患者的出血量进行分级统计,所以造成消化道出血未被列入其危险因素中。
从当前来看,现在还没有针对肝硬化腹水合并急性肾损伤的有效治疗方法[20],故需注重预防。在临床工作中,积极防治肝性脑病,酸化肠道,合理运用肠道微生态制剂,控制感染,避免大量放腹水;适时选择人工肝治疗,适当输注新鲜血浆;同时避免使用肾毒性药物。了解并重视诱因,才能尽可能降低急性肾损伤发生的风险,降低病死率。
[1] Wong F.Acute kidney injury in liver cirrhosis:new definition and application[J].Clin Mol Hepatol,2016,22(4):415-422.
[2] Belcher JM,Garcia-Tsao G,Sanyal AJ,et al.Association of AKI with mortality and complications in hospitalized patients with cirrhosis[J].Hepatology,2013,57(2):753-762.
[3] Wong F,O'Leary JG,Reddy KR,et al.New consensus definition of acute kidney injury accurately predicts 30-day mortality in patients with cirrhosis and infection[J].Gastroenterology,2013,145(6):1280 -1288.
[4] Kidney Disease.Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group.KDIGO Clinical Practice Guideline for Acute Kidney Injury[J].Kidney Int Suppl,2012,2(Suppl.1):1-138.
[5] Arroyo V,Fernández J.Management of hepatorenal syndrome in patients with cirrhosis[J].Nat Rev Nephrol,2011,7:517-526.
[6] Al-Khafaji A,Nadim MK,Kellum JA.Hepatorenal disorders[J].Chest,2015,148(2):550-558.
[7] Bolognesi M,Di Pascoli M,Verardo A,et al.Splanchnic vasodilation and hyperdynamic circulatory syndrome in cirrhosis[J].World J Gastroenterol,2014,20:2555-2563.
[8] SchrierRW,ArroyoV,BernardiM,et al.Peripheral arterial vasodilation hypothesis:a proposal for the initiation of renal sodium and water retention in cirrhosis[J].Hepatology,1988,8(5):1151-1157.
[9] Wadei HM,Mai ML,Ahsan N.et al.Hepatorenal syndrome:patho- Physiologyand management[J].Clin J Am Soc Nephrol,2006,1(5):1066-1079.
[10]Jalan R,Bernuau J.Induction of cerebral hyperemia by ammonia plus endotoxin:Does Hyperamm on emia unlock the blood-brain barrier[J].Journal of Hepatology,2007,47(2):168.
[11]聂鑫,贺勇,李贵星,等.肝肾综合征与肝性脑病的关系研究[J].中国实验诊断学,2012,16(3):475-478.
[12]Bernardi M,Moreau R,Angeli P,et al.Mechanisms of decompensation and organ failure in cirrhosis:From peripheral arterial vasodilation to systemic inflammation hypothesis[J].J Hepatol,2015,63(5):1272-1284.
[13]WadeiHM.Hepatorenal syndrome:a critical update[J].Semin Respir Crit Care Med,2012,33(1):55-69.
[14]Schrier RW,Shchekochikhin D.Renal failure in cirrhosis:prerenal azotemia,hepatorenal syndrome and acute tubular necrosis[J].Nephrol Dial Transplant,2012,27(7):2625-2628.
[15]王利娜,陈飞,姜慧卿.肝肾综合征的发病机制与肾血管调节[J].胃肠病学和肝病学杂志,2009,18(4):295-298.
[16]Rafat C,Burbaeh M,Brochrriou I,et al.Bilirubin-associated acute tubular necrosis in a kidney transplantrecipient[J].Am J KidneyDis,2013,61(5):782-785.
[17]Park JM.Cystatin C is a good predictor of hepatorenal syndrome and survivalin patients with cirrhosis who have normal serum creatinine levels[J].Hepato gastroenterology,2012,59(116):1168-1173.
[18]Kakazu E,Kondo Y,Shimosegawa T.The relationship between renal dysfunction and abnormalities of the immune system in patients with decompensated cirhosis[J].Gastroenterology,2012,50(12):123-126.
[19]吕日英.重型肝炎患者并发肝肾综合征的危险因素[J].临床肝胆病杂志,2012,28(7):542-544.
[20]Paolo A,Pere G,Florence W,et al.Diagnosis and management of acute kidney injury in patients with cirrhosis:revised consensus recommendations of the International Club of Ascites[J].Journal of Hepatology,2015,62(4):968-974.
