肝细胞癌组织中DCLK1蛋白的表达及其临床意义
2018-03-10梁东黄起桢张翔罗柳平黎蕴通曾永毅
梁东 黄起桢 张翔 罗柳平 黎蕴通 曾永毅
肝细胞癌(肝癌)是消化道常见的恶性肿瘤之一,为中国肿瘤死因的第2位[1],且术后复发率高、预后差,5年的生存率仅为18%[2]。寻找有效的肿瘤标志物对肝癌的诊断和治疗均具有重大意义。双肾上腺素样激酶1 (Doublecortin-like kinase 1, DCLK1)是一种发现于有丝分裂后的神经元中的跨膜微管相关蛋白激酶[3]。近年研究发现DCLK1可能是消化系统肿瘤相关的重要标志蛋白[4],其高表达于胰腺癌、结肠癌、食管癌、前列腺癌、乳腺癌等多种肿瘤细胞中[5-8],但DCLK1在肝癌中的表达情况及其功能研究尚未见报道。另外,有研究显示卵圆细胞蛋白OV6可作为肝癌祖细胞的标志物,可能与肝癌的形成、转移密切相关。为了解肝癌中DCLK1表达情况以及其可能的生物学功能,本研究回顾性分析2012年6月至2015年6月福建医科大学孟超肝胆医院收治的52例肝癌病人的临床病理资料。检测DCLK1蛋白和OV6在肝癌组织和癌旁组织中的表达情况,探讨两者的相关性、以及其与肝癌临床病理因素和病人预后的关系。
资料与方法
一、病例资料和材料
1.病例资料和组织样本来源 经福建医科大学孟超肝胆医院伦理委员会批准,采用回顾性横断面研究方法,收集2012年6月至2015年6月在福建医科大学孟超肝胆医院行根治性肝癌手术病人的临床资料52例,其中男性40例,女性12例,年龄28~78岁,平均年龄51岁。从我院生物标本库及病历信息中心收集病人临床资料,包括病人性别、年龄、肝硬化水平、甲胎蛋白(AFP)水平、肿瘤大小、肿瘤包膜等信息。纳入标准:①术前肝功能为Child-Pugh A级;②无远处转移;③术前均未进行化疗、放疗、介入治疗和免疫治疗等抗肿瘤治疗;④均行根治性肝癌切除手术;⑤病理学检查证实为肝细胞癌。排除标准:①术前肝功能为Child-Pugh B级及以下;②有远处转移;③术前接受过化疗、放疗、介入治疗和免疫治疗等抗肿瘤;④治疗非肝细胞癌,如胆管细胞癌、混合型肝癌或其他恶性肿瘤肝转移;⑤合并其他恶性肿瘤。
2.试剂及设备 兔抗人DCLK1单克隆抗体(1∶200)购自台湾Abnova公司,鼠抗人OV6单克隆抗体(1∶200)购自香港Abcam公司,二氨基联苯胺(DAB)酶显色试剂盒购自武汉博士德公司,PBS缓冲液(pH 7.4)、二甲苯、EDTA、多浓度梯度乙醇、过氧化氢等试剂均为福建医科大学孟超肝胆医院病理科提供。组织芯片机,全自动脱水机、石蜡切片机,普通光学显微镜、Olympus荧光显微镜( Leica公司)。
二、方法
1.制作组织芯片 挑选组织保留良好的供者蜡块,制作空白蜡块;将供者蜡块和空白蜡块预热至30 ℃~40 ℃备用。用穿刺针打孔,将穿好的组织推入孔内。每个空白蜡块可穿刺47个点。将含有组织的一面向下放置于载玻片上,放到65 ℃~70 ℃的烤箱里,待蜡块与载玻片之间出现液体石蜡时,迅速移去载玻片,轻轻挤压蜡块四周,自然冷却。
2.免疫组织化学 组织芯片蜡块5 μm连续切片,60 ℃烤箱中烤片1 h,二甲苯脱蜡,梯度乙醇脱水,蒸馏水浸洗,3 min /次,共3次。3%过氧化氢室温孵育10 min,EDTA煮沸法进行抗原修复;过氧化氢阻断内源性氧化物酶活性;一抗OV6抗体(1∶200)、DCLK1抗体(1∶200)4 ℃孵育过夜,二抗37 ℃孵育30 min,DAB显色;苏木精复染细胞核;水性封固剂封固。PBS代替一抗做阴性对照。
3.结果判定标准 观察5个高倍镜视野,阳性标准为细胞核内出现棕黄色或淡黄色颗粒。判定标准采用半定量积分法。以细胞核的染色深浅程度作为评定标准:无染色记为0,浅染色记为1,中等染色记为2,深染色记为3。以染色的肿瘤细胞核所占百分比作为评定标准:0~10%的肿瘤细胞核着色记为0,11%~25%的肿瘤细胞核着色记为1,26%~50%的肿瘤细胞核着色记为2,51%~75%的肿瘤细胞核着色记为3,76%~100%的肿瘤细胞核着色记为4。最终的免疫组化判定标准根据上述两个评定标准(染色强度和着色细胞比例) 的乘积而定:0分为无表达,≤4分为低表达,>4分为高表达。
4.随访 随访自治疗结束后开始,采用电话和门诊方式进行随访,首次治疗后3个月内随访1次,此后每6个月随访1次。随访期间定期复查彩色多普勒超声、肿瘤指标、血液生化检查、磁共振检测等。随访时间截止至2016年7月,或至病人死亡、失访。
三、统计学处理
采用SPSS (20.0版)统计学软件进行分析,根据DCLK1表达量的高低将病人分为两组,采用χ2检验及Fisher精确概率法分析DCLK1表达与临床病理特点之间的关系,两种蛋白的表达差异采用Spearman等级相关分析,同时采用Kamplan-Meier法绘制生存曲线,组间无瘤生存率差异用Log-rank检验,P<0.05认为差异有统计学意义。
结 果
一、OV6和DCLK1在肝癌与癌旁组织中表达情况
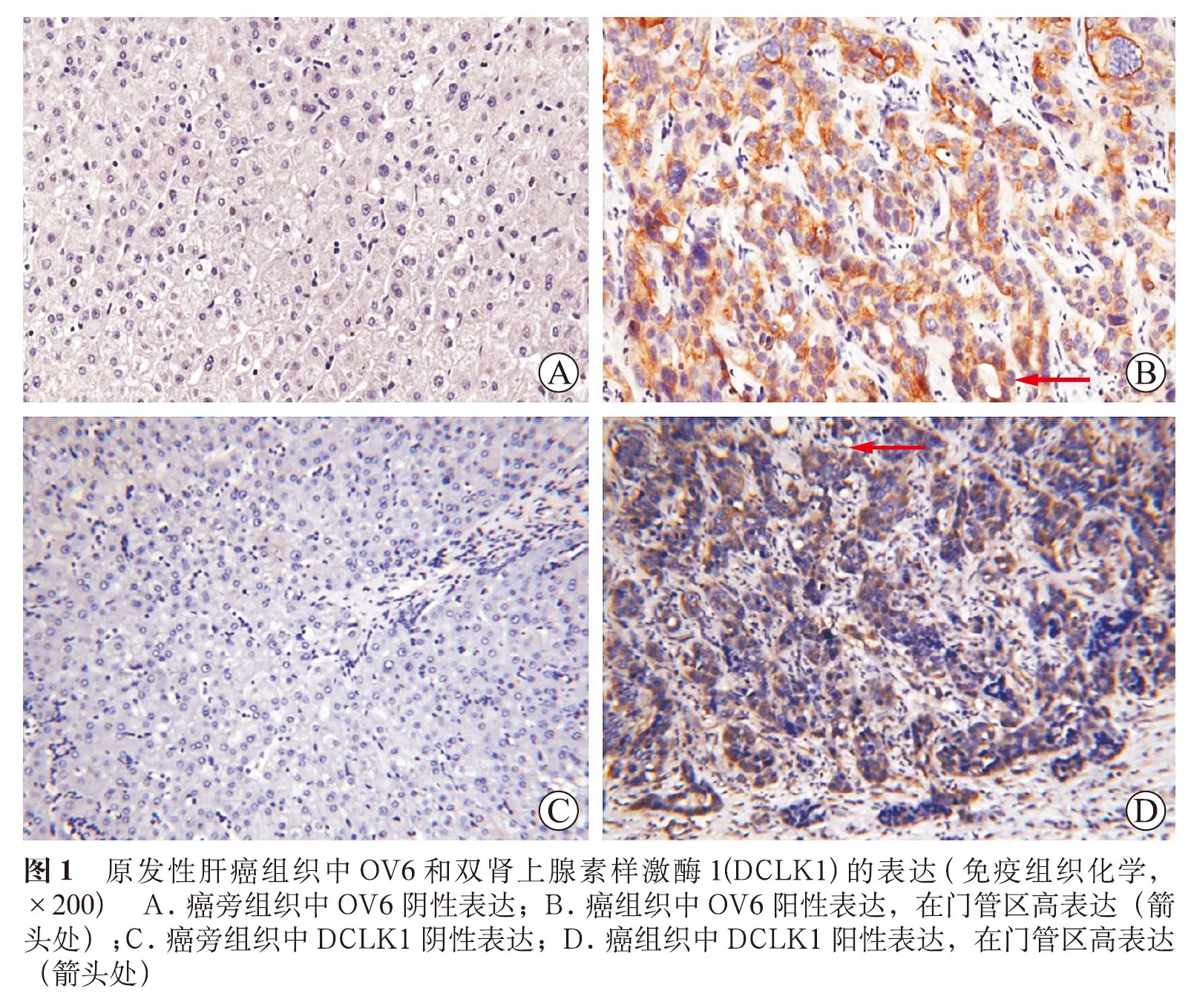
OV6蛋白和DCLK1蛋白均主要在细胞质中表达,阳性的细胞胞质呈棕黄色。在癌旁组织中OV6表达量低或不表达(图1A),在肝癌组织中OV6呈广泛高表达于门管区(图1B);在癌旁组织中DCLK1表达量低或者不表达(图1C);在肝癌组织中,DCLK1表达量明显增高,主要分布于肿瘤组织的胞质、生长活跃的区域及门管区,但不同样本之间的表达强度、数量不一(图1D)。分别统计DCLK1、OV6在肝癌与癌旁组织中的表达情况,结果显示DCLK1、OV6在肝癌与癌旁组织中的表达差异均有统计学意义(表1、表2)。
表1DCLK1在癌旁组织与肝癌组织中的表达对比[例(%)]

组别DCLK1高表达低或无表达χ2值P值癌组织18(34.6)34(65.4)5.1280.0234癌旁组织8(15.4)44(84.6)

表2 与OV6在癌旁组织与肝癌组织中的表达[例(%)]
二、DCLK1蛋白的表达与临床病理特点的关系
分析显示肝癌组织中DCLK1的表达与AFP、微血管侵犯有关(P均<0.05),提示DCLK1可能与肝癌的增殖及干性能力相关;而DCLK1的表达水平与病人的性别、年龄、乙肝病毒载量、肿瘤直径、肿瘤数量、肿瘤包膜、肝硬化状况无明显相关性(P均>0.05),Spearman等级相关分析提示DCLK1与OV6在肝癌组织中的表达呈正相关(r=0.505,P<0.001),详见表3及表4。
三、DCLK1表达水平与病人的生存预后分析
所有病人均采用电话和门诊相结合的方法随访3年(有数例为2014年6月至2015年6月病例,随访生存期小于2年,但观察到终点)。自手术之日起至死亡或随访结束,最长生存期36.85个月,最短生存期2.33个月,中位生存期为14.16个月。DCLK1高表达组无瘤中位生存时间12.71个月,3年无瘤生存率为16.7%;DCLK1低表达组平均无瘤中位生存时间为25.67个月,3年无瘤生存率为46.2%。采用K-M生存分析显示两组病人术后3年无瘤生存率差异具有统计学意义(P=0.022),详见图2。
讨 论
尽管肝癌在手术方式、介入治疗、化疗及放疗取得了一定的进步,但由于多数在发病早期没有明显症状,大部分病人在确诊时已处于中晚期阶段,且肝癌复发率高,5年生存率仍仅为18%,因此,早期诊断和治疗对于改善肝癌病人的预后意义重大,但目前肝癌仍缺少有效的协助早期诊断及判断预后的分子标志物。DCLK1是一种跨膜微管相关蛋白样激酶,主要参与骨架的形成、调节细胞运动、细胞分化以及细胞周期[9]。DCLK1蛋白在体内多种恶性肿瘤中均有表达[10-12]。因此DCLK1蛋白被认为在部分肿瘤中可作为肿瘤标志物。王欢等[13]报道DCLK1在结直肠癌组织中的表达率为36.7%,可作为结直肠癌肿瘤干细胞的标志物。位于肝索与胆管终末连接处的卵圆细胞是肝脏的重要组成细胞,是肝祖细胞的活化形式,具有多向分化潜能,OV6作为其分子标志物之一,被认为与肝癌细胞的形成与转移密切相关。Yang等[14]的研究发现OV6在肝癌组织中的高表达率为38.0%,可作为肝癌的干性指标。
表3DCLK1的表达与原发性肝癌病人临床病理学特点的关系(例)
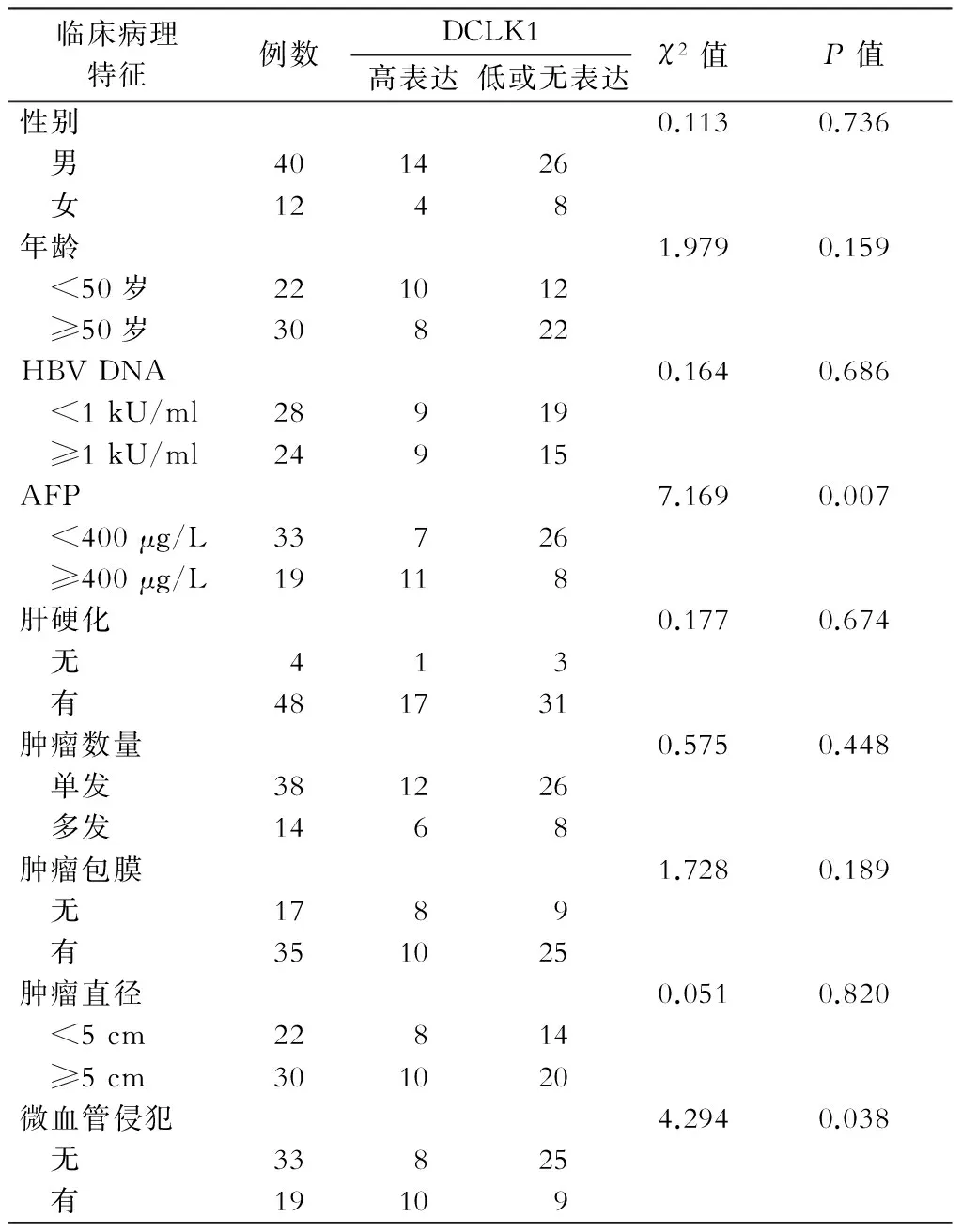
临床病理特征例数DCLK1高表达低或无表达χ2值P值性别0.1130.736 男401426 女1248年龄1.9790.159 <50岁221012 ≥50岁30822HBVDNA0.1640.686 <1kU/ml28919 ≥1kU/ml24915AFP7.1690.007 <400μg/L33726 ≥400μg/L19118肝硬化0.1770.674 无413 有481731肿瘤数量0.5750.448 单发381226 多发1468肿瘤包膜1.7280.189 无1789 有351025肿瘤直径0.0510.820 <5cm22814 ≥5cm301020微血管侵犯4.2940.038 无33825 有19109
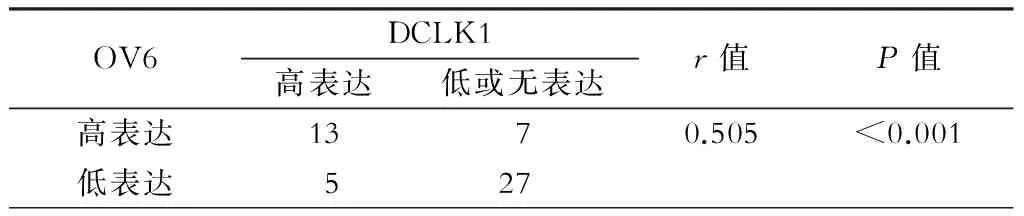
表4 DCLK1和OV6在肝癌组织中表达强度的相关性(例)
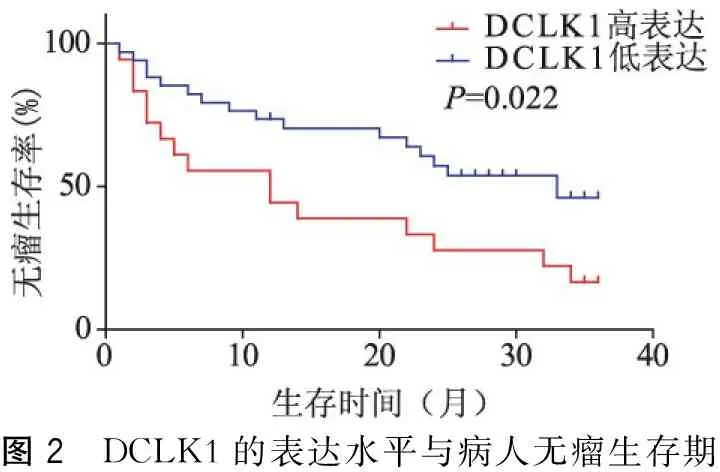
图2 DCLK1的表达水平与病人无瘤生存期
本研究结果显示:在肝癌组织中DCLK1的高表达率为34.6%(18/52),OV6的高表达率为38.5%(20/52),Spearman分析提示二者表达量呈正相关,与上述研究结果相近;且肝癌组织和癌旁组织中的表达差异有统计学意义,DCLK1在癌组织中明显高表达,在肝癌组织中DCLK1的表达情况与AFP、微血管侵犯密切相关,而DCLK1的表达情况与乙肝病毒载量、肿瘤直径、肿瘤数量、肿瘤包膜、肝硬化状态等指标无关。免疫组化结果显示肝癌组织中DCLK1同OV6蛋白共同高表达于门管区,而门管区肝细胞的功能异常是肝癌干细胞产生的来源之一[15],因此我们认为DCLK1可能通过影响门管区肝癌干细胞的增殖及其干性,在肝癌中的发生及发展过程发挥其生物学作用。因此,DCLK1与OV6可能存在相似的生物学功能,可作为一个潜在的肝癌标志物,但其确切功能及作用机制有待进一步研究。
甘婧婧等[16]的研究结果表明:在乳腺癌中DCLK1高表达病人150个月的总生存率为37%,而DCLK1低表达病人总生存率为62.4%。孟庆彬等[17]研究结果表明:在胃癌中DCLK1高表达者的5年总生存率和5年无瘤生存率分别为39.0%和37.0%,明显低于DCLK1低表达者的65.8%和64.5%。以上研究报道均提示:DCLK1高表达的病人预后较差。本研究结果显示:在肝癌中DCLK1高表达组无瘤中位生存时间12.71个月,3年无瘤生存率为16.7%;DCLK1低表达组平均无瘤中位生存时间为25.67个月,3年无瘤生存率为46.2%。DCLK1高表达组与低表达组无瘤生存期差异有统计学意义,提示DCLK1高表达的肝癌病人预后较差,同上述研究结果一致,因此,DCLK1可能成为一个判断肝癌病人预后的指标。
综上所述,肝癌组织中DCLK1蛋白表达较癌旁组织明显升高;DCLK1蛋白表达情况与AFP水平、微血管侵犯有关,可能成为潜在的肝癌诊断及评估预后的分子标志物。但其中的分子机制有待进一步探讨,也是我们接下来的研究方向。
1 Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015.CA Cancer J Clin,2016,66: 15-132. DOI:10.3322/caac.21338.
2 Siegel RL,Miller KD,Jemal A.Cancer statistics,2016.CA Cancer J Clin, 2016, 66:7-30.DOI:10.3322/caac.21332.
3 Li L,Bellows CF.Doublecortin-like kinase 1 exhibits cancer stem cell-like characteristics in a human colon cancer cell line. Chinese J Cancer Res,2013,25:134.DOI:10.3978/j.issn.1000-9604.2013.03.02.
4 Nakanishi Y,Seno H,Fukuoka A,et al.Dclk1 distinguishes between tumor and normal stem cells in the intestine. Nat Genet,2013,45:98-103.DOI:10.1038/ng.2481.
5 Smith MT,Guyton KZ,Gibbons CF,et al.Key characteristics of carcinogens as a basis for organizing data on mechanisms of carcinogenesis.Environ Health Persp,2016,124:713.
6 Merlos-Suárez A,Barriga FM,Jung P,et al.The intestinal stem cell signature identifies colorectal cancer stem cells and predicts disease relapse. Cell stem cell,2011,8:511-524.DOI:10.1289/ehp.1509912.
7 Du L,Rao G,Wang H,et al.CD44-positive cancer stem cells expressing cellular prion protein contribute to metastatic capacity in colorectal cancer. Cancer Res,2013,73:2682-2694.DOI:10.1158/0008-5472.CAN-12-3759.
8 Barker N,Van Es JH,Kuipers J,et al.Identification of stem cells in small intestine and colon by marker gene Lgr5.Nature,2007,449:1003-1007.DOI:10.1038/nature06196.
9 Ji J,Wang H,Li Y,et al.Diagnostic Evaluation of des-gamma-carboxy prothrombin versus α-fetoprotein for hepatitis b virus-related hepatocellular carcinoma in China:a large-scale,multicentre study.PloS one,2016,11: 0153227.DOI:10.1371/journal.pone.0153227.
10Chandrakesan P,Yao J,Qu D,et al.Dclk1,a tumor stem cell marker,regulates pro-survival signaling and self-renewal of intestinal tumor cells. Mol Cancer, 2017,16:30.DOI:10.1186/s12943-017-0594-y.
11Pan Y,Zhang J,Fu H,et al.miR-144 functions as a tumor suppressor in breast cancer through inhibiting ZEB1/2-mediated epithelial mesenchymal transition process.OncoTargets and therapy,2016,9:6247.DOI:10.2147/OTT.S103650.
12Ali N,Allam H,May R,et al.Hepatitis C virus-induced cancer stem cell-like signatures in cell culture and murine tumor xenografts. J Virol, 2011, 85:12292-12303. DOI:10.1128/JVI.05920-11.
13王欢,马法库,刘斌,等.结直肠癌组织中DCLK1+/Ki67-肿瘤干细胞样细胞的形态和分布.中国组织工程研究,2015, 19:1575-1579.DOI:10.3969/j.issn.2095-4344.2015.10.018.
14Yang W,Wang C,Lin Y,et al. OV6+ tumor-initiating cells contribute to tumor progression and invasion in human hepatocellular carcinoma.J Hepatol,2012,57:613-620.DOI:10.1016/j.jhep.2012.04.024.
15张鹏,朱晓峰,焦兴元.卵圆细胞的生物学特性及其与原发性肝癌的关系.中国普外基础与临床杂志,2015,22:494-498.DOI:10.7507/1007-9424.20150130.
16甘婧婧. DCLK1在乳腺导管癌中的表达及预后关系.湖南衡阳:南华大学, 2016.
17孟庆彬,于健春,康维明,等.Doublecortin样激酶-1在胃癌组织中的表达及其与预后关系.中国医学科学院学报,2013,35:639-644.DOI:10.3881 /j.issn.1000-503X.2013.06.010.
