幼兔CO2人工气腹模型的建立*
2018-03-09李贵斌王春燕
刘 扬 李贵斌 王春燕 邱 云
(天津市第五中心医院小儿外科,天津 300450)
1 材料与方法
1.1 实验动物及分组
32只健康新西兰大白兔幼兔(3周龄,体重0.8~1 kg)购自青岛今墨堂百福泰生物技术有限公司[生产许可证号:SCXK(鲁)2015 0021]。动物饲养于伯言合众(天津)生物医药科技有限公司动物室,室温25 ℃,湿度10%~20%,每天保持12 h昼夜循环。幼兔自由摄取水和饲料。所有操作符合实验伦理委员会的要求,并按实验动物使用的3R原则给予人道关怀。
幼兔按随机数字表法分为4组,每组8只:对照组,单纯腹腔麻醉;开腹组,麻醉后行开腹手术暴露腹腔;低压气腹组,腹腔气腹压力维持于6 mm Hg(1 mm Hg=0.133 kPa);高压气腹组,腹腔气腹压力维持于12 mm Hg。
1.2 主要实验试剂和仪器
4%水合氯醛,10%水合氯醛,2%碘伏,75%乙醇,生理盐水,手术刀,手术剪,纱布,精密电子压力计(江苏金湖华泰计量有限公司,型号HT-Y-100)。
1.3 实验方法
1.3.1 麻醉方法 每只幼兔称重,腹腔缓慢推注10%水合氯醛(3 ml/kg)麻醉,监测幼兔心率及呼吸频率,无菌棉签轻触眼结膜,以结膜反射消失认定为麻醉满意。实验过程中监测结膜反射,结膜反射恢复认定为麻醉过浅,需追加4%水合氯醛1 ml/kg,麻醉时间持续4 h。
1.3.2 实验动物模型的建立
对照组:仅行腹腔注射麻醉,不行任何手术操作。
开腹组:麻醉成功后,将幼兔仰卧于手术台上,弯剪刀剪去腹部皮毛,2%碘伏及75%乙醇消毒,剑突下沿腹正中线切开皮肤3 cm,切开腹膜,暴露腹腔,湿纱布覆盖,持续4 h后逐层缝合,关闭腹腔(图1)。
低压和高压气腹组:麻醉成功后,将幼兔仰卧于手术台上,弯剪刀剪去腹部皮毛,2%碘伏及75%乙醇消毒,取腹部正中手术切口长约5 mm,切开皮肤及腹膜,将直径2 mm三通软管插入腹腔内,用丝线固定于腹壁(图2),一个接口为精密电子压力计连接CO2进气管道,另一个接口为注射通路于术中追加水合氯醛麻醉。手动调节CO2进气压力,间断输入CO2,低压和高压气腹组压力计指数分别维持在6 mm Hg和12 mm Hg(受呼吸影响,允许压力指数波动范围为±0.2 mm Hg)。建立CO2人工气腹。持续4 h后逐层缝合腹部切口。
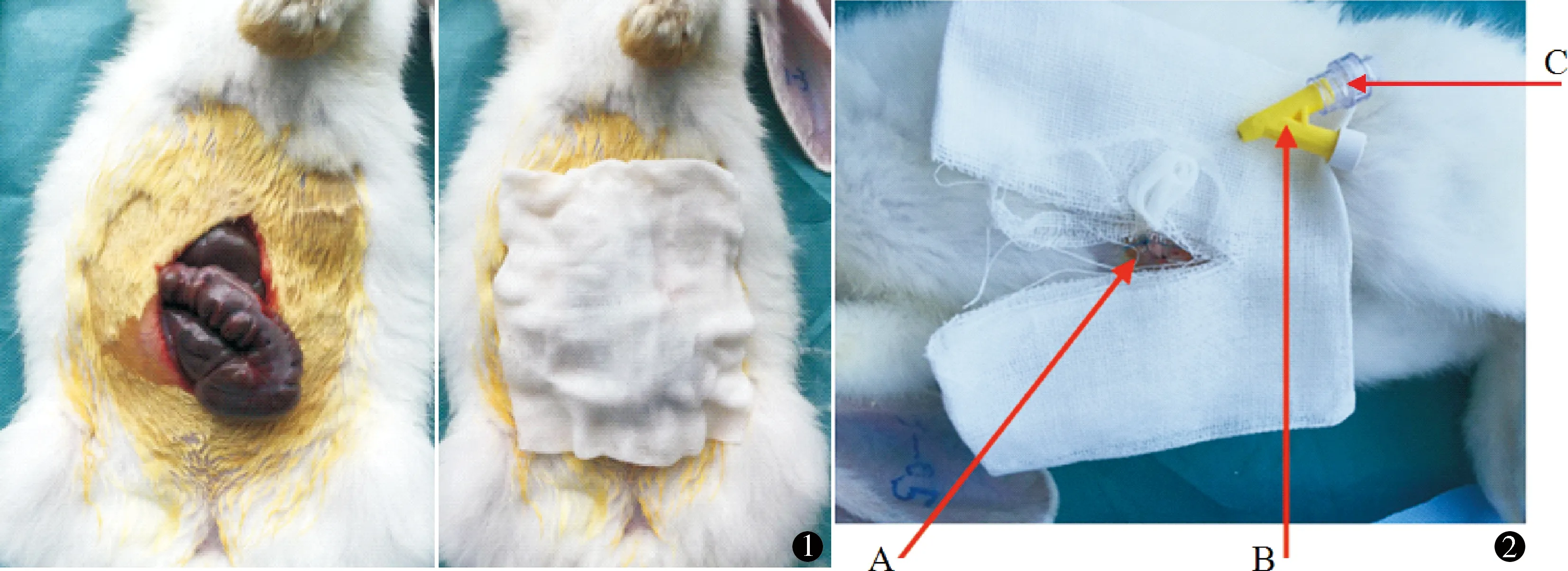
图1 开腹组操作 图2 CO2气腹操作:A为腹腔穿刺部位,B为CO2进气通路,C为注射通路
麻醉4 h后将每组幼兔随机取一半(4只)处死,留取所需标本(另一研究内容),余4只关腹后送回笼中继续饲养7 d。
1.4 观察指标
1.4.1 生命体征 围术期监测心率、呼吸频率,记录麻醉开始前30 min和麻醉后30 min、1 h、2 h、3 h、4 h及术后1 h心率、呼吸频率。
1.4.2 进食量 记录术前每日进食量,连续监测3 d,取平均值作为每日进食量参照标准,以恢复80%平均进食量认定为正常。
1.4.3 切口情况 每日观察手术切口,注意切口有无感染、出血等并发症,术后7 d切口拆线,观察切口愈合情况。
1.4.4 术后死亡率 各组4只术后送回笼中继续饲养7 d,记录术后死亡率。
1.5 统计学方法
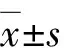
2 结果
2个气腹组采用精密电子压力计调节气腹压力的方法可以维持理想的气腹压力。4组幼兔围术期心率、呼吸频率比较均无统计学差异(P>0.05)(表1)。各组4只术后继续饲养幼兔术后2 h均开始少量进食饮水,术后24 h内进食量均恢复正常,术后7 d手术切口拆线,切口均一期愈合,未出现感染、出血等并发症,至术后第7天均无死亡。
表1 各组幼兔不同时间点心率、呼吸频率的变化 次/min
T0:麻醉开始前30 min;T1:麻醉后30 min;T2:麻醉后1 h;T3:麻醉后2 h;T4:麻醉后3 h;T5:麻醉后4 h;T6:术后1 h
3 讨论
CO2因其具有弥散性好、溶解度高、不易燃烧爆炸等优点,目前已成为建立腹腔镜气腹最常用的气体[1]。然而,CO2气腹对机体的不利影响也逐渐受到广泛关注,气腹压力过大不仅会造成高碳酸血症,也会影响机体的血流动力学及应激反应能力,且压力越高,影响越明显[3];气腹压力过低会导致手术视野狭窄,操作空间受限,手术难度增加。面对这种矛盾,大多数临床医生根据经验而定,更倾向于选择略高的气腹压力以保证手术操作空间。然而,新生儿许多器官发育尚未完全成熟,解剖生理特性与成人、儿童均存在较大差异。Li等[4]的研究显示8~14 mm Hg的CO2气腹压力对婴儿的呼吸和循环系统有影响,建议对气腹压力进行控制。目前,关于腹腔镜手术对婴幼儿身体机能影响的研究尚不深入,而且没有成熟的用于模拟新生儿人工气腹的动物模型。所以,探索一种适合的动物模型,对研究新生儿腹腔镜手术必不可少。
外科手术最常见的实验动物为猪和犬,主要用于模拟体型较大的儿童及青少年,但花费较多且不易管理。新西兰大白兔体型较小,腹腔操作空间与婴幼儿相近,用药量小,花费较少,麻醉易成功,且兔的性情温顺,易于获得及管理,也常用于动物实验研究中[5]。1.5~3月龄的幼兔相当于人类的幼年期至青春前期[6],因此,本研究选择3周龄幼兔作为模型动物,较接近于新生儿的生理状态,是研究新生儿腹腔镜手术比较理想的实验动物[7]。
为了排除麻醉药物对实验结果的影响,本研究对照组幼兔仅行腹腔注射麻醉,不行任何手术操作,开腹组在同样的麻醉条件下行开腹手术暴露腹腔,而低压气腹组与高压气腹组采用精密电子压力计调节气腹压力,模拟临床气腹操作。根据压力计显示的压力调节进气压力,间断输入CO2,维持拟定压力值,气腹压力波动范围为±0.2 mm Hg。研究结果显示,2个气腹组幼兔围手术期心率、呼吸频率与对照组及开腹组比较无统计学差异(P>0.05)。4组幼兔术后无并发症发生,无死亡,术后7 d手术切口拆线,切口均一期愈合。以上结果提示利用精密电子压力计建立CO2气腹模型有效、可行,不仅可直观调节气腹压力,而且操作简单,可重复性好,是一种可行的新生儿腹腔镜技术研究方法。
在本实验研究的基础上,我们将继续观察不同气腹压力对幼兔心肺功能、肝肾功能及免疫应激等指标的影响,进一步研究安全的气腹压力范围,为新生儿腹腔镜手术气腹压力的选择提供更加可靠的理论依据[8]。
1 赵淑萍,于海蓉,韩艳杰.腹腔镜手术人工气腹对机体的影响及护理干预.中华医院感染学杂志,2011,21(11):2378-2380.
2 李索林,徐伟立,韩新峰.腹腔镜技术在新生儿和小婴儿外科中的应用.中国微创外科杂志,2004,4(5):370-372.
3 谢 涛,肖金苗.腹腔镜手术不同气腹压力对IL-1β,IL-6和TNF-α的影响.中国微创外科杂志,2014,14(11):1028-1032.
4 Li LW,Zhang W,Ai YQ,et al.Influence of laparoscopic carbon dioxide pneumoperitoneum on neonate circulation and respiration.Int Med Res,2013,41(3):889-894.
5 Kozlov Y,Novogilov V,Rasputin A,et al.Laparoscopic inguinal preperitoneal injection-novel technique for inguinal hernia repair:preliminary results of experimental study. Laparoendosc Adv Surg Tech A,2012,22:276-279.
6 余高妍,颜崇淮,余晓刚,等.儿童慢性中度铅中毒幼兔动物模型的建立.实用儿科临床杂志,2007,22(19):1484-1513.
7 文建国,苏志强,王庆伟,等.幼兔逼尿肌无收缩模型的建立及影像尿动力学评估.中华小儿外科杂志,2013,34(5):373-376.
8 王春燕,李贵斌,刘 扬,等.二氧化碳气腹对幼兔肝肾功能影响的实验研究.中华小儿外科杂志,2017,38(9):713-717.
