腹腔镜胰体尾切除30例报告
2018-03-09刘汝海张执全李凤山袁俊建孔德帅
柴 伟 刘汝海 张执全 李凤山 雷 豹 袁俊建 孔德帅
(沧州市中心医院普通外科,沧州 061000)
近年来,随着技术及设备的不断改进,腹腔镜手术已经广泛应用于胰腺外科领域。对于胰体尾部的良性肿瘤及部分交界性、低度恶性肿瘤,腹腔镜胰体尾切除术(laparoscopic distal pancreatectomy,LDP)已成为首选术式。2013年1月~2016年6月我科施行腹腔镜胰体尾切除术30例,现报道如下。
1 临床资料与方法
1.1 一般资料
本组30例,女18例,男12例。年龄25~72岁,(43±7)岁。无临床症状、体检发现胰体尾占位9例,左上腹或腰背部胀痛17例,反复发作低血糖伴晕厥病史4例。均行上腹部平扫+增强CT检查,其中6例因CT诊断不明确而加行MRI检查:肿瘤单发28例,多发2例;肿瘤直径0.9~8.5 cm,(3.2±1.4)cm;肿瘤均无浸润性生长表现,无周围淋巴结肿大及脏器转移。24例囊性、囊实性或实性肿瘤,边界清晰,无胰管扩张表现,考虑为胰体尾良性肿瘤;2例胰尾部肿瘤CT呈现混杂密度,边界清晰,动态增强后肿瘤实性部分呈现渐进性强化,肿瘤最大径分别为5.8、6.4 cm,考虑交界性胰腺实性假乳头状瘤;1例胰体部肿瘤CT显示由多个小囊性低密度影组成,并可见等密度条状间隔,MRI显示肿瘤最大径为1.6 cm,与胰管相通,伴胰管扩张约5 mm,考虑交界性胰腺导管内乳头状黏液瘤;3例胰体尾部囊性肿瘤,边界清晰,囊壁较厚且不规则,囊内可见蛋壳样或不规则钙化,考虑为低度恶性胰腺黏液性囊腺瘤。术前检查CA19-9、CEA、AFP等肿瘤标记物,其中1例黏液性囊腺瘤CA19-9 46 U/ml,1例实性假乳头状瘤CA19-9 42 U/ml,其余均在正常范围。
病例选择标准:①术前实验室检查提示肿瘤标记物无明显异常,影像学检查提示肿瘤位于胰体尾部,边界清晰,无浸润性生长表现,无周围淋巴结肿大及脏器转移,初步诊断为胰体尾部良性、交界性或低度恶性肿瘤;②病变邻近胰管、脾血管、肠系膜血管或直径>2 cm不适合行剜除术;③术前检查无腹腔镜手术禁忌证。排除标准:①术前明确诊断为胰腺癌;②术前诊断为其他类型的恶性肿瘤,同时伴有周围脏器侵犯或淋巴结转移;③术中证实病变非胰腺来源;④术中仅行腹腔镜胰腺肿物剜除;⑤急性胰腺炎发作期。
1.2 方法
全身麻醉。平卧分腿位,头高30°、左侧抬高10°~15°。术者站于患者右侧,助手位于左侧,扶镜手位于患者两腿之间。采用五孔法,trocar布局类似腹腔镜胃癌手术,脐下放置10 mm trocar作为观察孔,左、右腋前线肋缘下2~3 cm分别放置5 mm trocar作为辅助孔,右侧腹直肌外缘脐上1~2 cm放置12 mm trocar作为主操作孔,左侧对应位置放置12 mm trocar作为辅助孔。首先,探查腹腔,排除肿瘤转移情况。超声刀打开胃结肠韧带,继续向左侧游离并离断脾结肠韧带,充分显露脾门及胰腺下缘。分离胃后壁与胰腺之间的粘连,向右直至胃及横结肠系膜融合处,部分患者可分离部分融合间隙,充分显露胰颈及胰腺上缘。定位胰腺肿物,如肿物较小、位于胰腺实质内,联合术中超声精确定位肿物及胰腺切缘。术者将胃胰皱襞向上提起,助手应用腔镜纱布下压胰颈部,超声刀于胃胰皱襞偏左侧胰腺上缘切开后腹膜,向两侧游离可轻松显露脾动脉主干。仔细游离脾动脉并将其前后贯通,避免损伤脾动脉发往胰腺分支而造成出血,预制血管吊带。于胰颈下缘切开后腹膜,进入胰后间隙,显露位于胰腺后方的脾静脉主干,将脾静脉与胰腺实质分离,同样预制血管吊带。此后根据是否保留脾脏及保脾方式分为胰体尾及脾切除(distal pancreatectomy with splenectomy, DPS)组、保留脾血管的保脾胰体尾切除组(Kimura法)及不保留脾血管的保脾胰体尾切除组(Warshaw法)。①肿瘤巨大且与脾门关系密切难以分离或肿瘤有壁结节、蛋壳样钙化、高度怀疑恶变者选择DPS:继续由胰腺后方向头侧游离,贯通胰腺,并预制胰腺吊带。于胰颈部结扎脾动、静脉主干,并于血管结扎线左侧应用Endo-GIA切断胰腺及脾血管。继续向胰尾及脾脏分离,切断脾周韧带,将胰体尾及脾脏一并切除。②肿瘤与脾血管粘连致密难以分离、胰腺有明显慢性炎症或行保留脾血管手术过程中因出血被迫结扎脾血管选择不保留脾血管的保脾胰体尾切除(Warshaw法):切开胃结肠韧带时保留胃网膜左血管及胃短血管。同上贯通胰腺后,于胰颈部结扎脾动、静脉主干,并于血管结扎线左侧应用Endo-GIA切断胰腺及脾血管。向左侧游离胰腺及脾血管直至胰尾,再次应用Endo-GIA于胰尾左侧切断脾血管,保留胃网膜左血管及脾门血管。观察脾脏血运,如脾脏明显缺血,则联合脾脏切除。③除外上述2种方法的危险因素者采用Kimura法:继续由胰腺后方向头侧游离,贯通胰腺,并预制胰腺吊带。助手向上方提起胰腺吊带,术者应用Endo-GIA于脾动、静脉上方切断胰腺,向左侧分离胰腺与脾血管之间的间隙,仔细处理分支血管,直至完整切除胰体尾。距离胰腺断面约0.5 cm处应用4-0 Prolene缝线做2~3针“U”形绞锁缝合。胰腺断面上、下缘交叉放置硅胶引流管各1根。如联合脾脏切除,脾窝单独放置引流管1根。标本装入标本袋,经脐下扩大切口取出。如果术中出现难以控制的出血或腹腔镜下难以完成手术则选择中转开腹手术。
2 结果
4例因脾血管出血难以控制中转开腹;行腹腔镜保留脾脏胰体尾切除15例,其中保留脾血管的保脾胰体尾切除(Kimura法)10例,不保留脾血管的保脾胰体尾切除(Warshaw法)5例,DPS 11例,见表1。术后3~5 d恢复肛门排气,并进食流食。术后住院时间7~22 d,(12.2±2.4)d。术后病理:黏液性囊腺瘤9例,实性假乳头状瘤7例,神经内分泌肿瘤6例,浆液性囊腺瘤3例,胰腺囊肿3例,导管内乳头状黏液瘤1例,异位脾脏1例。术后胰漏发生率36.7%(11/30),其中A级9例,B级2例。A级胰漏均无须特殊处理,B级胰漏通过术后延长腹腔引流管留置时间、充分引流治愈,术后带管时间分别为32、49 d,无胰漏相关性出血及死亡。部分脾梗死1例,该患者行不保留脾血管的胰体尾切除。未发生术后腹腔出血、脾静脉残端及门静脉系统血栓形成、腹腔感染、胃排空障碍等并发症。21例随访中位时间15个月(6~36个月),未见肿瘤复发。
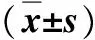
表1 不同手术方式的手术时间、出血量
3 讨论
胰腺位置深在,周围毗邻脏器众多,解剖关系复杂,种种原因限制腹腔镜胰腺手术的发展。近年来,腔镜技术及器械不断发展使腹腔镜胰腺手术不断成熟,腹腔镜胰体尾切除术便是其中的代表。国内外相继出现超过100例次腹腔镜胰体尾切除的报道[1~4]。但多数恶性肿瘤因其特殊的生物学行为,发现时往往已经出现周围组织、脏器及血管的侵犯,而且需要联合淋巴结清扫,腹腔镜完成该类手术难度大。其中一部分良性、交界性或低度恶性肿瘤往往包膜完整、边界清晰、无浸润性生长表现,即使肿瘤巨大,手术切除难度也相对较低,适宜腹腔镜切除[5]。腹腔镜的放大效果和清晰的视野恰恰适合于在较小空间内进行精细的解剖。
3.1 术前精确评估,严格把握手术适应证
患者常无临床症状,部分患者可出现上腹或腰背部胀痛,胰岛细胞瘤患者多有反复发作低血糖伴晕厥病史。临床症状的差异取决于肿瘤的大小、位置及性质等因素。故对于考虑该类疾病的患者,术前均需应用各种手段尽量明确肿瘤的性质、位置,与周围脏器及脾血管的关系,并做肿瘤可切除性分析。其中肿瘤性质及与脾血管的关系是首先需要考虑的要素,术前主要依靠彩色多普勒超声、薄层CT扫描及高场强MRI进行判断。彩超经济实用,阳性率高,对肿瘤的大小、位置等基本情况有较好地显示,可作为常规基础检查;CT能清晰地显示肿瘤及胰腺周围的解剖关系、并能较为准确地判断肿瘤的性质、大小及位置等;而MRI对于微小病变及神经内分泌肿瘤的辨别更为准确,且对于肿瘤及胰腺周围解剖间隙的判断较CT更为清晰。因增加感染、出血、胰腺损伤或肿瘤破裂、转移的风险,故对于可能切除的肿瘤我们不主张术前穿刺活检。但对于高度怀疑恶性肿瘤,且因多发转移或无法耐受手术的患者,可以考虑穿刺活检明确肿瘤性质,为其后的姑息性治疗提供依据。因刚刚开始尝试全腹腔镜下切除该类肿瘤,前期手术经验相对不足,故我们仅选择术前诊断为良性、交界性或低度恶性肿瘤,且肿瘤及胰腺与周围脏器间仍然存在潜在的解剖间隙的患者,而肿瘤的大小是我们次要考虑的因素。
3.2 手术方式的选择
传统观点认为脾动、静脉走形于胰体尾实质内,胰体尾和脾脏属同一个解剖单元,故对于胰体尾病变多主张胰体尾联合脾脏一同切除。但随着现代医学对脾脏造血、免疫、内分泌、储存Ⅷ因子等各项功能的更多认识,对于局限于胰体尾的良性、交界性及低度恶性肿瘤,保留脾脏的胰体尾切除术已成为治疗的首选,其中又分为保留或不保留脾血管的保脾胰体尾切除术。我们认为对于肿瘤较大、与脾血管粘连致密难以分离或行保留脾血管手术过程中出血难以控制被迫切断脾血管者,选择不保留脾血管的保脾胰体尾切除术。该术式可大大降低手术难度,但会增加脾梗死的风险,且术后易发生胃周血管和胃黏膜血管曲张,增加上消化道出血的风险。对于肿瘤巨大与脾门关系密切难以分离或肿瘤有壁结节、蛋壳样钙化、高度怀疑恶变者选择DPS[6]。
3.3 技术要点和经验教训
①术者须有一定的腹腔镜手术经验及开腹胰体尾切除的手术经验作为基础。患者术中取平卧分腿位,头高30°左右、左侧抬高10°~15°有利于术野的显露。②采用五孔法,trocar布局类似腹腔镜胃癌手术,我们的经验是主操作孔可根据操作部位不同在左、右腹直肌外缘trocar孔自由变换,尤其是使用Endo-GIA离断胰腺时更加灵活方便,避免因切割角度不佳而造成胰腺损伤、闭合不良等情况发生。③充分打开胃结肠韧带,但应避免损伤胃网膜左血管及胃短血管。充分松解胃后壁、结肠系膜等与胰腺的粘连,向右直至胃及横结肠系膜融合处,部分患者可分离部分融合间隙,充分显露胰颈及胰腺上缘。否则在游离胰腺时容易发生结肠系膜血管或胃周血管损伤或进入错误间隙的情况。④解剖脾动脉干时需在纱布保护下下压胰腺,避免手术器械对胰腺的直接损伤。术者向上提起胃胰皱襞可清晰显露脾动脉起始段。贯通脾动、静脉干时需仔细、轻柔,切忌暴力操作,避免分支血管出血。该类细小分支血管,尤其是脾静脉分支,可采用“轻夹旋离法”进行离断[7],即超声刀轻夹小血管根部,将刀头工作面旋离主干血管至露出分支血管根部约2 mm以上再切断。这样离断后小血管有1 mm左右的断端,止血牢靠。如果发生分支血管出血,不要盲目钳夹,可用腔镜纱布或速即纱等止血材料压迫,部分可自行止血。如仍有出血需助手吸引器辅助,明确出血位置后再予以处理。⑤脾动、静脉与胰腺组织成功分离后,分别预制吊带,便于Endo-GIA置入以及胰腺与血管的分离,同时如果操作中发生血管出血还可用于临时阻断。⑥本组11例术后胰漏,我们体会术中应用Endo-GIA离断胰腺时应根据胰腺厚度及质地选择合适型号的钉仓,夹闭后应间隔20 s再行激发切断胰腺[8]。距离胰腺断面约0.5 cm应用4-0 Prolene缝线做2~3针“U”形绞锁缝合,既能够起到断面止血的作用,又能降低术后胰漏的发生率。胰腺断面上、下缘交叉放置硅胶引流管各1根,既能达到充分引流的目的,又可以在胰瘘发生后进行腹腔冲洗。⑦因胰尾与脾门分支血管关系密切且血管走行复杂多变,故此处操作是该手术的难点之一,但二者之间存在疏松的组织间隙,故此处寻找并进入正确的间隙尤为重要。我们的经验是在胰尾表面切开胰腺被膜,于被膜下紧贴胰腺进行分离,可充分显露及保护上述血管。⑧对于术后脾梗死的预防,我们的经验是在行Warshaw手术过程中必须妥善保留胃网膜左血管及胃短血管。除此之外,保留脾脏的胰体尾切除术,无论是否保留脾脏血管,手术结束前均应认真检查脾脏血运,如果发现脾脏缺血严重或对于缺血程度难以准确判断者,应果断联合脾脏切除,避免术后出现大面积脾梗死或脾脓肿等严重并发症。
综上所述,对于胰体尾良性、交界性或低度恶性肿瘤,采用腹腔镜胰体尾切除安全可行,且手术创伤小、恢复快,具有临床推广价值。
1 陈灵华,牟一平,严加费,等.腹腔镜胰体尾切除术110例.中华普通外科杂志,2015,30(5):340-343.
2 Ding X, Tan J, Qian J,et al.Laparoscopic spleen-preserving distal pancreatectomy (LSPDP).Hepatogastroenterology,2013,60(123):605-610.
3 Song KB, Kim SC, Park JB, et al.Single-center experience of laparoscopic left pancreaticresection in 359 consecutive patients: changing the surgical paradigm of left pancreatic resection. Surg Endosc,2011,25(10):3364-3372.
4 Jean-Philippe Adam, Alexandre Jacquin, Christophe Laurent, et al. Laparoscopic spleen-preserving distal pancreatectomy: splenic vessel preservation compared with the Warshaw technique. JAMA Surg, 2013,148(3):246-252.
5 苗 毅.微创理念下胰腺囊性肿瘤的外科治疗策略.中国实用外科杂志,2013,33(6):434-437.
6 中华医学会外科学分会胰腺外科学组.胰腺囊性疾病诊治指南(2015).中华外科杂志,2015,53(9):641-645.
7 彭承宏, 李 花.开腹还是腹腔镜或机器人:胰体尾肿瘤切除方式的选择.中华外科杂志,2016,54(11):807-810.
8 吴志明, 孟兴成,储修峰.腹腔镜胰体尾切除术6例报告.中国微创外科杂志,2014,14(1):69-70,80.
