西妥昔单抗联合化疗治疗转移性结直肠癌的临床观察
2018-03-08王玲
王 玲
转移性结直肠癌(metastatic colorectal cancer,MCRC)是危险系数较高的消化道类恶性肿瘤。手术治疗是当前根治结直肠癌的唯一手段,但单一的手术治疗对中晚期的患者效果不佳,需要结合一些药物和放射的治疗。伴随着生长因子的受体单克隆的抗体药物西妥昔的面世,结直肠癌的治疗由此进入分子的靶向时代[1-2]。西妥昔单抗与肿瘤细胞的表皮生长的因子受体联合,可以封闭其内源性的配体部位,避免分子过分地激活,控制细胞的生长,减少了血管内生长因子和金属蛋白酶的产生;还可以调节身体的免疫系统,起到发挥抵抗肿瘤的作用[3]。因此,我们对采用西妥昔单抗联合化疗治疗MCRC的临床效果进行观察,现将结果报告如下。
1 资料与方法
1.1 一般资料
选择2015年10月至2016年10月在我院接受治疗的结肠癌患者200例。所有患者都经过病理组织学的检查并确诊,其中男性112例,女性88例;年龄33~77岁,平均57.8岁;病理分类:高分化腺癌有67例,中分化腺癌有94例,低分化腺癌有23例,黏液腺癌有16例。患者均有可用CT测评疗效的病灶。患者均没有重要的器官功能损坏,肝肾功能、血尿常规检查、心电图等都正常,没有化疗的禁忌证。预判的生存期都大于3个月。
1.2 患者分组及治疗方法
使用随机对照性研究,把所有患者分为2组:治疗组(92例)和对照组(108例)。2组患者的基本资料和病例史都没有明显的差异,有可比性。治疗组采用西妥昔单抗结合Folffox4的化疗方案对患者进行治疗,对照组只用Folffox4的化疗方案进行治疗。对2组患者进行疗效和不良反应的统计分析。治疗组疗法[4]:先使用西妥昔单抗,间隔1 h以后再使用化疗药物。在使用西妥昔单抗前的35 min,对患者进行苯海拉明的18 mg肌肉注射、地塞米松的8 mg静脉推射和0.3 g的西米替丁静脉滴注。患者第1次静脉滴注西妥昔单抗时为410 mg/m2,持续120 min,以后每周500 mg/m2,连续静脉滴注60 min。对照组疗法:单一Folffox4化疗。2组的治疗均为14天1个周期。
1.3 治疗效果的测评和不良反应
2组的患者都要完成4个周期以上的治疗,如果患者在治疗周期内病情严重,且证实是PD的患者则不再进行治疗。患者每周进行一次心电图、血常规和肝肾功能的检查,每4周进行一次盆腔B超、腹部B超和胸片的检查,需要进行CT和全身骨骼的扫描。
治疗效果的评判标准:按照Recist的抗肿瘤标准[5],分为完全缓解(CR)、部分缓解(PR)、病情稳定(SD)和进展(PD)。
不良反应:按WHO的判定标准[6],分为0~Ⅳ级。神经毒性为Levis的感觉神经毒性的分级准则,分为4个等级。查看患者的血压、胃肠道的反应、心率、体温及肝肾功能、血常规的指标。重点记录患者在治疗过程中出现的白细胞减少、皮疹、腹泻、过敏、呕吐和骨髓抑制等反应。
1.4 统计学方法
采用SPSS20.0统计软件进行数据分析,计量资料用均数±标准差来表示。组内数据用t检验,组间对比应用one-way anova分析,若方差不符合比较要求则用组组对比。计数资料采用χ2检验。P>0.05为差异无统计学意义。
2 结果
2.1 2组患者治疗的效果情况比较
2组患者都完成了4个周期以上的治疗,都可评判其治疗效果。治疗组的治疗有效率(CR和PR)为54.3%(50/98),对照组的治疗有效率为37.0%(40/108),2组的有效率有统计学差异(χ2=3.104,P=0.009),见表1。

表1 治疗组和对照组患者疗效比较/例
2.2 2组患者出现的不良反应情况比较
2组患者出现的不良反应主要包含肝肾功能的损坏、骨髓的抑制、呕吐、腹泻、过敏、神经毒性和过敏等,但多数都是轻微型,不影响继续治疗。治疗组患者大范围地出现痤疮样的皮疹,这个是用西妥昔治疗后出现的典型反应,一般发生在用药的前3周,主要在面部、胸背部和四肢。治疗组皮疹的发生率比对照组高,但经皮疹治疗后不影响后续治疗,见表2。
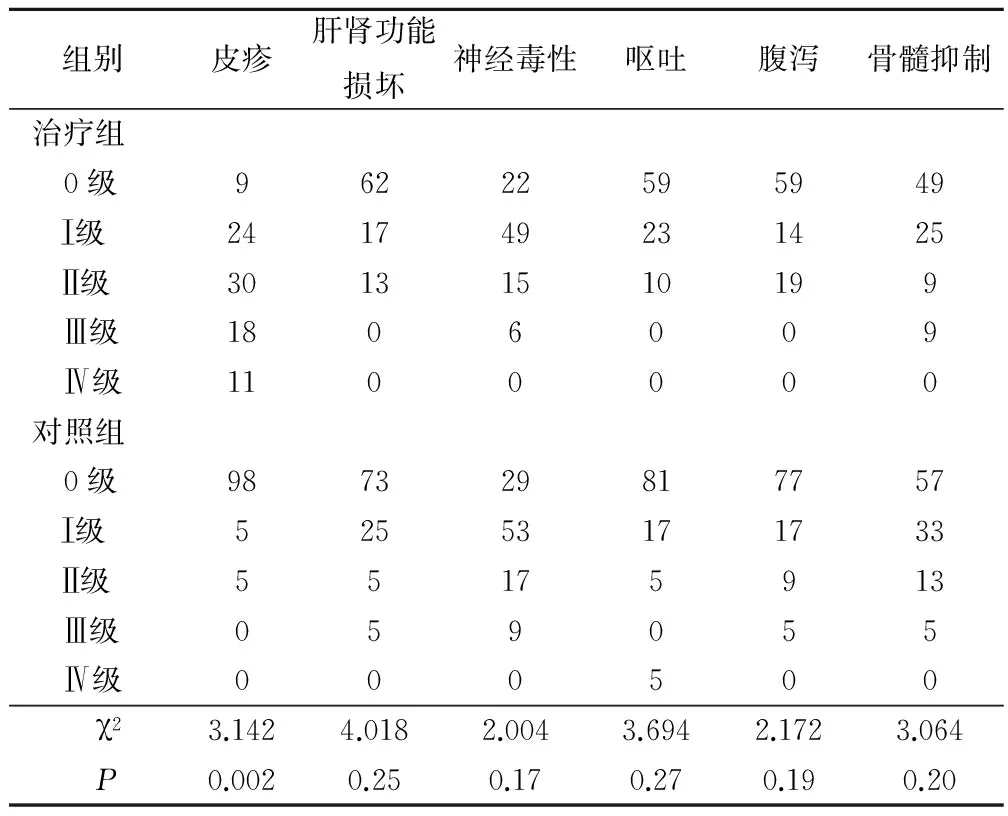
表2 对照组和治疗组患者的不良反应情况对比/例
3 讨论
晚期结直肠癌的治疗措施主要就是化疗。临床常用化疗药物主要包含拓扑异构酶、5-FU和第三代的铂类等[7-11],但这些药物的毒副作用较严重,限制了其在临床上的应用。当前,肿瘤分子的靶向治疗日渐成熟,且治疗药物的效率高、靶向性较好、毒性低,在缓解患者病情、控制肿瘤的发展和改善患者生活质量方面有更广阔的发展前景[12-15]。
本文使用随机对照研究的方法,对200例患者分组进行调查,观察患者在治疗后的疗效和不良反应,并对调查的结果进行统计学分析。结果显示,治疗组(西妥昔单抗结合化疗)的总有效率达54.3%,病情好转或痊愈的过半数,而对照组(单一化疗)的总有效率只有37.0%,2组对比有明显的差别。在毒副作用方面,2组患者出现的不良反应主要有神经毒性、肝肾功能的损坏、呕吐、腹泻和骨髓抑制等,但多数都是轻微型的,对症治疗或不治疗即可自己痊愈;但治疗组出现了大面积的皮疹反应,比对照组高,这是使用西妥昔单抗的正常反应,经过对症治疗后不影响后续的治疗,其安全性也是可靠的。
综上所述,西妥昔单抗是当前肿瘤分子靶向方面治疗的研究成果之一,对于结直肠癌患者个体的治疗有重大的意义。本研究也证实,西妥昔单抗结合化疗可以有效地提高MERC患者的疗效且安全。
[1] Ellis AG,Reginster JY,Luo X,et al.Bazedoxifene versus oral bisphosphonates for the prevention of nonvertebral fractures in postmenopausal women with osteoporosis at higher risk of fracture: a network meta-analysis〔J〕.Value Health,2014,17(4):424-432.
[2] Hamrick I,Schrager S,Nye AM.Treatment of osteoporosis:current state of the art〔J〕.Wien Med Wochenschr,2014,65(8):54-64.
[3] Wan L,Chen W,Yang L.The efficacy of parathyroid hormone analogues in combination with bisphosphonates for the treatment of osteoporosis:a meta-analysis of randomized controlled trials〔J〕.Medicine,2015,94(9):223-231.
[4] Zhang T,Su D,Li J,et al.Clinical efficacy observation of cetuximab combined with chemotherapy in the treatment of metastatic colorectal carcinoma〔J〕.Zhonghua wei chang wai ke za zhi,2015,18(6):584-588.
[5] Bai M,Deng T,Han R,et al.Gemcitabine plus S-1 versus cetuximab as a third-line therapy in metastatic colorectal cancer: an observational trial〔J〕.Int J Clin Exp Med,2016,8(11):2159-2165.
[6] Graham CN,Maglinte GA,Schwartzberg LS,et al.Economic analysis of panitumumab compared with cetuximab in patients with wild-type KRAS metastatic colorectal cancer that progressed after standard chemotherapy〔J〕.Clin Ther,2016,38(6):1376-1391.
[7] Lin L,Chen L,Wang Y,et al.Efficacy of cetuximab-based chemotherapy in metastatic colorectal cancer according to RAS and BRAF mutation subgroups: A meta-analysis〔J〕.Mol Clin Oncol,2016,4(6):78-80.
[8] Semrad TJ,Fahrni AR,Gong IY,et al.Integrating chemotherapy into the management of oligometastatic colorectal cancer:evidence-based approach using clinical trial findings〔J〕.Ann Surg Oncol,2015,22(Suppl 3):S855-862.
[9] Do K,Liang C,Kang Z,et al.A phase Ⅱ study of sorafenib combined with cetuximab in EGFR-expressing,KRAS-mutated metastatic colorectal cancer〔J〕.Clin Colorectal Cancer,2015,14(3):154-161.
[10] Pietrantonio F,Mazzaferro V,Miceli R,et al.Pathological response after neoadjuvant bevacizumab-or cetuximab-based chemotherapy in resected colorectal cancer liver metastases〔J〕.Med Oncol,2015,32(7):1-10.
[11] Inoue M,Takahashi S,Soeda H,et al.Gene-expression profiles correlate with the efficacy of anti-EGFR therapy and chemotherapy for colorectal cancer〔J〕.Int J Clin Oncol,2015,20(6):1147-1155.
[12] Taniguchi H,Yamazaki K,Yoshino T,et al.Japanese society of medical oncology clinical guidelines:RAS,(KRAS/NRAS) mutation testing in colorectal cancer patients〔J〕.Cancer Sci,2015,16(3):324-327.
[13] Boeckx N,Peeters M,Camp GV,et al.Prognostic and predictive value of RAS,gene mutations in colorectal cancer:moving beyond KRAS,Exon 2〔J〕.Drugs,2015,75(10):1739-1756.
[14] Chiadini E,Scarpi E,Passardi A,et al.EGFR methylation and outcome of patients with advanced colorectal cancer treated with cetuximab〔J〕.Oncol Lett,2015,9(3):1432-1438.
[15] Huiskens J,Gulik TMV,Lienden KPV,et al.Treatment strategies in colorectal cancer patients with initially unresectable liver-only metastases,a study protocol of the randomised phase 3 CAIRO5 study of the Dutch Colorectal Cancer Group (DCCG)〔J〕.Bmc Cancer,2015,15(1):1-7.
