基于GEO数据库的胃癌耐药基因表达谱分析及其对预后的影响
2018-03-08胡国兴余晓茹
胡国兴 余晓茹
据统计,胃癌是致死人数排名第三的恶性肿瘤[1]。由于胃癌早期症状不明显,所以大部分患者在确诊时已到晚期[2]。然而晚期胃癌多已发生转移,且预后不良[3],因此,深入研究并阐明胃癌的转移以及耐药机制对胃癌的防治具有十分重要的意义。
恶性肿瘤实现转移并且发展耐药性涉及环节众多[4-5]。上皮间质转化能使恶性肿瘤细胞失去上皮细胞的特性,使其易于发生浸润和转移,同时,产生对相关化疗药物的耐药性[6-7]。众多的研究证实,EMT是启动恶性肿瘤细胞实现转移的关键环节[8-9]。EMT是胃癌转移过程中胃癌细胞所发生的重要表型变化[10],当胃癌细胞受到微环境中多种信号的刺激时,胃癌细胞由此获得迁移和耐药的能力[11]。
本研究通过对GEO数据库中的胃癌患者组织表达谱数据的分析,旨在通过相关胃癌的耐药基因的表达研究及相关样本的预后情况,了解胃癌耐药性基因表达的相关性,以及其异常表达对胃癌预后生存的影响,以期为临床耐药性胃癌患者的用药和治疗提供一个可靠的理论基础。
1 材料与方法
1.1 研究材料
本研究所用到的材料均来自于NCBI的GEO数据库,具体信息见表1。
1.2 分析方法
1.2.1 表达量分析 基于数据库特定研究样本数据集中特定目标基因的表达量的相对值进行表达量的分析,所有数据都经过对数转换和中位数中心化处理。根据表达量处理后数据进行聚类和差异分析。文中热图由HemI软件制作,比较差异分析图由GraphPad Prism 5软件制作。
1.2.2 生存分析 基于数据库特定研究样本数据集中特定目标基因的表达量的相对值及对应样本的总生存(OS)和无复发生存(RFS)信息进行生存分析,所有数据都经过对数转换和中位数中心化处理,并采用Kaplan-Meier分析方法进行分析。
1.2.3 相关性分析 基于数据库特定研究样本数据集中特定目标基因的表达量的相对值进行相关性分析,所有数据都经过对数转换和中位数中心化处理。
2 结果
2.1 相关耐药基因在胃癌患者中的表达分析
为了评估胃癌耐药基因的表达变化,选取了4个已有报道过的胃癌相关的耐药基因,分别为ATP结合盒亚家族B成员1蛋白(ATP binding cassette subfamily B member 1,ABCB1)、肺耐药蛋白(lung resistance protein,LRP)、葡糖神经酰胺合成酶(glucosylceramide synthase,GCS)和谷胱甘肽转移酶π(glutathione S transferase pi,GST-π),据以往的相关研究表明,这些基因在胃癌的耐药性调控方面都起着非常重要的作用。据此,对不同数据集中的胃癌组织样本和正常胃组织样本的这些基因的表达进行了表达谱的聚类分析,结果表明,不同耐药相关基因在胃癌组织和正常胃组织间的表达存在差异,如ABCB1和LRP基因在胃癌组织中存在明显的高表达。这些表明,耐药基因的表达在胃癌组织间存在差异,可能与胃癌的耐药性的不同有关。
2.2 正常与胃癌组间耐药基因的表达差异比较
与正常胃组织相比,ABCB1、LRP、GCS和GST-π基因在胃癌组织中存在明显的高表达(ABCB1,P<0.0001;LRP,P<0.0001;GCS,P=0.0035;GST-π,P<0.0001)(图1)。

图1 正常组与胃癌组间耐药相关基因的表达差异比较
2.3 耐药基因表达间的相关性分析
在胃癌组织中ABCB1和LRP的表达呈正相关(P<0.0001,γ=0.6157);而且GCS与GST-π的表达同样呈正相关性(P<0.0001,γ=0.6666)(图2)。然而,ABCB1与GCS的表达呈负相关(P=0.032,γ=-0.02301)。说明在胃癌组织中,ABCB1与LRP以及GCS与GST-π可能存在协同高表达的情况,而ABCB1和GCS之间则可能是一种耐药功能上的互补关系。综上,即便是在同样高表达胃癌组织中,各耐药基因的高表达情况并不完全同步,且可能存在互补的现象。
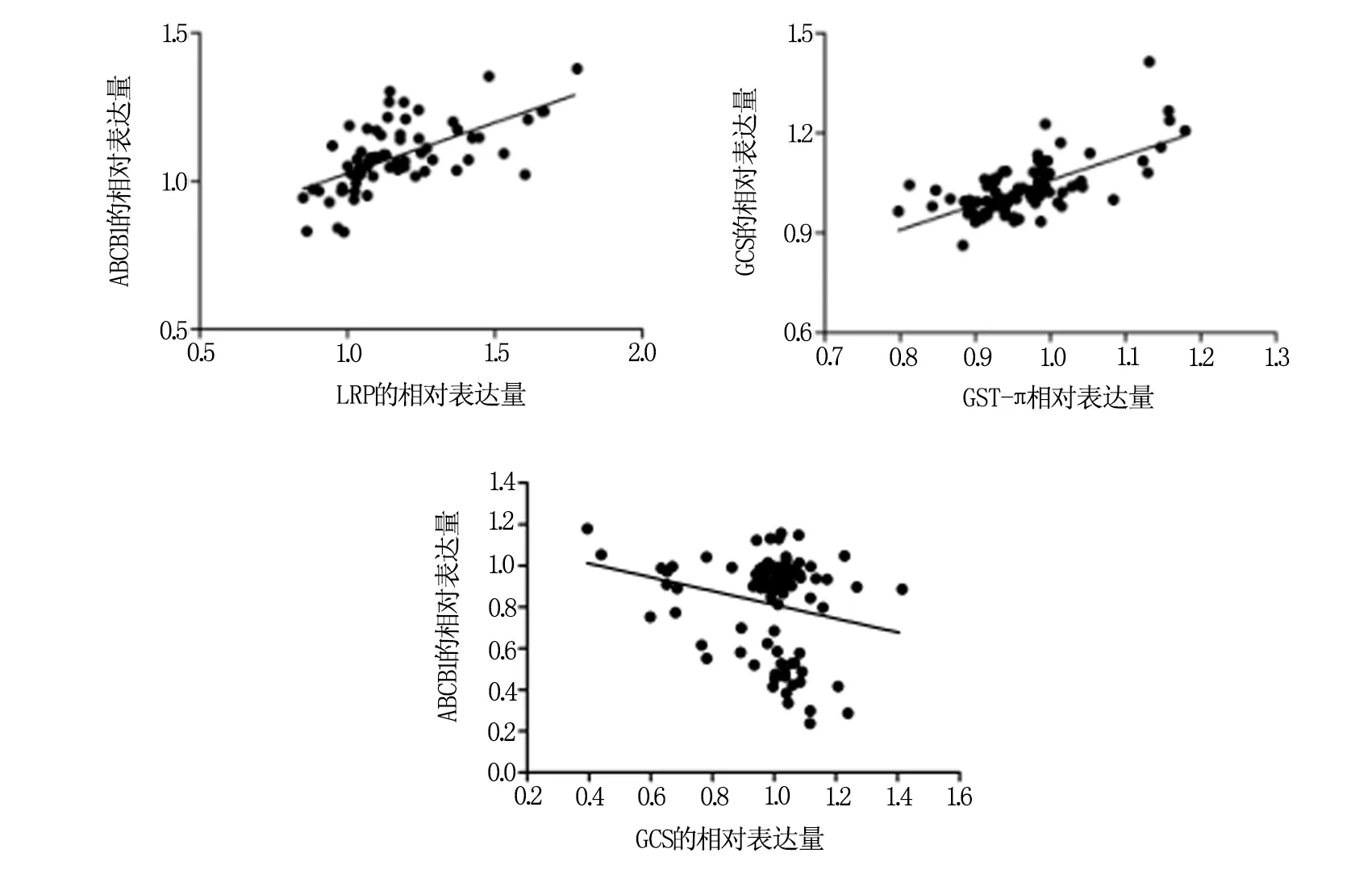
图2 胃癌组织中相关耐药基因表达相关性分析
2.4 耐药基因异常表达对胃癌患者生存及预后的影响
在胃癌患者中,ABCB1的高表达会导致肺癌患者的总生存率明显降低(P=0.0037),并且它的高表达也同样会导致肺癌患者的无复发生存率明显降低(P=0.0007);与此类似,GCS的高表达也会导致肺癌患者的总生存率明显降低(P=0.0223),并且它的高表达也同样会导致肺癌患者的无复发生存率明显降低(P=0.0175)(图3)。
3 讨论
在我国,胃癌是发病率和死亡率排名第三的恶性肿瘤。虽然早期胃癌根治术后5年生存率可达90%以上,但胃癌早期症状不明显,大部分患者就诊时已到中晚期。胃癌的耐药转移是胃癌临床治疗失败和危及患者生命的最主要原因,因此,深入探讨胃癌耐药相关基因在胃癌中的表达情况及其与胃癌患者预后生存的关系可以在一定程度上为解决胃癌防治提供一定的理论基础。
我们的研究分析表明,ABCB1、LRP、GCS和GST-π基因在胃癌组织中存在不同程度的高表达现象。这一表达情况的分析证明了耐药基因异常表达的情况存在于胃癌病例中,且有可能与胃癌的某些进程相关。与此同时,对胃癌组织与正常胃组织间耐药基因的表达差异的分析显示,部分耐药相关基因在此之间存在差异表达。针对于此,进一步的研究结果显示,在胃癌组织中ABCB1和LRP及GCS和GST-π的表达情况均呈正相关;而ABCB1和GCS的表达情况呈负相关。这就说明,在胃癌组织中,ABCB1和LRP以及GCS和GST-π可能存在协同高表达的情况,而ABCB1和GCS之间则可能是一种耐药功能上的互补关系。所以即便是在同样高表达胃癌组织中,各耐药基因的高表达情况并不完全同步,且可能存在互补的现象。最终,我们对本研究分析筛选出的耐药基因ABCB1和GCS进行了生存分析,在胃癌患者中,ABCB1的高表达会导致肺癌患者的总生存率明显降低,并且它的高表达也同样会导致肺癌患者的无复发生存率明显降低;同样,GCS的高表达也会导致肺癌患者的总生存率明显降低,并且它的高表达也同样会导致肺癌患者的无复发生存率明显降低。

图3 ABCB1和GCS高表达对胃癌患者的生存分析
通过本研究对相关数据库中胃癌样本和正常胃组织样本数据的分析和归纳,发现在胃癌中部分相关耐药基因的存在差异表达的情况,尤其是高表达的耐药基因之间还可能存在一种互补协同的关系,通过这样的表达关系可以更大化地维持肿瘤的增殖和存活等功能,以进一步增强肿瘤的耐药性。这就与某些胃癌病例的不同耐药性相关联了,鉴于此,在今后的研究和临床治疗中,可以以这些差异表达的耐药基因作为针对的依据及靶向治疗的靶点。
[1] Cancer Genome Atlas Research N.Comprehensive molecular characterization of gastric adenocarcinoma〔J〕.Nature,2014,513(7517):202-209.
[2] Yeoh KG.How do we improve outcomes for gastric cancer?〔J〕.J Gastroenterol Hepatol,2007,22(7):970-972.
[3] Takaoka M,Naomoto Y,Ohkawa T,et al.Heparanase Expression Correlates with Invasion and Poor Prognosis in Gastric Cancers〔J〕.Lab Invest,2003,83(5):613-622.
[4] Liotta LA,Steeg PS,Stetler-Stevenson WG.Cancer metastasis and angiogenesis:an imbalance of positive and negative regulation 〔J〕.Cell,1991,64(2):327-336.
[5] Kang Y,Massague J.Epithelial-mesenchymal transitions:twist in development and metastasis〔J〕.Cell,2004,118(3):277-279.
[6] Davidson B,Holth A,Hellesylt E,et al.The clinical role of epithelial-mesenchymal transition and stem cell markers in advanced-stage ovarian serous carcinoma effusions〔J〕.Hum Pathol,2015,46(1):1-8.
[7] Tan TZ,Miow QH,Miki Y,et al.Epithelial-mesenchymal transition spectrum quantification and its efficacy in deciphering survival and drug responses of cancer patients〔J〕.EMBO Mol Med,2014,6(10):1279-1293.
[8] Singh A,Settleman J.EMT,cancer stem cells and drug resistance:an emerging axis of evil in the war on cancer 〔J〕.Oncogene,2010,29(34):4741-4751.
[9] Akalay I,Janji B,Hasmim M,et al.Epithelial-to-mesenchymal transition and autophagy induction in breast carcinoma promote escape from T-cell-mediated lysis〔J〕.Cancer Res,2013,73(8):2418-2427.
[10] Huang J,Xiao D,Li G,et al.EphA2 promotes epithelial-mesenchymal transition through the Wnt/β-catenin pathway in gastric cancer cells〔J〕.Oncogene,2014,33(21):2737-2747.
[11] Kannan A,Krishnan A,Ali M,et al.Caveolin-1 promotes gastric cancer progression by up-regulating epithelial to mesenchymal transition by crosstalk of signalling mechanisms under hypoxic condition〔J〕.Eur J Cancer,2014,50(1):204-215.
