老年晚期非小细胞肺癌外周血RRM1表达与吉西他滨疗效及预后的相关性研究*
2018-03-08江波朱颖涂长玲何文杰聂俊杨承纲
江波,朱颖,涂长玲,何文杰,聂俊,杨承纲
[昆明医科大学第三附属医院(云南省肿瘤医院)1.干部医疗科,2.病理科,云南 昆明 650118]
无驱动基因的晚期NSCLC的一线标准化疗方案目前仍然是铂类为基础的双药方案。既往临床实践提示:在化疗方案及药物剂量相同的情况下,不同个体对化疗的敏感性差异很大,这种差异使依靠临床经验进行化疗面临着极大的挑战。老年人是个特殊群体,器官功能与药物代谢和年轻人不同,临床中有很多老年患者因化疗疗效的不确定性和毒副反应的不可避免性而选择放弃治疗。DNA是许多抗肿瘤药物的分子靶点,DNA的修复能力影响着化疗药物的疗效,也和化疗药物的耐药性相关。为了提高药物的疗效,减轻毒副反应,可以通过对化疗药物相关基因或蛋白的表达水平或多态性进行检测,筛选出能够从化疗中获益的老年人群,从而提高疗效,减低毒副反应。现阶段定量分析RRM1表达水平的研究主要针对来源于纤维支气管镜活检或手术切除获得的肿瘤组织,而对于老年晚期患者来说,组织标本无法再次获取或者组织量较少的问题尤为突出。本研究采用实时荧光定量聚合酶链反应(qRT-PCR)检测老年晚期NSCLC患者外周血中RRM1的表达与吉西他滨化疗药物疗效及预后的相关性,旨在寻找一种简便易行的检测方法进行化疗药物的筛选。
1 资料与方法
1.1 临床资料
筛选云南省肿瘤医院2013年9月-2015年12月收治且经病理组织学诊断的晚期NSCLC患者40例,其中,男性32例,女性8例,男∶女为4∶1,年龄70~78岁,平均73岁,PS评分≤2分。病理类型:鳞癌30例,均未行EGFR突变检测;腺癌10例,其中6例EGFR野生型,4例EGFR突变未知型。Ⅲb期8例,Ⅳ期32例。化疗前行CT,彩超和全身骨骼核素扫描,常规检查心、肺、肝、肾等功能。化疗采用吉西他滨单药的化疗方案:吉西他滨1 000 mg/m2第1和8天,每21~28 d为1个周期;连续2~6个周期。病理组织分型按WHO组织学分类(1998)标准,分期按1997年国际抗癌联盟(UICC)制订的标准。
1.2 试剂和仪器
外周血中RNA提取试剂盒,cDNA合成试剂盒,荧光定量PCR试剂盒均购自北京天根生化科技公司。PCR仪,凝胶成像系统由北京BioRAD公司生产。
1.3 引物设计和合成
根据GeneBank的序列RRM1及管家基因β-actin进行引物设计。RRM1正向引物:5'-CCCTGACTATG CTATCCTGGC-3',反向引物:5'-ACCATGGGAGAGTG TTTGCC-3';管家基因正向引物:5'-AGCCTCGCCTTTG CCG-3',反向引物:5'-CTCGTCGCCCACATAGGAAT-3'。引物由北京Invitrogen公司合成。
1.4 外周血中RNA的提取及cDNA的合成
在化疗前和2个周期化疗后分别抽取患者外周静脉血4 ml置于EDTA抗凝管中,离心后弃去上层血浆,将细胞层移入离心管中。依据血液RNA提取试剂盒操作规程进行外周血中RNA的提取。依据cDNA合成试剂盒操作规程进行cDNA的合成反应。
1.5 qRT-PCR
将质粒标准品RRM1及管家基因质粒标准品等比稀释成6个浓度后,进行SYBR qRT-PCR。反应体系中加入Real Master Mix/SYBR Solution 22.5μl,正反向引物各 1μl,Rox reference dye 0.5μl,DNA 模板5μl,DEPC水20.5μl。反应条件:聚合酶的活化20 s,95℃,PCR扩增40个循环。
1.6 疗效判断标准
疗效按WHO实体瘤标准判定分为:完全缓解(complete response,CR),部分缓解(partial response,PR),疾病稳定(stable disease,SD), 疾 病进展(progression disease,PD)。CR+PR为有效,CR+PR+SD为控制。无进展生存期(progression free survival,PFS)指自治疗首日至病变进展日;总生存期(overall suvvival,OS)为治疗首日至死亡日或失访日,均以月计。随访结止时间:2016年4月。
1.7 统计学方法
采用SPSS 17.0统计学软件进行数据分析。进行统计处理前,治疗前外周血RRM1的表达以其中位数为界,分为高表达组和低表达组。2个样本率的比较采用χ2检验,生存分析采用Kaplan-Meier法、Logrank法检验及Cox多因素回归分析;P<0.05为差异有统计学意义。
2 结果
2.1 外周血RRM1及管家基因的电泳结果
以含有RRM1和管家基因的质粒作为模板进行PCR扩增,产物经琼脂凝胶电泳检测,条带清晰,片段长度正确,经测序证实两序列一致。见图1。

图1 外周血中RRM1不同表达水平的电泳结果
2.2 外周血RRM1的表达水平
以管家基因β-actin作为内参,计算RRM1的相对表达量。计算方法:RRM1mRNA拷贝数/β-actin mRNA拷贝数,计算平均值。外周血中RRM1的中位表达水平为:26.7%(12.32%~55.86%)。
2.3 外周血RRM1表达与临床特征的关系
外周血RRM1的表达水平以中位数26.7%为界分为高表达组和低表达组。高表达组的表达水平为:(51.65%±4.21%);低表达组的表达水平为:(15.33%±3.01%)。两组与临床特征的相关性见表1。

表1 外周血RRM1表达与临床特征的相关性
2.4 外周血RRM1表达与化疗疗效的关系
本组患者共接受单药吉西他滨方案化疗146周期,无CR患者,9例PR,总有效率(CR+PR)为22.5%,8例SD(20%),疾病控制率(CR+PR+SD)为42.5%,23例PD(57.5%)。RRM1低表达组有效率(RR)40%(8/20),RRM1 高表达组有效率 5%(1/20),两组差异有统计学意义(P=0.023)。RRM1低表达组疾病控制率(disease control rate,DCR)65%(13/20),RRM1高表达组疾病控制率20%(4/20),两组差异有统计学意义(P=0.004),见表2。

表2 外周血RRM1表达水平与化疗疗效的关系 (n=20)
2.5 外周血RRM1表达与生存期的关系
本组病例中位总生存期(OS)为13.3个月,1年生存率为66.7%,2年生存率为4.6%。RRM1低表达组和高表达组,中位OS分别为14.8个月和11.6个月,1年生存率分别为76.7%和53.3%;2年生存率分别为9.3%和0%。经Log-rank检验,差异有统计学意义(P=0.004),见图1。OS与性别(男:13个月vs女:15个月,P=0.052)、病理类型(鳞癌:14个月vs腺癌:14.5个月,P=0.139)、分期(ⅢB期:13.2个月vsⅣ期:14.5个月,P=0.148)均无相关性。
本组病例中位无进展生存期(PFS)为3.7个月。RRM1低表达组和高表达组,中位PFS分别为4.4个月和3.2个月;经Log-rank检验,差异有统计学意义(P=0.012)。见图2、图3。
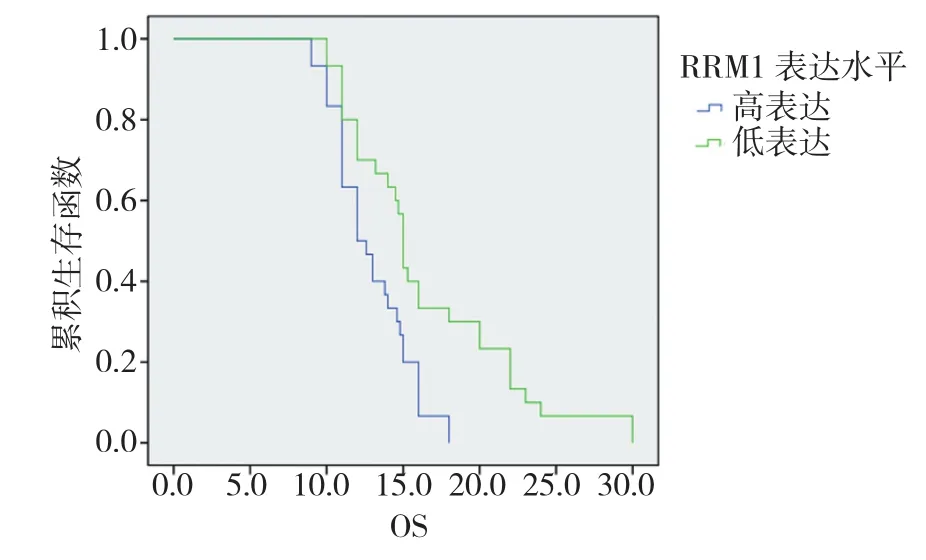
图2 外周血RRM1表达水平与生存期的关系
2.6 晚期NSCLC预后的Cox多因素分析
将OS单因素分析中有统计学意义的变量纳入多因素分析时,Cox回归分析显示:RRM1表达是有统计学意义的预后因素,见表3。

图3 外周血RRM1表达水平与无进展生存期的关系

表3 Cox回归变量分析
3 讨论
已有研究[2-4]提示:吉西他滨用于肿瘤细胞时,RRM1的表达水平增高会使肿瘤细胞的耐药性增加。既然晚期NSCLC患者中RRM1的表达水平与肿瘤细胞对吉西他滨耐药的相关性已经明确,RRM1的表达水平应该可以成为筛选患者的一项指标。多项Meta分析[5-7]提示:RRM1低表达的患者对吉西他滨化疗更敏感,生存期也更长;RRM1的表达可预测吉西他滨化疗的疗效。ZHANG等[8]的研究同时检测了外周血中RRM1和ERCC1的表达,发现外周血RRM1低表达的患者比RRM1高表达的患者有更高的化疗有效率和更长的无进展生存期及总生存期;而外周血ERCC1的表达水平与吉西他滨和铂类化疗的疗效及生存期无相关性。从现有的标本来看,外周血中的表达检测相对简便而且容易获取,对于无法获取组织及组织标本量较少的老年患者来说,外周血替代组织标本检测是可行的。
本研究以老年晚期NSCLC为研究对象,化疗药物选择单药吉西他滨,排除了铂类药物的影响因素,使研究因素较为单一,因此能较好地反应外周血RRM1的表达与吉西他滨疗效间的关系。研究显示:外周血RRM1的表达水平与老年晚期NSCLC患者的性别,病理类型及分期均无相关性。外周血RRM1低表达的患者比RRM1高表达的老年患者有更高的化疗有效率,疾病控制率和更长的无进展生存期及总生存期,说明老年晚期NSCLC外周血RRM1低表达的患者更能从吉西他滨的化疗中获益。而生存期与老年患者的性别,分期,病理类型无明显的相关性。多因素分析还显示外周血RRM1的表达水平是老年晚期NSCLC独立的预后因素。通过本项研究为晚期NSCLC无法再获取组织标本的老年患者如何选择化疗药物提供了理论依据。
[1]JEMAL A,SIEGEL R,WARD E,et al.Cancer statistics,2009[J].Ca A Cancer Journal for Clinicians,2009,59(4): 225-249.
[2]BEPLER G,WILLIAMS C,SCHELL M J,et al.Randomized international phase Ⅲ trial of ERCC1 and RRM1 expressionbased chemotherapy versus gemcitabine/carboplatin in advanced non–small-cell lung cancer[J].Journal of Clinical Oncology,2013,31(19): 2404-2412.
[3]ZHANG Y,LI X,CHEN Z,et al.Abstract 5537: Ubiquitination of RRM1 by Ring1B (RNF2) promotes its degradation and nuclear export[J].Cancer Research,2011,71(8 Supplement): 5537.
[4]BEPLER G,OLAUSSEN K A,VATAIRE A L,et al.ERCC1 and RRM1 in the international adjuvant lung trial by automated quantitatⅣe in situ analysis[J].American Journal of Pathology,2011,178(1): 69-78.
[5]ZENG C,FAN W,ZHANG X.RRM1 expression is associated with the outcome of gemcitabine-based treatment of non-small cell lung cancer patients-a short report[J].Cellular Oncology,2015,38(4):319-325.
[6]YAN ZHANG,XIN S U,YI SHI.Relationship between RRM1expression and therapeutic effects of gemcitabine for advanced non-small-cell lung cancer:a meta-analysis[J].Med J Chin Pla,2012,37(2): 135-140.
[7]GONG W,ZHANG X,WU J,et al.RRM1 expression and clinical outcome of gemcitabine-containing chemotherapy for advanced non-small-cell lung cancer: a meta-analysis[J].Lung Cancer,2012,75(3): 374-380.
[8]ZHANG G B,CHEN J,WANG L R,et al.RRM1 and ERCC1 expression in peripheral blood versus tumor,tissue in gemcitabine/carboplatin-treated advanced non-small,cell lung cancer[J].Cancer Chemotherapy & Pharmacology,2012,69(5): 1277-1287.
