激活素相互作用蛋白5在急性肝损伤动物模型中的表达变化及意义*
2018-03-08徐元红鞠宝玲聂影宋传芳吴昆庄彦华张红军
徐元红,鞠宝玲,聂影,宋传芳,吴昆,庄彦华,张红军
(1.牡丹江医学院附属红旗医院 消化内科,黑龙江 牡丹江 157011;2.牡丹江医学院 免疫学教研室,黑龙江 牡丹江 157011)
激活素是最早在性腺细胞中发现的二聚体糖蛋白,是转化生长因子β(transforming growth factor,TGF-β)超家族的一员,具有广泛的生物学功能[1-3]。近年研究表明[4-7]激活素与肝纤维化形成密切相关,它以自分泌/旁分泌的形式作用于肝实质细胞,不仅抑制肝细胞再生、诱导肝细胞凋亡、还能活化肝星状细胞(hepatic stellate cells,HSC)促进细胞外基质(extracellular matrix,ECM)合成,笔者在前期的研究中发现激活素及其Ⅱ A型受体,在刀豆蛋白A(concanavalin,ConA)诱导的慢性免疫性肝损伤模型中表达异常,其表达变化与肝组织病理损伤呈平行状态,提示激活素及其信号传导蛋白可能参与了ConA诱导的慢性肝损伤进程[8]。
ConA为T淋巴细胞的多克隆刺激剂,其诱导肝损伤的机制与T淋巴细胞、巨噬细胞活化及相关细胞因子的产生有重要联系,ConA诱导引发的肝损伤模型被认为是经典T细胞介导的急性肝细胞损伤性模型[9-11],有关激活素及其信号传导蛋白在Con A诱导的急性肝损伤过程中的作用研究较少。
激活素受体相互作用蛋白5(activin receptorinterating protein 5,ActRIP5)是激活素特异信号传导调控蛋白,在肝脏组织高表达,具有促进激活素信号传导的作用,是激活素在肝脏发挥作用的重要信号传导蛋白,本研究拟通过ConA诱导复制急性免疫性肝损伤模型,探讨ActRIP5在T细胞介导的急性肝损伤进程中的表达变化,进一步揭示激活素及其信号传导蛋白在急慢性肝损伤及肝纤维化形成进程中的作用,为以病毒性肝炎为主的免疫学性肝损伤的预防和治疗提供一定的研究依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 C57BL/C纯系小鼠,雄性,18~22 g,54只,由牡丹江医学院医药研究中心SPF级动物房提供。
1.1.2 主要试剂 Con A Ⅳ型(美国Sigma公司),Trizol试剂(美国Invitrogen公司),逆转录试剂盒(RevertAid First Strand Cdna Synthesis Kit)、SYBR实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测试剂盒均购自美国Thermo公司,PCR扩增引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 实验动物分组及模型复制 将54只C57BL/C纯系小鼠,适应性喂养1周随机分为9组,其中对照组6只,ConA给药组48只,分别为给药2、4、8、12、24、48、72和96 h组各6只。对照组以15 mg/kg生理盐水尾静脉注射,ConA给药组以15 mg/kg ConA尾静脉注射,分别于给药后2、4、8、12、24、48、72和96 h眼球取血后处死,称重,取肝、脾组织称重,留取肝脏组织分别行病理形态学检查、基因水平检测。
1.2.2 肝脏指数和脾脏指数 实验动物处死后称其体重,取出肝脏和脾脏,借助滤纸吸干后立即称重、记录。肝脏指数=肝脏重量/体重×100,脾脏指数=脾脏重量/体重×100。
1.2.3 血清ALT和AST测定 小鼠麻醉后摘眼球取血约1 ml,静置30 min后2 500 r/min,离心20 min。取上清液用生化法测定丙氨酸转氨酶(alanine aminotransferase,ALT)和天冬氨酶转氨酶(aspartate aminotransferase,AST)。
1.2.4 肝脏病理学检测 取小鼠肝组织右叶标本,用4%多聚甲醛固定24 h,常规石蜡包埋、切片。HE染色分析肝脏损伤程度。
1.2.5 qRT-PCR检测小鼠肝脏组织内激活素、ActRIP5的表达 液氮研磨肝脏组织,Trizol提取肝组织总RNA,取2μg总RNA进行逆转录,以GAPDH作为内参,反应条件为:50℃ 2 min,95℃10 min,1个循环;95℃ 15 s,60℃ 1 min,39个循环;M:60~90℃ 30 s,10℃ 10 min,1个循环。设定3个复孔,进行SYBR qRT-PCR。引物由美国Invitrogen公司合成。引物序列如下:GAPDH正向:5'-TGGCCTTCCGTGTTCCTAC-3',反向:5'-GAGTTGC TGTTGAAGTCGCA-3';激活素正向:5'-GCTGTATTAC GATGATGGT-3',反向:5'-TGTCTTCTCTGGACTCT C-3';ActRIP5 正向:5'-GATGCTGTAGACCTCTTC-3',反向5'-CTTCACCTCGATGTACTATA-3'。
1.3 统计学方法
运用SPSS24.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,所有数据资料符合正态分布特征及方差齐性,应用t检验和方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 血清ALT、AST水平
注射ConA分不同时相测定小鼠血清中ALT和AST的生化检测结果,小鼠血清ALT水平ConA给药组与对照组比较,给药后4 h开始升高,差异有统计学意义(t=5.976,P=0.002),8、12、24 h均高于对照组(t=8.702、19.076和 34.000,均P=0.000),至24 h达到峰值后开始下降,但给药48、72、96 h后仍高于对照组(t=31.853、11.154 和 7.275,P=0.000、0.000和0.001),96 h仍未恢复至正常水平。小鼠血清AST水平ConA给药组与对照组比较,自给药后4 h开始升高,差异有统计学意义(t=13.191,P=0.000),至24 h达到峰值后开始下降,至给药后96 h未恢复正常水平(t8h=19.895、t12h=47.647、t24h=38.676、t48h=51.946、t72h=20.633 和t96h=10.976,P8h=0.000、P12h=0.000、P24h=0.000、P48h=0.000、P72h=0.000 和P96h=0.024)。小鼠血清ALT、AST水平给药后4~96 h均高于对照组,差异有统计学意义,这说明ConA给药4 h开始造成肝细胞受到损伤,至24~48 h肝细胞损伤最重,随着给药时间的延长ALT、AST有所下降,肝细胞损伤未再继续加重但96 h未恢复至正常水平。见图1。
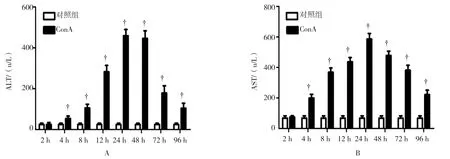
图1 ConA诱导急性肝损伤模型鼠小鼠血清ALT(A)和AST(B)水平变化
2.2 组织学改变
2.2.1 肝脏、脾脏大体标本肉眼观 对照组小鼠肝脏体积正常,质地软,有光泽,表面光滑。2、4、8 h组小鼠肝脏未见明显变化,12 h以后各给药组小鼠肝脏肿大,质地变韧、发白,表面粗糙,呈小结节状增生及模糊可见条纹状、片状坏死灶,且以72 h组为重。72 h组至96 h组小鼠损伤有减轻趋势,给药96 h组后肝损伤未恢复至正常水平。对照组小鼠脾脏体积正常,质地软,色泽红润,表面光滑,给药组2 h后小鼠脾脏出现充血水肿,体积增大,包膜紧张,色泽变暗发黑,质地变硬,24 h达高峰,随着给药时间的延长,逐渐恢复,至给药后96 h恢复接近正常水平。见图2。
2.2.2 肝脏组织病理检查结果 对照组肝细胞形态正常,无胞质疏松,肝细胞索清晰可见,小叶结构正常。给药后2 h组肝组织无明显病理变化;给药后4 h组可见肝细胞轻度肿胀,肝细胞索形态正常;给药后8 h组肝细胞进一步肿胀,胞质略疏松,细胞间隙变窄;给药后12 h组可见肝细胞肿胀,胞质疏松,肝细胞索形态仍正常;给药后24 h组肝脏切片可见明显的点状坏死,坏死处胞质疏松见大量中性粒细胞及淋巴细胞浸润,部分组织肝小叶结构紊乱,肝细胞索排列紊乱,部分肝细胞索消失;给药后48 h组病变持续加重组织肝小叶结构紊乱,肝细胞索消失;给药后72 h组肝脏组织损伤较前好转,仍有炎症细胞浸润但较前减轻,细胞肿胀较前减轻,可见肝细胞索结构存在;给药后96 h组肝损伤减轻但仍未恢复至正常,肝细胞略肿胀,胞质略疏松,偶见炎症细胞浸润,肝细胞索结构清晰,肝小叶结构完整。见图3。
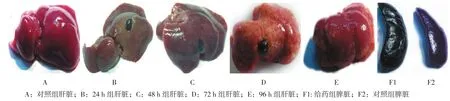
图2 ConA诱导急性肝损伤模型小鼠肝脏、脾脏形态变化

图3 ConA诱导急性肝损伤模型小鼠肝脏组织病理学变化 (HE染色×100)
2.2.3 肝脏指数、脾脏指数 肝脏指数检测显示自给药后12 h肝脏指数开始增大,至24~48 h达到峰值,72 h开始下降。脾脏指数检测显示自给药后8 h脾脏指数开始增大,至24 h达到峰值,48 h开始下降,96 h恢复正常水平。见附表。
2.3 急性肝损伤模型鼠肝组织内激活素、ActRIP5 mRNA的表达变化
ActRIP5 mRNA的表达水平与激活素mRNA的表达水平呈平行变化趋势,两者均在Con A给药后8 h出现突现1个高峰表达,然后表达逐渐下降,但仍高于正常对照组,呈现高水平表达,激活素mRNA的表达在96 h降至正常水平,而ActRIP5 mRNA水平于48 h降至正常水平。见图4。由此可见激活素及ActRIP5的表达于肝损伤进展期处于较高水平,于损伤恢复期表达逐渐下降,直至恢复至正常。
附表 小鼠肝脏指数、脾脏指数 (n=6,%,±s)
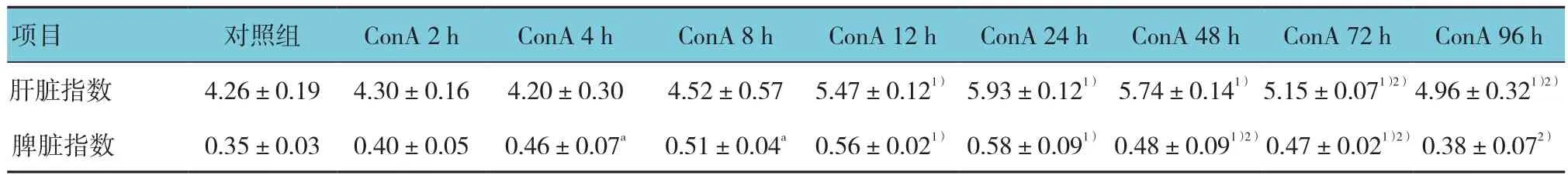
附表 小鼠肝脏指数、脾脏指数 (n=6,%,±s)
注:1)与对照组相比,P<0.05,2)与ConA 24 h峰值相比,P<0.05
项目 对照组 ConA 2 h ConA 4 h ConA 8 h ConA 12 h ConA 24 h ConA 48 h ConA 72 h ConA 96 h肝脏指数 4.26±0.19 4.30±0.16 4.20±0.30 4.52±0.57 5.47±0.121) 5.93±0.121) 5.74±0.141) 5.15±0.071)2)4.96±0.321)2)脾脏指数 0.35±0.03 0.40±0.05 0.46±0.07a 0.51±0.04a 0.56±0.021) 0.58±0.091) 0.48±0.091)2)0.47±0.021)2) 0.38±0.072)
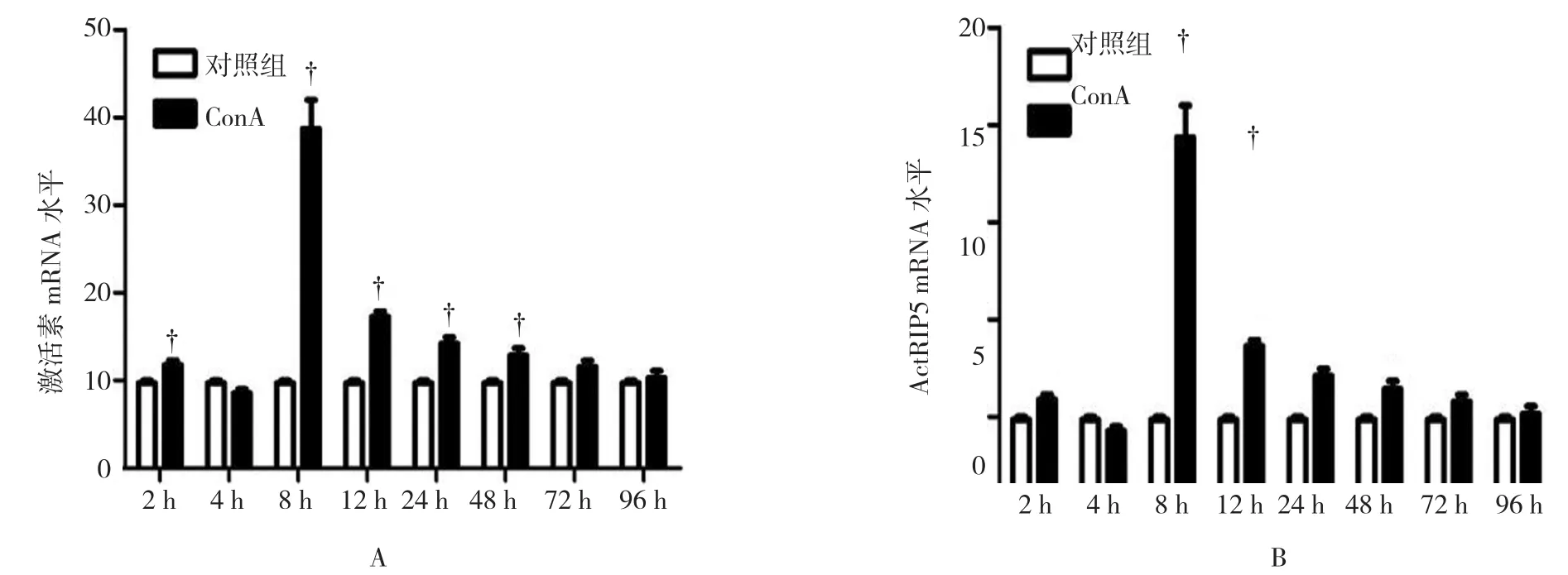
图4 Con A诱导急性肝损伤模型与对照组小鼠肝组织激活素(A)及ActRIP5 mRNA(B)水平变化
3 讨论
病毒性肝炎一直是危害人类健康的常见疾病,在我国HBsAg阳性率可高达为9.75%[12],病毒性肝炎是引起肝硬化的最常见原因,部分慢性乙肝患者最终将发展为肝癌[13-14]。ConA是一种T细胞丝裂原,由其诱导的免疫性肝损伤模型与病毒性肝炎的病理机制最为接近,被认为是研究人类病毒性肝炎及自身免疫性肝病等病理机制的理想模型[9,15]。
激活素在神经细胞分化诱导、造血细胞增殖和分化、内分泌中枢垂体性激素分泌调节等多方面发挥重要作用,同时激活素还是组织修复、再生和分化的重要调节因子,基于激活素的这些生物学活性,研究人员对激活素及其信号传导在慢性肝损伤及肝纤维的形成过程中的作用做了较多的研究,近年来研究发现在慢性肝炎、肝纤维化、肝癌及肝功能衰竭等疾病发生发展过程中均有激活素表达异常,研究表明激活素与肝纤维化形成密切相关,可由肝实质细胞自分泌或旁分泌、抑制肝细胞再生、诱导肝细胞凋亡、促进HSC合成和分泌ECM,阻断激活素在肝脏的信号传导途径可以抑制肝纤维化的形成[4-6]。
ConA为T淋巴细胞的多克隆刺激剂,能引起特异性的肝损伤,其诱导肝损伤的机制与T淋巴细胞、巨噬细胞活化及相关细胞因子的产生有重要联系,ConA诱导的急性肝损伤,起病急损伤可逆,数小时即有明显的病理改变。有文献报道[16]观察脂多糖造模诱导的急性肝损伤模型的肝组织中JNK信号通路可诱导肝损伤,而有关激活素及其信号传导在ConA诱导的急性肝损伤过程中的作用研究较少,未见有相关的文献报导。
研究表明Smads蛋白家族分布在激活素与TGF作用的所有靶细胞中,从Smads信号蛋白的角度,无法明确阐述激活素作用的组织学特异性。而ActRII受体活性的调控,可能是决定激活素作用组织学特异性的关键。ActRIPs是最近发现的一组信号传导调控蛋白[17],作为Smad上游信号调控蛋白可特异结合激活素Ⅱ型受体,影响激活素诱导的细胞内信号传导。ActRIPs主要的特点在于其存在组织分布以及生物学活性的差异,可能是决定激活素组织学作用特异性的关键分子[18]。研究发现AcRIP5可通过与激活素Ⅱ型受体作用,促进激活素的细胞内信号传导,在肝细胞内高表达,激活素受体相互作用蛋白拥有组织特异性,ActRIP 1、3、4在肝细胞不表达。因此,ActRIP5是促进激活素发挥生物学功能,介导激活素在肝损伤发挥作用的关键分子。本实验选用C57BL/6小鼠尾静脉注射ConA(15 mg/Kg),分别于给药后2、4、8、12、24、48、72、96 h分批次通过血清酶学改变、肝脏脾脏形态及指数变化、及肝脏组织病理学改变判断肝损伤进展情况,应用qRT-PCR方法分析激活素及ActRIP 5的表达变化,结果显示肝损伤在ConA给药4 h出现,24 h达高峰,后逐渐恢复。激活素及ActRIP5 mRNA的表达水平呈平行变化趋势,两者均在ConA给药后8 h出现突现1个高峰表达,然后表达逐渐下降,但在24 h内仍高于正常对照组呈现高水平表达。激活素mRNA的表达在96 h降至正常水平,而ActRIP5 mRNA水平于48 h将至正常水平。虽然激活素及ActRIP5的表达变化,未与病理损伤一致,其表达峰值位于给药后8 h早于病理损伤的高峰24 h出现,但激活素及ActRIP5的异常高表达集中于肝损伤进展期,两者表达下降直至恢复正常则体现在损伤恢复期。
由此可见激活素及其在肝脏的特异信号传导可能参与了ConA诱导的急性肝损伤进程,但有关激活素及其肝内特异信号传导蛋白ConA诱导的急性免疫性肝损伤中的确切作用及其机制,有待进一步探讨。
[1]WADA W,KUWANO H,HASEGAWA Y,et al.The dependence of TGF-β-induced collagen production on autocrine factor activin A in hepatic stellate cells[J].Endocrinology,2004,145(6): 2753-2759.
[2]WERNER S,ALZHEIMER C.Roles of activin in tissuere Pair,ifbrosis,and inflamatory disease[J].Cytokine Groth Factor Rev,2006,17: 157-171.
[3]郑晨宏,谢晓华.刀豆蛋白A诱导肝损伤模型中免疫细胞及因子研究进展[J].解放军医学院学报,2016,37(2): 191-192.
[4]VOUMVOURAKI A,NOTAS G,KOULENTAKI M,et al.Increased serum activin-A differentiates alcoholic from cirrhosis of other aetiologies[J].Eur J Clin Invest,2012,42(8): 815-822.
[5]YNDESTAD A,HAUKELAND J W,DAHL T B,et al.Activin A in nonalcoholic fatty liver disease[J].Vitam Horm,2011,85: 323-342.
[6]DELI A,KREIDL E,SANTIFALLER S,et al.Activins and activin antagonists in hepatocellular carcinoma[J].World J Gastroenterol,2008,14(11): 1699-1709.
[7]黎旸,李瑾翡,蒋忠军,等.CCl4致小鼠急性肝损伤模型的研究[J].热带医学杂志,2010,10(6): 657-659.
[8]张红军,柳忠辉,马迪,等.激活素A及其ⅡA型受体在小鼠肝损伤模型肝组织中的表达[J].吉林大学学报,2008,34(3):393-396.
[9]任玲玲,孙淑杰.刀豆蛋白1与四氯化碳诱导的小鼠急性肝损伤病理特[J].临床与实验医学杂志,2016,15(16): 1553-1554.
[10]胡梅琮,邹玲莉,黄保军,等.胞外ATP在小鼠急性肝损伤中的表达及意义[J].检验医学,2014,29(8): 838-840.
[11]肖欢,潘卫民,孙雯,等.可溶性mB7-H4对ConA诱导小鼠肝损伤的保护作用[J].吉林大学学报(医学版),2016,42(1):36-39.
[12]刘伟平,易琴,殷明刚.ALT和HBV DNA联合诊断e抗阴性的慢性活动性乙型肝炎诊断界值的建立及评价[J].检验医学,2014,29(5): 483-487.
[13]葛均波,徐永健.内科学(第8版)[M].北京: 人民卫生出版社,2013: 419-427.
[14]YANG F,WANG Q,BIAN Z,et al.Autoimmune hepatitis: East meets West[J].J Gastroenterol Hepatol,2015,30(8): 1230-1236.
[15]KREMER M,PERRY A W,MILTON R I,et al.Pivotal role of Smad3 in a mouse model of T cell 2 mediated hepatitis[J].Hepatology,2008,47(1): 113-126.
[16]覃春美,苏松,魏晓,等.JNK信号通路在脂多糖诱导的小鼠急性肝损伤中的表达研究[J].中国现代医学杂志,2015,25(20): 7-9.
[17]KARIYAWASAM H H,PEGORIER S,BARKANS J,et al.Activin and transforming growth factor-beta signaling pathways are activated after allergen challenge in mild asthma[J].J Allergy Clin Immunol,2009,124: 454-462.
[18]LIU H Y,CHEN F F,GE J Y,et al.Expression and localization of activin receptor-interacting protein 2 in mouse tissues[J].Gen Comp Endocrinol,2009,161(2): 276-282.
