2型糖尿病小鼠不同时间点的病理生理变化*
2018-03-08齐艳萍田孝祥刘丹吴鹏闫承慧韩雅玲
齐艳萍,田孝祥,刘丹,吴鹏,闫承慧,韩雅玲
(1.锦州医科大学 研究生院,辽宁 锦州 121001;2.沈阳军区总医院 心内科,辽宁 沈阳 110016)
糖尿病(diabetes mellitus,DM)是由胰岛β细胞分泌障碍或者胰岛素抵抗引起的代谢性疾病,主要分为1型和2型,其中2型糖尿病(T2DM)常见[1]。流行病学调查结果显示,2016年我国T2DM患者已有1.1亿,还有5亿以上成年人处于糖尿病前期,位居世界首位。T2DM病理改变主要是胰岛素抵抗及胰岛素分泌不足[2],而高脂饮食和肥胖是引起胰岛素抵抗的主要诱因[3]。本研究采用高脂饮食联合链脲佐菌素(Streptozocin,STZ)方法复制动物模型用来模拟人类T2DM病理改变[4]。既往研究中[5],虽采用高脂饮食联合STZ诱导来复制T2DM动物模型,但是没有对动物模型进行连续动态检测。本研究在STZ注射的不同时间点,对代谢指标及心功能等指标进行连续动态检测,明确了各种病理改变发生的具体时间,为T2DM干预治疗提供理论依据。
1 材料与方法
1.1 主要试剂及仪器
STZ(货号:S0130)、柠檬酸(货号 :791725)、柠檬酸钠(货号:S4641)购买于美国Sigma公司。柠檬酸2.1 g,溶于100 ml蒸馏水中配成A液,柠檬酸钠2.94 g溶于100 ml蒸馏水中配成B液,将A、B液按1∶1比例配成100 ml柠檬酸缓冲液,pH≈4.5。高脂鼠粮购于美国Research diets Ins公司,血糖仪和罗氏卓越血糖试纸购于罗氏中国公司,胰岛素ELISA试剂盒购买于英国Abcam公司,Masson染色试剂盒购于美国Sigma公司。苏木素、伊红染液、盐酸乙醇分化液、二甲苯、浓度梯度酒精,小动物超声机器、麻醉机、电子秤等由沈阳军区总医院心血管研究所提供。
1.2 实验方法
1.2.1 实验动物 SPF级雄性C57BL/6小鼠,8周龄,75只,体重(28.89±0.86)g,购买于北京维通利华公司。饲养于实验动物室[实验动物室注册批文号:SYXK(军)2012-0003],温度、湿度适宜。小鼠自由摄食,饮水,12 h昼夜交替光照。
1.2.2 复制T2DM动物模型 随机将C57BL/6小鼠分为3组,分别为正常饮食对照组(normal diet,ND)、高脂饮食对照组(high fat,HF)、HF+STZ组。每组25只,每组小鼠体重平均28.89 g,空腹血糖平均8.5 mmol/L。HF+STZ组和HF组小鼠高脂鼠粮(脂含量60%)喂养4周。4周后,实验组小鼠给予STZ(25 mg/kg)腹腔注射,连续注射4 d,对照组小鼠腹腔注射等体积的柠檬酸缓冲液[2]。
1.2.3 血糖检测 复制模型前(-4周)、STZ注射时(0周)、STZ注射后不同时间点(1、2、3、4、6、8及12周)检测小鼠空腹血糖。上午9时禁食,禁食4 h后麻醉,尾静脉采血检测空腹血糖。
1.2.4 糖耐量和胰岛素耐量测定 葡萄糖耐量测定:小鼠禁食4 h,以2 g/kg剂量向小鼠腹腔注射总体积0.1 ml的葡萄糖水溶液,测定注射后15、30、60及120 min鼠尾静脉血的血糖水平。胰岛素耐量测定:小鼠禁食4 h,以0.75 u/kg剂量腹腔注射总体0.1 ml胰岛素溶液,在注射后的15、30、60及120 min测定空腹血糖水平。采用曲线下面积(AUC)评价各组葡萄糖耐量及胰岛素耐量改变。AUC计算公式:相邻时间点空腹血糖相加×时间间隔/2。
1.2.5 血清胰岛素测定 STZ注射后4、8及12周时,小鼠禁食4 h,麻醉,颈动脉取血,3 000 r/min离心10 min,取上清,ELISA试剂盒检测血清胰岛素含量。
1.2.6 心功能测定 在STZ注射后4、6、8及12周时,应用小动物超声检测左心室舒张功能及收缩功能。
1.2.7 心肌组织学检测 STZ注射4、8及12周,麻醉小鼠,取心脏组织,PBS冲洗,4%多聚甲醛固定,石蜡包埋,切片,苏木素-伊红染色,显微镜下观察心脏大体情况,Masson染色观察心肌纤维化程度。
1.3 统计学方法
采用SPSS22.0软件进行数据分析,计量资料采用均数±标准差(±s)表示,不同时间比较采用重复测量设计的方差分析,若方差齐则组间两两比较用LSD-t检验。所有P值均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 代谢水平比较
3组在STZ注射不同时间点体重比较,采用重复测量设计的方差分析,结果:①不同时间点的体重有差异(F=5.189,P=0.000),②3组体重有差异(F=20.279,P=0.000),HF+STZ组小鼠体重低于HF组,高于ND组,HF组小鼠体重高于ND组,③3组体重变化趋势有差异(F=5.723,P=0.000)。见图1A。
3组在STZ注射不同时间点空腹血糖比较,采用重复测量设计的方差分析,结果:①不同时间点的空腹血糖有差异(F=46.047,P=0.000),②3组空腹血糖有差异(F=14.700,P=0.000),HF+STZ组小鼠空腹血糖高于HF组及ND组,HF组小鼠空腹血糖略高于ND组,③3组空腹血糖变化趋势有差异(F=20.126,P=0.000)。见图 1B。
STZ注射2周后,HF+STZ组小鼠糖耐量出现异常,曲线下面积(AUC)高于HF组和ND组(P=0.000和0.012),HF组AUC高于ND组(P=0.038)(见图1C、1D)。同时发现,STZ注射2周后,HF+STZ组小鼠胰岛素耐量出现异常,AUC低于HF组和ND组(均P=0.000),HF组胰岛素耐量较ND组出现异常(P=0.000)(见图 1E、1F)。
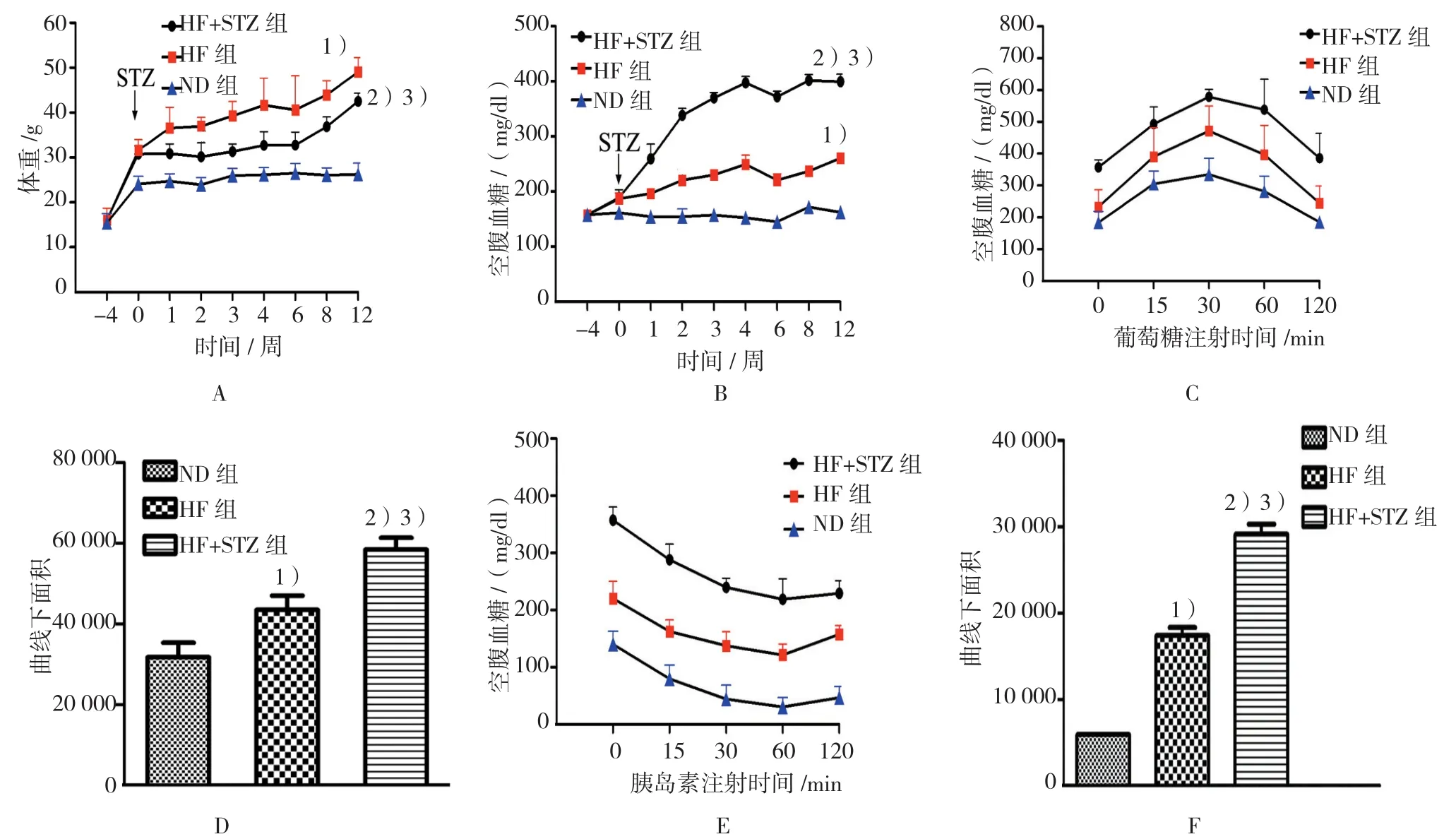
图1 STZ注射不同时间点3组小鼠体重、空腹血糖、葡萄糖耐量及胰岛素耐量比较 (n=8,±s)
2.2 血清胰岛素含量比较
STZ注射后的4、8及12周时,小鼠禁食4 h,颈动脉取血,离心,取上清,用ELISA胰岛素检测试剂盒检测血胰岛素含量。ND组、HF组与HF+STZ 3组血清胰岛素含量比较,采用重复测量设计的方差分析,结果:①不同时间点血清胰岛素无差异(F=0.680,P=0.470),②3组血清胰岛素有差异(F=46.445,P=0.006),HF+STZ组小鼠血清含量低于HF组,HF组胰岛素含量高于ND组,③3组血清胰岛素变化趋势差异无统计学意义(F=1.813,P=0.242),见图2。
2.3 心肌组织学改变
STZ注射8周时,心肌组织HE染色,发现HF+STZ组小鼠左心室室壁较HF组及ND组肥厚,心腔减小。STZ注射12周时,心肌组织Masson染色结果显示HF+STZ小鼠心脏较HF组及ND组发生纤维化改变。见图3。
2.4 左心室功能比较
STZ注射后4、6、8周,应用小动物超声检测小鼠左心室功能。3组小鼠左心室E/A,采用重复测量设计的方差分析,结果:①不同时间点3组小鼠左心室E/A有差异(F=28.888,P=0.002),②3组小鼠左心室E/A有差异(F=11.283,P=0.009),HF+STZ组小鼠左心室E/A低于HF组及ND组,HF组小鼠左心室E/A低于ND组,③3组小鼠左心室E/A变化趋势有差异(F=5.885,P=0.002)。见图 4A。
STZ注射8周后,HF+STZ组小鼠左心室E/A降低,较ND组差异有统计学意义(P=0.002),虽然低于HF组,但差异无统计学意义;STZ注射12周后,HF+STZ组左心室舒张功能障碍明显,E/A比值低于HF组和ND组(P=0.024和0.001),HF组E/A低于ND组(P=0.026),见图4A。

图2 STZ注射后不同时间点3组小鼠血清胰岛素含量 (n=8,±s)
3组小鼠左心室射血分数,采用重复测量设计的方差分析,结果:①不同时间点左心室射血分数有差异(F=52.300,P=0.000),②3组左心室射血分数有差异(F=6.171,P=0.035),HF+STZ组小鼠左心室射血分数低于HF组及ND组,HF组小鼠左心室射血分数低于ND组,③3组左心室射血分数变化趋势有差异(F=7.453,P=0.024)。见图 4B。
STZ注射12周时,HF+STZ组小鼠左心室射血分数低于HF组及ND组(P=0.038和0.001),HF组小鼠左心室射血分数低于ND组(P=0.016)。HF+STZ组及HF组小鼠在STZ注射12周时较STZ注射8周时左心室射血分数降低(t=8.657和18.041,P=0.013和0.003),上述结果提示HF+STZ组小鼠在STZ注射8周时出现左心室舒张功能障碍,12周时出现左心室收缩功能障碍。
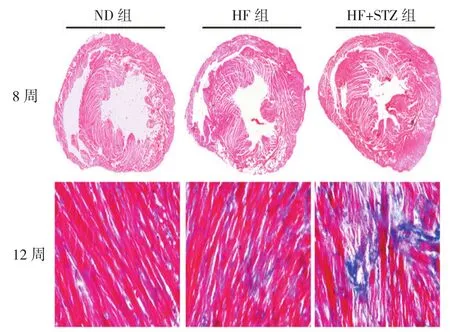
图3 STZ注射8和12周心肌组织HE和Masson染色 (n=3)

图4 STZ注射后不同时间点3组心功能情况 (n=8)
3 讨论
T2DM主要表现为胰岛素抵抗和胰岛β细胞功能障碍[6]。研究证实[7-8]高脂饮食和肥胖是引胰岛素抵抗的主要诱因。高脂可导致细胞膜上葡萄糖转运体和脂转运体分布异常,细胞膜上葡萄糖转运体减少,脂转运体增多,从而引起糖摄取障碍,导致机体内长期慢性炎症反应,使胰岛功能受损,并产生胰岛素抵抗[9]。
既往糖尿病研究中,多采用高脂饮食联合STZ方法诱导糖尿病动物模型。STZ剂量可以决定复制的糖尿病动物模型分型。一次性大剂量STZ注射,可以破坏大量胰岛β细胞,引起胰岛素分泌不足,复制1型糖尿病动物模型[10]。小剂量STZ多次注射,对胰岛β细胞的破坏作用较小,可复制T2DM动物模型[11]。为研究T2DM动物模型的病理改变,本实验采用25 mg/kg的小剂量STZ连续腹腔注射4 d方法复制T2DM动物模型。单纯高脂喂养,虽会导致胰岛素抵抗及糖耐量异常[12],但是空腹血糖仍低于糖尿病临界值16.7 mmol/L。提示单纯高脂喂养不能复制T2DM模型,因此,在小鼠高脂喂养4周时,给予腹腔注射25 mg/kg的STZ,连续注射4 d。本研究发现,在STZ注射1周后,小鼠空腹血糖增加,随着时间的延长,血糖水平逐渐增加。在STZ注射2周后,小鼠出现胰岛素抵抗及糖耐量异常。同时为充分证实模型复制是否成功,本研究还监测不同时间点各组小鼠血清胰岛素水平。结果显示,与HF组和ND组相比,HF+STZ组血清胰岛素水平下降。上述结果均提示,本研究中高脂饮食联合STZ成功复制T2DM小鼠模型。
研究发现[13-15],糖尿病小鼠氧化应激反应增加,线粒体功能障碍,心肌细胞损伤,导致心功能异常。长期高糖高脂病理刺激,可导致心肌中胶原纤维Ⅰ和胶原纤维Ⅲ堆积,纤维化通路重要因子TGF-β表达增加,引起心肌重塑,功能障碍,影响收缩功能[16]。本研究发现,与HF组和ND组比较,在STZ注射8周时,HF+STZ组小鼠左心室明显肥厚并左心室舒张障碍。在STZ注射12周时,HF+STZ组小鼠心肌出现纤维化,收缩功能明显障碍。然而,在本研究中,高脂联合STZ导致哪条信号通路异常进而导致心肌收缩功能和舒张功能出现严重障碍还尚不清楚,有待于进一步的深入研究。
本实验在STZ注射的不同时间点,连续检测T2DM病理改变,明确了各种病理改变出现的时间,提示T2DM早期主要表现为糖代谢异常及左心室舒张功能障碍,晚期出现心肌纤维化,左心室收缩功能障碍。因此,为预防T2DM引起心脏功能改变,应尽早进行干预治疗。
[1]YANG J,ZHAO P,WAN D,et al.Antidiabetic effect of methanolic extract from berberis julianae schneid.via activation of AMP-activated protein kinase in type 2 diabetic mice[J].Evid Based Complement Alternat Med,2014,2014: 106206.
[2]KERNER W,BR CKEL J.De fi nition,classi fi cation and diagnosis of diabetes mellitus[J].Exp Clin Endocrinol Diabetes,2014,122(07): 384-386.
[3]ZHAO L,FU Z,WU J,et al.In fl ammation-induced microvascular insulin resistance is an early event in diet-induced obesity[J].Clin Sci (Lond),2015,129(12): 1025-1036.
[4]ISLAM M S,WILSON R D.Experimentally induced rodent models of type 2 diabetes[J].MethodsMol Biol,2012,933: 161-174.
[5]LIU X Y,LIU F C,DENG C Y,et al.Left ventricular deformation associated with cardiomyocyte Ca(2+) transients delay in early stage of low-dose of STZ and high-fat diet induced type 2 diabetic rats[J].BMC Cardiovasc Disord,2016,16(1): 41.
[6]KIM C H,KIM H K,KIM E H,et al.Relative contributions of insulin resistance and beta-cell dysfunction to the development of type 2 diabetes in Koreans[J].Diabet Med,2013,30(9): 1075-1079.
[7]SHIRAI T,SHICHI Y,SATO M,et al.High dietary fat-induced obesity in Wistar rats and type 2 diabetes in nonobese Goto-Kakizaki rats differentially affect retinol binding protein 4 expression and vitamin A metabolism[J].Nutr Res,2016,36(3): 262-270.
[8]DAVID M A,JONES K H,INZANA J A,et al.Tendon repair is compromised in a high fat diet-induced mouse model of obesity and type 2 diabetes[J].PLoS One,2014,9(3): e91234.
[9]CHEN Y P,TSAI C W,SHEN C Y,et al.Palmitic acid interferes with energy metabolism balance by adversely switching the SIRT1-CD36-fatty acid pathway to the PKC zeta-GLUT4-glucose pathway in cardiomyoblasts[J].J Nutr Biochem,2016,31: 137-149.
[10]SAKATA N,YOSHIMATSU G,TSUCHIYA H,et al.Animal models of diabetes mellitus for islet transplantation[J].Exp Diabetes Res,2012,2012: 256707.
[11]MANSOR L S,GONZALEZ E R,COLE M A,et al.Cardiac metabolism in a new rat model of type 2 diabetes using high-fat diet with low dose streptozotocin[J].Cardiovasc Diabetol,2013,12: 136.
[12]DU J,FAN L M,MAI A,et al.Crucial roles of Nox2-derived oxidative stress in deteriorating the function of insulin receptors and endothelium in dietary obesity of middle-aged mice[J].Br J Pharmacol,2013,170(5): 1064-1077.
[13]NOWOTNY K,JUNG T,HOHN A,et al.Advanced glycation end products and oxidative stress in type 2 diabetes mellitus[J].Biomolecules,2015,5(1): 194-222.
[14]REICHELT M E,MELLOR K M,CURL C L,et al.Myocardial glycophagy - a speci fi c glycogen handling response to metabolic stress is accentuated in the female heart[J].J Mol Cell Cardiol,2013,65: 67-75.
[15]YILMAZ S,CANPOLAT U,AYDOGDU S,et al.Diabetic cardiomyopathy; summary of 41 years[J].Korean Circ J,2015,45(4): 266-272.
[16]LI S,HONG Y,JIN X,et al.A new agkistrodon halys venompurified protein C activator prevents myocardial fibrosis in diabetic rats[J].Croatian Medical Journal,2015,56(5): 439-446.
