大鼠肺纤维化和活性维生素D3干预后P32和PKD1的表达及作用研究
2018-03-08倪娜刘乃国高海洋郑静董洪亮王楠
倪娜,刘乃国,高海洋,郑静,董洪亮,王楠
(滨州医学院附属医院 1.临床医学实验室,2.急诊EICU,山东 滨州 256603)
特发性肺间质纤维化(idiopathic pulmonary interstitial fibrosis,IPIF)是一种以弥漫性肺泡炎和成纤维细胞病理性增生,最终导致肺间质纤维化为特征的疾病[1]。目前病因不明,病程进展缓慢。近年来通过大量的临床观察和实验发现氧化/抗氧化失衡,在IPIF的发生和发展中起着重要的作用。TEIXEIRA[2]研究发现在博来霉素诱导的大鼠肺纤维化模型中,给予抗氧化药物N-乙酰半胱氨酸治疗可以减轻肺纤维化程度。
PATRICK等[3]研究发现活性维生素D3(VD3)具有抗氧化作用,在氧自由基诱导的生物损伤中,可以保护细胞免受活性氧增加和氧化应激引起的细胞死亡。氧化应激会导致丝/苏氨酸激酶蛋白激酶D1(protein kinase d1,PKD1)及其所调控的PKD1/MnSOD线粒体抗氧化信号通路相关分子表达升高,进而保护细胞器和细胞免受线粒体氧化应激带来的损伤和细胞死亡[4-5]。透明质酸结合蛋白(P32),是一个分子量为32 kD的多功能蛋白[6]。STORZ[7]报道,P32可以与PKD1结合并对PKD1在线粒体中的定位和功能具有调节作用。P32在肺纤维化中的作用未见报道。本研究旨在探讨P32蛋白和PKD1在肺纤维化发生中的表达及其相互作用,以及活性VD3在肺纤维化发生发展中是否通过P32蛋白和PKD1相关信号通路来发挥作用。
1 材料与方法
1.1 材料与试剂
雄性SD大鼠,购自鲁抗医药实验动物中心,体重180~200 g[许可证号:SCXK(鲁)20130001]。
活性VD3[1,25(OH)2VD3](美国Sigma公司,批号:#074M4028V),博来霉素(日本化药株式会社,15 mg/瓶,批号:030201),羟脯氨酸(hydroxyproline,HYP)检测试剂盒(南京建成生物工程研究所),DNA/RNA/蛋白质提取试剂盒(美国OMEGA公司,R6734-01),HiFiScript快速去基因组cDNA第一链合成试剂盒(北京康为世纪公司,CW2582-100),实时定量试剂盒(瑞士罗氏公司,06924204001),内参基因GAPDH引物购自上海生物工程技术有限公司(B661204),PCR引物由上海生物工程技术有限公司设计合成,P32(1∶75,sc-23885)单克隆抗体(美国Santa Cruz公司),PKC mu(phosphor Y463)(1 ∶ 250,ab59415)多克隆抗体(英国Abcam公司),超敏二步法免疫组织化学检测试剂(PV-9001/2)、DAB试剂盒(ZLI-9019)(中杉金桥公司)。
1.2 仪器与设备
Eppendorf梯度PCR仪(德国艾本德股份公司,mastercycler 5333),实时定量PCR仪(美国Bio-Rad伯乐公司,CFX96),GeneQuant紫外分光光度计(美国通用电气公司,GE1300),奥林巴斯显微照相系统(日本奥林巴斯株式会社,BX51),凝胶成像分析系统(北京六一公司,WD9413C)。
1.3 方法
1.3.1 动物分组与处理 将90只雄性SD大鼠随机分为3个组,对照组、模型组和治疗组。模型组气管暴露后一次性注射博来霉素(5 mg/kg)[8],并于术后第2天腹腔注射VD3溶剂(99.9%丙二醇和0.1%乙醇,1μl/g);治疗组同模型组一样复制肺纤维化模型,于手术后第2天腹腔注射活性VD3(2μg/kg)[9];对照组暴露气管后注射灭菌生理盐水(500μl/kg),并于术后第2天腹腔注射生理盐水(1μl/g),各组均注射1次/2 d。各组动物分别在术后第14、21、28天处死取材,每个时间点10只大鼠。
1.3.2 HYP的含量测定 将肺组织在液氮中捣成粉末,按100 mg粉末加入1 ml生理盐水的比例制备组织匀浆,用碱水解法按说明书测定肺组织HYP浓度。
1.3.3 实时聚合酶链反应(real-time PCR)检测肺组织中PKD1和P32 mRNA表达 按照试剂盒说明书提取大鼠的总RNA,并进行逆转录。以GAPDH作为内参基因,用实时聚合酶链反应(real-time polymerase chain reaction,real-time PCR)检测各组大鼠肺组织中P32和PKD1 mRNA的表达,用2-△△Ct法进行相对定量。反应体系为20μl。扩增反应条件:95℃ 10 min;变性95℃ 15 s、退火60℃ 20 s、延伸72℃ 10 s,39个循环。引物见表1,扩增曲线及熔解曲线见图1。
1.3.4 免疫组织化学法检测肺组织中P32和PKD1蛋白表达水平 取各组肺组织,经多聚甲醛固定、脱水、透明处理后,进行石蜡包埋。切片厚度为4μm,常规脱蜡至水,抗原修复,去除内源性过氧化酶,37℃封闭30 min。滴加一抗,37℃孵育2 h,洗涤。按照试剂盒说明书滴加相应二抗,洗涤。DAB显色,洗涤,苏木素复染。酒精梯度脱水,二甲苯透明,中性树胶封片,光镜下进行组织观察分析。以细胞内出现明显的棕黄色颗粒或斑块为阳性表达。
1.3.5 图像分析 每例标本每个指标选取3~5个无重叠的阳性表达视野(×200),利用Motic Med 6.0彩色医学图文分析系统进行图像分析,测定各目的蛋白阳性目标的平均光密度值,量化实验结果,从而对目标蛋白表达进行半定量分析。

表1 引物序列
1.4 统计学方法
本研究所得实验数据均采用SPSS16.0软件处理,采用均数±标准差(±s)表示,采用重复测量设计的方差分析及单因素方差分析,两两比较采用LSD-t检验,相关性分析采用Spearman法,P<0.05为差异有统计学意义。
图1 基因P32、PKD1及GAPDH的扩增及熔解曲线
2 结果
2.1 HYP含量
3组HYP在不同时间点上的含量进行重复测量设计的方差分析,结果显示,不同组别之间HYP含量有差别(F=234.23,P=0.000),不同时间点HYP含量之间有差别(F=9.912,P=0.003),变化趋势有差别(F=2.935,P=0.042)。见表2和图2。
3组在不同时间点的HYP含量采用LSD-t检验进行两两比较,结果显示,模型组和治疗组在各时间点的HYP含量均比其相应时间点对照组的HYP含量升高(P<0.05);治疗组在各时间点的HYP含量与相应时间点的模型组相比都降低(P<0.05)。见表2。
2.2 P32和PKD1 mRNA表达
对照组、模型组和治疗组在不同时间点的P32和PKD1 mRNA表达量进行单因素方差分析,两两比较采用LSD-t检测,结果显示,第14天,这2种细胞因子在模型组和治疗组中的表达与对照组比较均降低,而治疗组中的表达高于模型组中的表达,差异均有统计学意义(P<0.05)。第21天,模型组和治疗组中这两种细胞因子的表达与对照组比较均升高,治疗组中P32 mRNA的表达量比模型组中升高,差异均有统计学意义(P<0.05),而PKD1 mRNA的表达量在治疗组和模型组中差异无统计学意义(P>0.05)。第28天,这2种细胞因子的表达在模型组和治疗组高于对照组,差异有统计学意义(P<0.05),而治疗组中的表达虽然高于模型组,但差异无统计学意义(P>0.05)。(见表3)。相关性分析发现,P32和PKD1的mRNA表达量之间具有相关性(r=0.861,P<0.05)。
表2 不同时间点3组大鼠肺组织中HYP的含量比较 (n=10,±s,μg/g)

表2 不同时间点3组大鼠肺组织中HYP的含量比较 (n=10,±s,μg/g)
注:1)与对照组比较,P<0.05;2)与模型组比较,P<0.05
组别 第14天 第21天 第28天对照组 481±102 452±127 475±129模型组 832±1371) 1 025±741) 1 182±751)治疗组 650±701)2) 820±1281)2) 858±851)2)

图2 各组在不同时间点HYP含量变化
2.3 P32和PKD1的免疫组织化学实验结果
免疫组织化学实验结果显示,细胞因子PKD1和P32在各组肺组织中的表达分布一致,都是主要在肺泡上皮细胞、肺泡巨噬细胞、支气管上皮细胞、纤维化肺泡隔中表达较高,在成纤维细胞和肌成纤维细胞中无明显表达。见图3。
实验第14、21、28天,对检测的2个基因的蛋白表达量,进行重复测量设计的方差分析,结果显示,不同时间点之间P32和PKD1的蛋白表达量有差别(F=18.826和45.047,均P=0.000);不同组之间P32和PKD1的蛋白表达量有差别(F=4.002和8.532,P=0.049和0.006);变化趋势有差别(F=4.440和4.970,P=0.009 和 0.005),见图4、5。
表3 P32 和 PKD1 mRNA 表达水平比较 (2-ΔΔCT,n=10,±s)
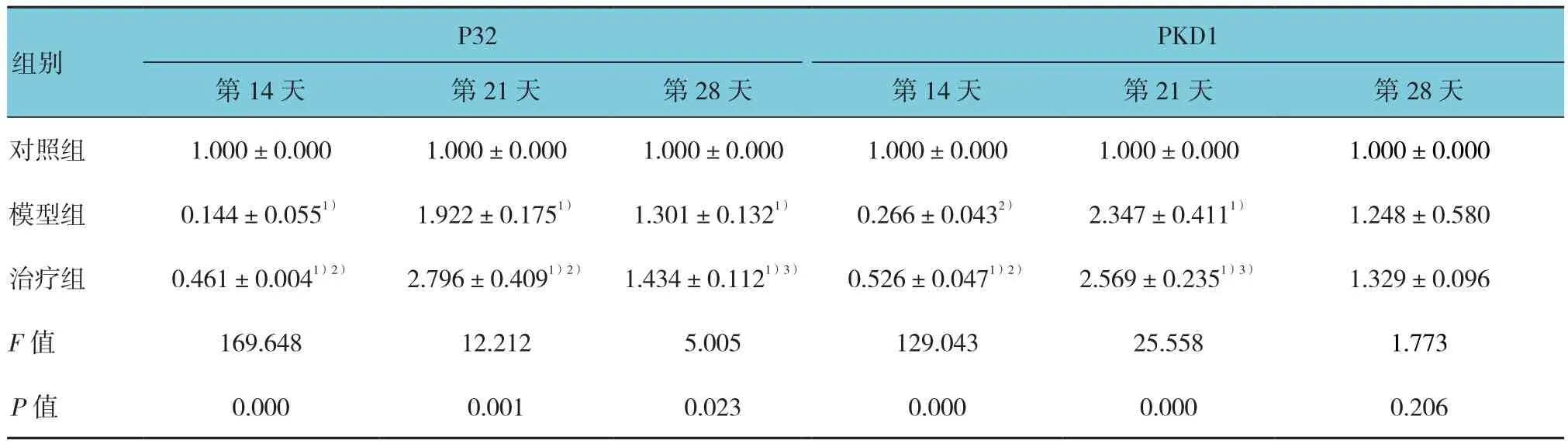
表3 P32 和 PKD1 mRNA 表达水平比较 (2-ΔΔCT,n=10,±s)
注:1)与对照组比较,P<0.05;2)与模型组比较,P<0.05;3)与模型组比较,P>0.05
PKD1第14天 第21天 第28天 第14天 第21天 第28天对照组 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000模型组 0.144±0.0551) 1.922±0.1751) 1.301±0.1321) 0.266±0.0432) 2.347±0.4111) 1.248±0.580治疗组 0.461±0.0041)2) 2.796±0.4091)2) 1.434±0.1121)3) 0.526±0.0471)2) 2.569±0.2351)3) 1.329±0.096 F值 169.648 12.212 5.005 129.043 25.558 1.773 P值 0.000 0.001 0.023 0.000 0.000 0.206 P32组别
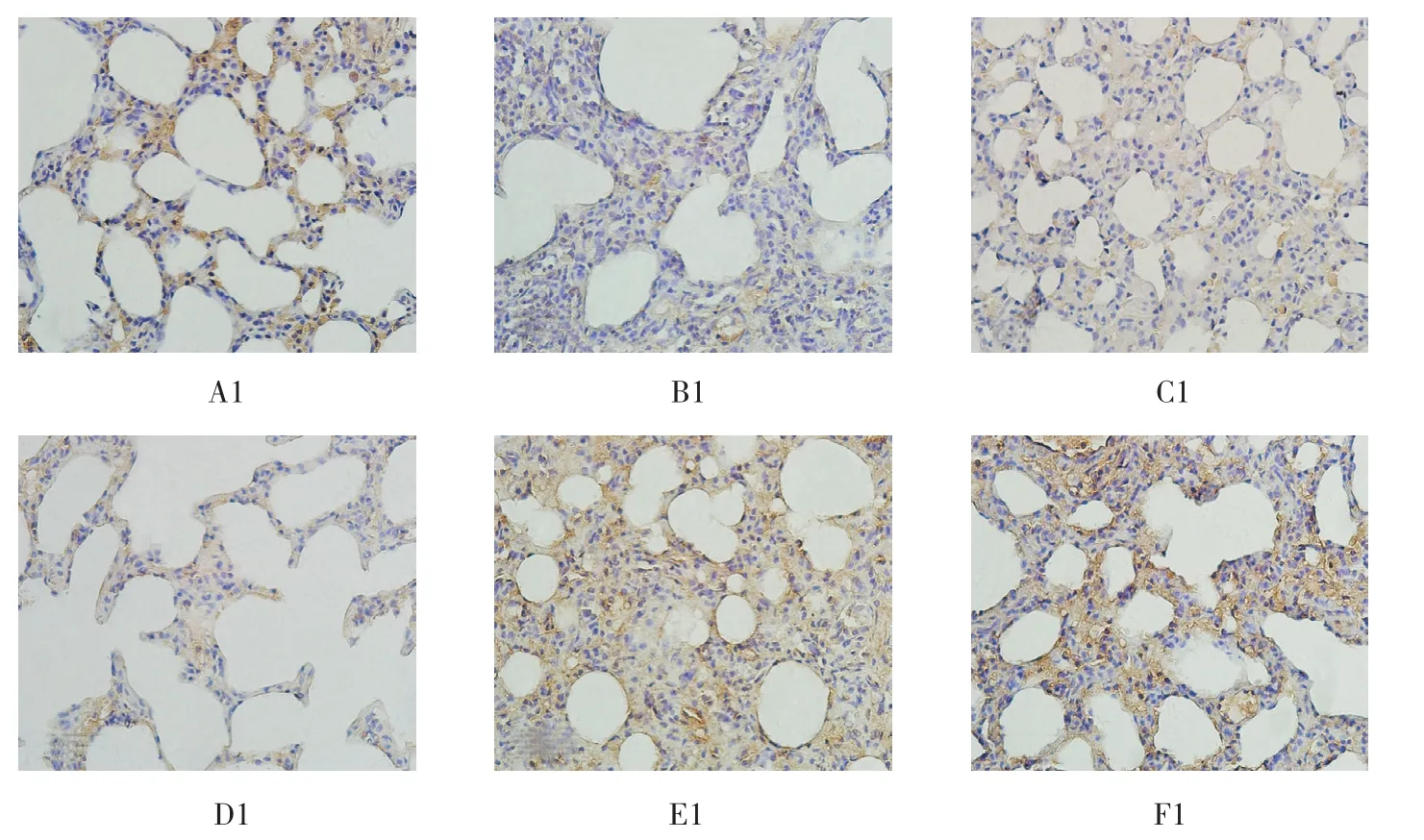
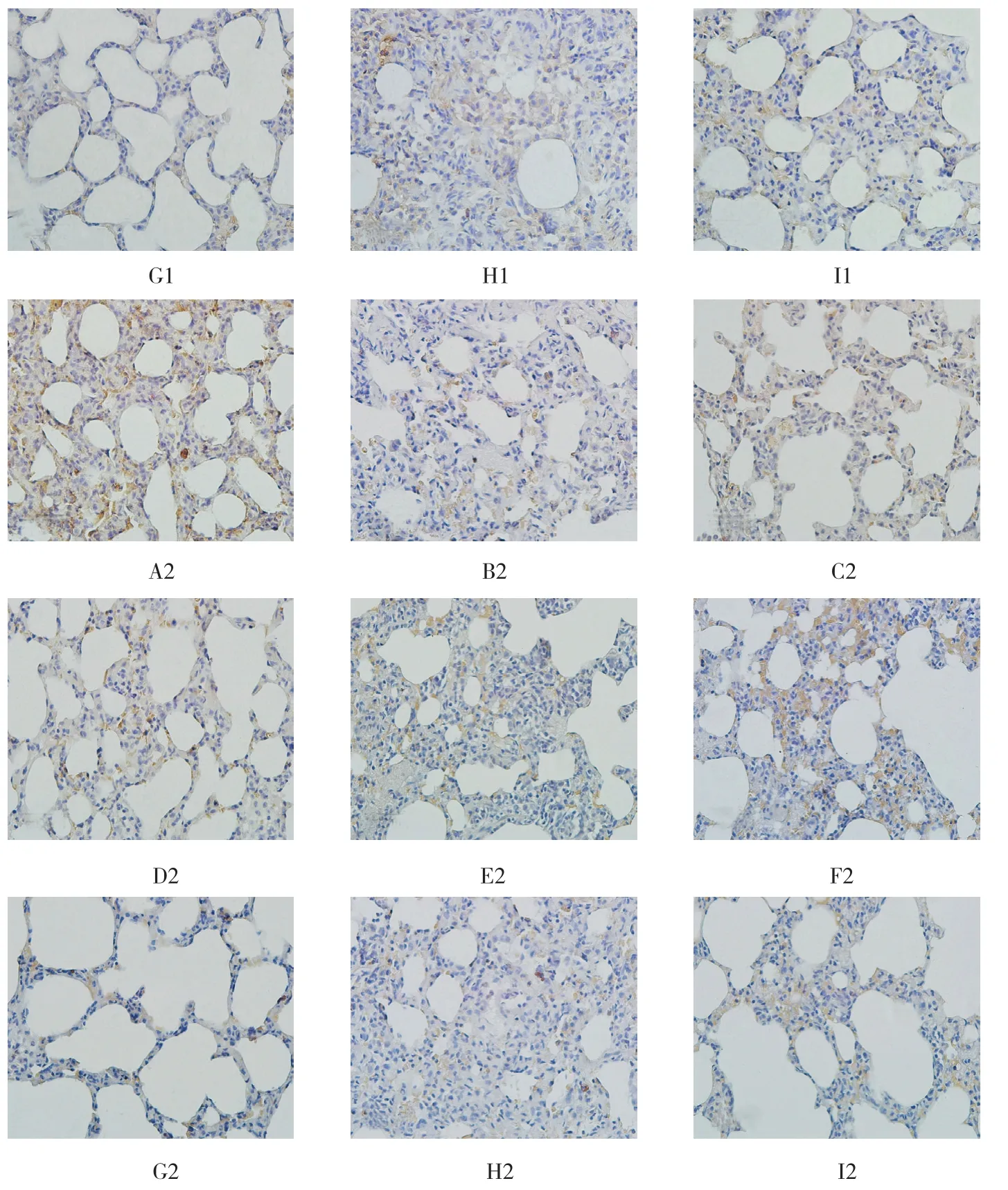
图3 P32(A1~I1)和PKD1(A2~I2)在大鼠肺组织中的表达 (DAB显色,200μm)

图4 各组不同时间点P32蛋白表达量变化
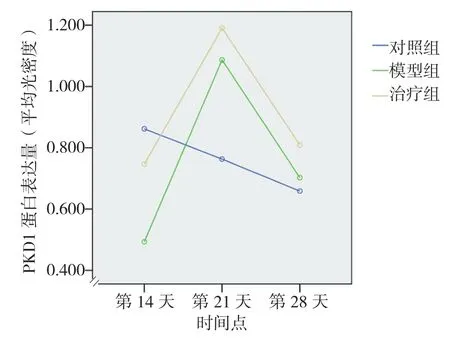
图5 各组不同时间点PKD1蛋白表达量变化
各组在不同时间点的P32和PKD1 蛋白表达量比较,采用LSD-t法,结果显示,第14天,2种细胞因子在模型组和治疗组中的蛋白表达量均比对照组降低,治疗组的蛋白表达均比模型组升高,差异有统计学意义(P<0.05)。第21天,模型组和治疗组中这2种细胞因子的蛋白表达量与对照组比较均升高,差异有统计学意义(P<0.05);治疗组中这2种细胞因子的蛋白表达量虽然高于模型组,但是差异无统计学意义(P>0.05)。第28天,这2种细胞因子的蛋白表达,治疗组均高于对照组,差异有统计学意义(P<0.05),但是模型组与对照组比较差异无统计学意义(P>0.05),治疗组中这2种细胞因子的蛋白表达量虽然略高于模型组,但是差异无统计学意义(P>0.05)(见表4)。2种细胞因子蛋白表达的总体趋势与mRNA表达情况基本一致。相关性分析发现,P32和PKD1的蛋白表达量之间具有相关性(r=0.859,P<0.05)。
表4 P32和PKD1的蛋白表达情况 (平均光密度,n=10,±s)

表4 P32和PKD1的蛋白表达情况 (平均光密度,n=10,±s)
注:1)与对照组比较,P<0.05;2)与对照组比较,P>0.05;3)与模型组比较,P<0.05;4)与模型组比较,P>0.05
P32组别PKD1第14天 第21天 第28天 第14天 第21天 第28天对照组 0.955±0.040 0.812±0.039 0.783±0.048 0.836±0.038 0.763±0.026 0.659±0.039模型组 0.591±0.0261) 1.086±0.0171) 0.824±0.0502) 0.493±0.0361) 1.087±0.0281) 0.722±0.0382)治疗组 0.801±0.0441)3) 1.156±0.1311)4) 0.946±0.0231)4) 0.701±0.0341)3) 1.191±0.0791)4) 0.808±0.0221)4)
3 讨论
HYP含量检测是评价肺纤维化程度的金标准。本研究结果显示各组肺组织HYP含量,在不同时间点模型组均高于对照组,且随建模时间延长而逐渐增高;治疗组均低于相应时间点的模型组。这说明本研究选用气管内注射博来霉素的方法成功复制了大鼠肺纤维化模型,活性VD3对肺纤维化的发生、发展有一定的缓解作用。
PKD1是一种丝/苏氨酸蛋白激酶,PKD1被证实是一种线粒体氧化压力感受器及抗氧化酶表达的调节器[10]。PKD1可以把线粒体中ROS水平升高的信号从线粒体传递到细胞核,诱导线粒体体内MnSOD的表达以保护细胞器和细胞免受氧化应激介导的损伤和细胞死亡[4,10-11]。有文献报道[12],PKD1 能被氧自由基调节,低浓度的氧化剂使酶活化,而高浓度的氧化剂则使酶灭活。本研究结果显示,在纤维发生早期(第14天),模型组和治疗组中PKD1细胞因子无论从转录水平还是从蛋白质水平,其表达均比其在对照组中降低。这可能是在肺纤维化早期,博来霉素在体内活化产生大量的活性氧,抑制了PKD1的表达。然而第14天治疗组中2种细胞因子的表达量又高于模型组,说明活性VD3能够上调PKD1的表达,提高PKD1抗氧化的能力,保护线粒体免受活性氧的损害。
在第21天,模型组和治疗组中PKD1的mRNA和蛋白表达均高于第14天的表达,这可能是随着疾
病发展,活性氧水平下降,解除了对PKD1的抑制作用,导致PKD1被激活上调;治疗组中PKD1的表达量虽然略高于模型组,但差异无统计学意义,说明活性VD3在第21天时对PKD1表达的上调作用并不明显。第28天,模型组、治疗组中PKD1的表达量与其相应的第21天时的表达量相比,均降低,而治疗组中的表达量虽然略高于模型组,但差异无统计学意义。这可能是28 d时氧化/抗氧化趋于平衡,线粒体氧化应激减弱,PKD1介导的抗氧化作用减弱。提示线粒体氧化应激及PKD1介导的抗氧化通路可能在大鼠肺纤维化前期(21天前)发挥重要作用。活性VD3在肺纤维化早期(21天前)能够促进PKD1及其介导的抗氧化通路相关分子的表达,具有一定的抗氧化作用。
P32蛋白是一个分子量为32KD的多功能酸性蛋白,以环形三聚体的形态主要存在于细胞的线粒体基质中[13]。P32蛋白可以与蛋白激酶C(PKC)的所有亚型相结合并增强PKC的活性,可能是PKC定位和功能的调节因子[7]。PKCδ为PKC家族的一个亚型,是PKD1的一种上游激酶,P32可以与PKCδ紧密结合,进而调控PKD1参与许多重要的细胞内信号转导通路[14-15]。STORZ等[7]在B细胞系SKW6.4中证实了P32能够与PKD1在线粒体膜上结合。本研究发现,在博来霉素诱导的大鼠肺纤维化过程中,P32 mRNA和蛋白的表达总体趋势与PKD1相似。在第14天时,无论mRNA水平还是蛋白水平,治疗组的表达量均高于模型组。第21天,mRNA水平治疗组的表达量高于模型组,差异有统计学意义,蛋白水平治疗组的表达量虽然高于模型组,但差异无统计学意义。第28天,治疗组和模型组之间mRNA和蛋白水平表达量差异无统计学意义。相关性分析发现,无论是mRNA还是蛋白水平,P32和PKD1的表达均具有相关性,且免疫组织化学结果显示两者的表达分布一致,说明P32可能与PKD1在线粒体内结合,PKD1被线粒体氧化应激激活,通过调节PKD1介导的线粒体-核抗氧化通路来缓解线粒体的氧化压力。本研究表明活性VD3在早期(14天)可以增加P32和PKD1的表达量,说明活性VD3可能在肺纤维化早期促进P32和PKD1的表达,通过P32和PKD1相互作用来实现抗氧化作用,进而影响肺纤维化的发生发展。
[1]钟长军.氧化应激在特发性肺纤维化中的作用及其机制研究进展[J].安徽医学,2012,33(2): 245-247.
[2]TEIXEIRA K C.Attenuation of bleomycin-induced lung injury and oxidative stress by N-acetylcysteine plus deferoxamine[J].Pulm Pharmacol Ther,2008,21(2) : 309-316.
[3]PATRICK B K,CHRISTINE M,VICTORIA E K,et al.Antioxidants and doxorubicin supplementation to modulate CD14 expression and oxidative stress induced by vitamin D3 and seocalcitol in HL60 cells[J].Oncology Reports,2007,18: 1513-1519.
[4]PETER S.Mitochondrial ROS - radical detoxi fi cation,mediated by protein kinase D[J].Trends in Cell Biology,2006,17(1): 13-18.
[5]PETER S,HEIKE D,ALEX T.Protein kinase D mediates detoxification from mitochondrial reactive mitochondrion-tonucleus signaling and oxygen species[J].Mol.Cell.Biol,2005,25(19): 8520-8530.
[6]SOLTYS B J,KANG D,GUPTA R S.Localization of P32 protein in mitochondria and at specific extramitochondrial locations in normal tissues[J].Histochem Cell Biol,2000,114(3): 245-255.
[7]STORZ P.Protein kinase C[micro]is regulated by the multifunctional chaperon protein p32[J].J Biol Chem,2000,275(32): 24601-24607.
[8]李月红,张春来,王艳,等.骨髓间充质干细胞对肺纤维化大鼠肺组织中Thl/Th2平衡的调节作用[J].解剖学杂志,2014,37(1): 10-14.
[9]张宗梅,顾盼,易祥华,等.骨化三醇对博来霉素诱导的小鼠肺纤维化的影响[J].中华结核和呼吸病杂志,2013,36(11): 814-820.
[10]CATHERINE F,COWELL,HEIKE D,et al.Mitochondrial diacylglycerol initiates protein-kinase-D1-mediated ROS signaling[J].Journal of Cell Science,2009,122(7): 919-927.
[11]SUKHDEV S,JOEL N,CARL D,et al.Bortner Mitochondrial DNA-depleted A549 cells are resistant to bleomycin[J].Am J Physiol Lung Cell Mol Physiol,2012,303: L413-L424.
[12]ZHANG T Z,PHILIP S,URSULA B,et al.PKD1 protein is involved in reactive oxygen species-mediated mitochondrial depolarization in cooperation with protein kinase C δ (PKC δ)*[J].The Journal of Biological Chemistry,2015,290(16): 10472-10485.
[13]PARAMITA S,ANINDYA R C,SHUBHRA D,et al.Autophagic vacuolation induced by excess ROS generation in HABP1/p32/gC1qR overexpressing fi broblasts and its reversal by polymeric hyaluronan[J].2013,PLoS One 8(10): 1-18.
[14]MARTHA R F,ERIKA R H.p32 (gC1qBP) Is a general protein kinase C (PKC) -binding protein[J].The Journal of Biological Chemistry,2002,277(7): 5247-5255.
[15]FOGAL V,RICHARDSON A D,KARMALI P P,et a1.Mitochondrial p32 protein is a critical regulator of tumor metabolism via maintenance of oxidative phosphorylation[J].Mol Cell Biol,2010,30(6): 1303-1318.
