不同程度亚临床甲状腺功能减退症患者止凝血相关指标变化的研究
2018-03-07张云娜赵乃蕊李翠柳杨馨鑫
高 芳, 张云娜, 赵乃蕊, 李翠柳, 杨馨鑫
(沧州市中心医院内分泌二科,河北 沧州 061001)
亚临床甲状腺功能减退症(subclinical hypothyroidism,SH)是一种常见的临床疾病,成年人中患病率为4%~10%,尤其以女性多见[1]。虽然SH通常临床症状轻微甚至无特异性,但是其与血脂代谢异常、动脉粥样硬化斑块的发生发展、血管内皮功能障碍等密切相关,增加了心血管疾病的发生及相关的死亡率[1-3]。近年研究表明,甲状腺功能紊乱患者的外周血中存在明显的止凝血指标异常[4-5],而血液凝固性质的变化与心血管疾病的发生具有一定的相关性。目前关于SH与止凝血功能关系的研究报道较少,且存在争议,对于不同程度SH患者的凝血状态的研究罕见报道。本研究对SH患者进行止凝血指标分析,探讨止凝血指标的变化情况,有助于阐明SH患者心血管疾病发病率升高的机制,并为临床是否需要对SH患者进行治疗提供了一定的决策依据。
1 材料和方法
1.1 研究对象
选取2012年3月—2013年11月在河北省沧州市中心医院内分泌科门诊95例初次诊断为SH的女性患者(SH组),其中71例患者由桥本甲状腺炎引起,甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)及甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)阳性;24例患者由甲状腺手术或碘治疗后继发SH,抗体为阴性;同时选取54名健康志愿者作为正常对照组。纳入标准:SH诊断标准为血清促甲状腺激素(thyroid-stimulating hormone,TSH)升高、血清游离甲状腺素(free thyroxine,FT4)在正常范围内;正常对照组年龄、血压、体重指数、血清FT4与SH组匹配。排除标准:年龄<18岁;已知有甲状腺疾病;服用影响甲状腺功能的药物及降血脂药物;冠心病、糖尿病、高血压、高血脂、慢性肝病、慢性肾病、急慢性炎症及结缔组织病患者;产后、妊娠期。
1.2 方法
记录所有研究对象的年龄、血压、体重指数、吸烟史,所有检查者均禁食水至少8 h后抽取其静脉血,TSH、血清游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、FT4、TPOAb、TGAb采用cobas e601全自动电化学发光免疫分析仪(瑞士Roche公司)检测,正常参考区间分别为0.27~4.20 μIU/mL、2.0~4.4 pg/ mL、0.93~17.00 ng/L、<115 IU/mL、<34 IU/mL;甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、空腹血糖(fasting blood glucose,FBG)、尿酸(uric acid,UA)、D-二聚体(D-dimer,DD)采用7600-120 HITACHI全自动生化分析仪(日本日立公司)检测,正常参考区间分别为:0.0~1.7 mmol/ L,2.8~6.0 mmol/L、0.00~3.12 mmol/L、0.8~1.5 mmol/L、3.6~6.1 mmol/L、137~488 μmol/L、0.00~1.35 μg/mL;活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time,PT)、纤维蛋白原(fibrinogen,Fib)采用CA 7000全自动血凝分析仪(日本Sysmex公司)检测,正常参考区间分别为23~35 s、10~14 s及2~4 g/L;血小板(platelet,PLT)、平均血小板容积(mean platelet volume,MPV)、血小板分布宽度(platelet distribution width,PDW)采用CE 5000全自动血液分析仪(日本Sysmex公司)检测,正常参考区间为100~300×109/ L、6~14 fL、9.8%~16.2%;血浆纤溶酶原激活物(tissue plasminogen activator,t-PA)、纤溶酶原激活物抑制物1(Plasminogen activator inhibitor-1,PAI-1)含量采用酶联免疫吸附试验,试剂盒由武汉优尔生公司提供,实验步骤和要求均严格按照说明书进行,正常参考区间分别为l~12 ng/mL、5~45 ng/mL。根据 TSH 水平将SH患者分为2个组(A组:4.2 μIU/mL<TSH<10 μIU/mL,53例;B组:TSH≥10 μIU/mL,42例)。
1.3 统计学方法
采用SPSS 18.0软件进行统计分析,正态分布资料以x ±s表示;类别变量用百分数表示;多组间比较采用方差分析,协方差分析进行影响因素的校正;2个组间比较采用t检验;类别变量比较采用χ2检验;单因素分析采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 SH A组、B组及正常对照组临床、甲状腺功能及代谢指标的比较
SH A组、B组及正常对照组3个组间平均年龄、体重指数、吸烟习惯、收缩压、舒张压、FBG、HDL-C差异无统计学意义(P>0.05)。SH A组、B组TSH、TC、LDL-C均高于正常对照组(P<0.05),SH A组TG、UA与正常对照组比较差异无统计学意义(P>0.05),SH B组患者TG、UA均高于对照组(P<0.05)。见表1。
2.2 SH A组、B组及正常对照组止凝血相关指标的比较
SH A组APTT、PT、Fib、PLT、MPV、PDW、t-PA、PAI-l与正常对照组比较无明显差异(P>0.05)。而SH B组MPV、PDW、Fib、PAI-1、t-PA均高于正常对照组(P<0.05),DD、APTT低于正常对照组(P<0.05)。见表1。
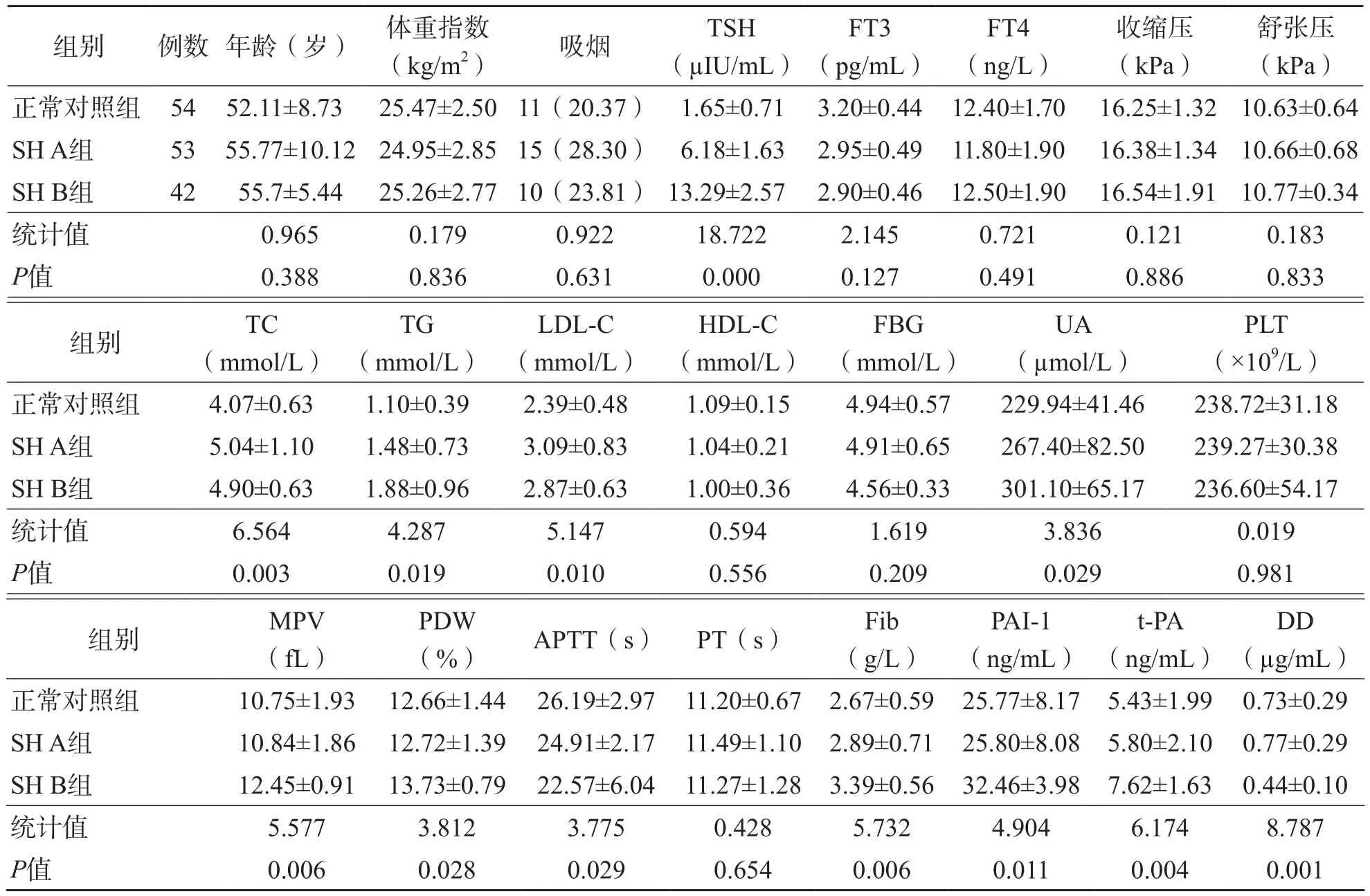
表1 各组临床、甲状腺功能、凝血相关指标的比较
经血脂校正后,SH B组MPV、PDW与正常对照组比较差异无统计学意义(P>0.05),但Fib、PAI-1、t-PA仍高于正常对照组(P<0.05),DD、APTT仍低于正常对照组,差异有统计学意义(P<0.05)。
2.3 将SH A组和B组合并为SH组后与正常对照组比较
合并后的SH组年龄、体重指数、吸烟习惯、收缩压、舒张压、FBG、HDL-C差异无统计学意义(P>0.05)。SH组TSH、TG、TC、LDL、UA均高于正常对照组(P<0.05)。APTT、PT、Fib、PLT、MPV、PDW、t-PA、PAI-l与正常对照组比较差异也无统计学意义(P>0.05)。
2.4 SH患者的甲状腺激素与止凝血指标的相关性分析
Pearson相关分析显示,APTT、PT、Fib、PLT、t-PA、PAI-l与FT3、FT4、TSH水平均无相关性。见表2。
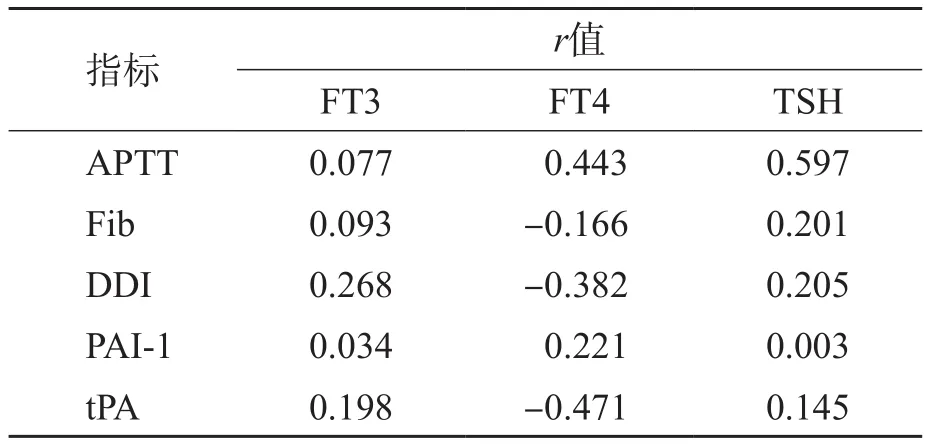
表2 SH患者的甲状腺激素与止凝血指标的相关性分析
3 讨论
SH是冠心病及心肌梗死的独立危险因素[6]。近年来,不断有关于SH对凝血功能影响的报道,并且存在不一致的结论。一些研究表明,SH患者血液呈高凝低纤溶状态[7-9]。但是也有研究指出,SH患者未出现止凝血功能的变化[10-12]。而本研究发现,不同程度SH患者中止凝血指标变化不一,按照SH的严重程度即TSH水平的高低分成轻度SH组和重度SH组,并与正常对照组比较,轻度SH组患者止凝血指标无明显变化,而重度SH组患者Fib、t-PA、PAI-1水平增高,DD水平降低,APTT缩短,这些指标变化提示动脉粥样硬化、血栓形成风险增加。当不考虑疾病的严重程度,将2个组的SH患者合并为一组,并与正常对照组比较,止凝血指标未发现明显变化。疾病严重程度不同,凝血状态不同的结论可能为先前矛盾的研究结果提供了一种解释。
本研究进一步分析了重度SH患者止凝血功能改变是否可能由代谢组分变化引起。有研究表明,SH患者LDL-C水平升高[13]。有研究结果显示,重度SH患者LDL-C、TC、TG、UA水平增高,血脂代谢紊乱、高UA血症是引起动脉粥样硬化、心血管疾病的主要危险因素,脂质沉积促使PLT黏附到受损的血管内皮细胞,促进血栓形成;另一方面,由于大量的PLT被激活、功能亢进,PLT被破坏及消耗,刺激骨髓造血功能代偿增生,产生大量的新生PLT,这些新生的PLT体积较大,含有较多的致密颗粒,黏附、聚集功能更强,导致MPV、PDW增高[14]。高UA血症通过促进PLT激活、黏附、聚集等变化引起凝血纤溶功能改变或血栓形成[15]。但是在经血脂、血UA校正后,我们发现DD、Fib、PAI-1、t-PA、APTT差异仍存在,MPV、PDW较正常对照组无差异,提示SH患者存在高凝状态。
DD的含量变化可作为体内高凝状态和纤溶亢进的标志。有学者报道[16]在轻度甲状腺功能减低的患者中DD水平减低, 易于血栓形成。Fib水平升高,提示纤维蛋白降解减少。Fib是一种急性时相蛋白,作为凝血因子I由血液进入动脉壁内,在凝血酶作用下转变为纤维蛋白单体继发交联为纤维蛋白,可直接破坏内皮细胞吸附在红细胞表面,使动脉血栓发生率增加,并促进粥样斑快进展。纤维蛋白活性减低可能与PAI-1水平升高有关,血浆PAI-1水平增高具有凝血酶激酶原的作用,使内源性和外源性纤溶活性降低,已形成的纤维蛋白不再溶解,有利于局部血栓的形成和扩展。PAI-1水平升高导致纤溶活性降低,促使血栓形成,是血栓性疾病的独立危险因素之一。PAI-1与t-PA之间保持着一种生理平衡,对防止血液低凝、高凝状态至关重要。PAI-1水平增加可抑制t-PA活性,在低纤溶状态下t-PA代偿性增加[17]。Fib增加使血流动力学改变,增加血液黏度。有文献[18]中提到Fib水平升高被定义为>3.25 g/L (依据参考值上限和人口分布的第75百分位) ,我们观察到重度SH患者Fib水平为(3.39±0.56)g/L,较正常对照组明显升高。GALLUS等[19]观察到,与术后无血栓形成的患者相比,术后血栓形成患者术前APTT水平更低。APTT缩短是血栓形成的危险因素[20],提示重度SH患者存在高凝状态,有潜在血栓形成的倾向。
本研究结果显示,凝血指标与FT3、FT4、TSH水平无相关性。由此可见,SH患者外周血的高凝状态可能与其他机制参与调节有关,所致的患者血管内皮细胞功能异常更有可能是功能紊乱而非内皮细胞直接损伤,导致止凝血指标的显著异常,形成不稳定平衡状态的出现,但仍可维持患者不发生血栓。由于患者存在显著的多系统功能异常,因此当患者合并其他风险因素时 ,可能导致患者各系统间失衡,引发血栓形成。
总之,重度SH患者已开始出现凝血功能异常,对止凝血指标监测的意义不仅在于对患者潜在血栓风险的确认,而且还在于对合并有其他疾病风险尤其是心血管疾病风险的预期评估。关于SH患者止凝血功能变化的机制以及左旋甲状腺素替代治疗是否能改善凝血功能还需要进行更深一步的思索和研究。
[1] BIONDI B,COOPER D S. The clinical significance of subclinical thyroid dysfunction[J]. Endocr Rev,2008,29(1):76-131.
[2] RODONDI N,DEN ELZEN W P,BAUER D C,et al. Subclinical hypothyroidism and the risk of coronary heart disease and mortality[J]. JAMA,2010,304(12):1365-1374.
[3] MOLINARO S,IERVASI G,LORENZONI V,et al. Persistence of mortality risk in patients with acute cardiac diseases and mild thyroid dysfunction[J].Am J Med Sci,2012,343(1):65-70.
[4] MARONGIU F,CAULI C,MARIOTTI S.Thyroid,hemostasis and thrombosis[J]. J Endocrinol Invest,2004,27(11):1065-1071.
[5] SQUIZZATO A,ROMUALDI E,BÜLLER H R,et al. Clinical review:thyroid dysfunction and effects on coagulation and fibrinolysis:a systematic review[J]. J Clin Endocrinol Metab,2007,92(7):2415-2420.
[6] HAK A E,POLS H A,VISSER T J,et al.Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women:the Rotterdam Study[J]. Ann Intern Med,2000,132(4):270-278.
[7] CANTÜRK Z,CETINARSLAN B,TARKUN I,et al. Hemostatic system as a risk factor for cardiovascular disease in women with subclinical hypothyroidism[J]. Thyroid,2003,13(10):971-977.
[8] GULDIKEN S,DEMIR M,TURGUT B,et al.Global fibrinolytic capacity in patients with subclinical hypothyroidism[J]. Endocr J,2005,52(3):363-367.
[9] AKINCI B,COMLEKCI A,ALI OZCAN M,et al. Elevated thrombin activatable fibrinolysis inhibitor(TAFI) antigen levels in overt and subclinical hypothyroid patients were reduced by levothyroxine replacement[J]. Endocr J,2007,54(1):45-52.
[10] OZCAN M A,CÖMLEKCI A,DEMIRKAN F,et al. Plasma levels of free tissue factor pathway inhibitor in patients with various thyroid disorders[J].Thromb Res,2003,110(4):243-247.
[11] KVETNY J,HELDGAARD P E,BLADBJERG E M,et al. Subclinical hypothyroidism is associated with a low-grade inflammation,increased triglyceride levels and predicts cardiovascular disease in males below 50 years[J]. Clin Endocrinol(Oxf),2004,61(2):232-238.
[12] EREM C. Blood coagulation,fibrinolytic activity and lipid profile in subclinical thyroid disease:subclinical hyperthyroidism increases plasma factor X activity[J].Clin Endocrinol(Oxf),2006,64(3):323-329.
[13] 陈宝炳,陈松,滕勇,等. 甲状腺功能减退患者血清同型半胱氨酸水平监测的意义[J]. 检验医学,2005,30(6):593-594.
[14] PIAZZE J,GIOIA S,CEREKJA A,et al. Doppler velocimetry alterations related to platelet changes in third trimester pregnancies[J]. Platelets,2007,18(1):11-15.
[15] FERNÁNDEZ-REAL J M,BROCH M,RICHART C,et al. CD14 monocyte receptor,involved in the inflammatory cascade,and insulin sensitivity[J]. J Clin Endocrinol Metab,2003,88(4):1780-1784.
[16] CHADAREVIAN R,BRUCKERT E,LEENHARDT L,et al. Components of the fibrinolytic system are differently altered in moderate and severe hypothyroidism[J]. J Clin Endocrinol Metab,2001,86(2):732-737.
[17] DI MINNO M N,PALMIERI V,LOMBARDI G,et al. Lack of change in insulin levels as a biological marker of PAI-1 lowering in GH-deficient adults on r-HGH replacement therapy[J]. Thromb Res,2009,124(6):711-713.
[18] DÖRR M,ROBINSON D M,WALLASCHOFSKI H,et al. Low serum thyrotropin is associated with high plasma fibrinogen[J]. J Clin Endocrinol Metab,2006,91(2):530-534.
[19] GALLUS A S,HIRSH J,GENT M. Relevance of preoperative and postoperative blood tests to postoperative leg-vein thrombosis[J]. Lancet,1973,2(7833):805-859.
[20] TRIPODI A,MANNUCCI P M. Activated partial thromboplastin time(APTT). New indications for an old test?[J]. J Thromb Haemost,2006,4(4):750-751.
