痰涂片检出白细胞吞噬细菌在下呼吸道感染诊断中的价值
2018-03-07曹慧玲赵苏瑛汪小蓉
曹慧玲, 杭 鸣, 赵苏瑛, 杨 琳, 吴 玲, 李 岷, 汪小蓉
(南京中医药大学附属医院 江苏省中医院检验科,南京,210029)
痰标本的涂片染色镜检和分离培养是病原学诊断的常用方法,对于诊断呼吸系统感染及指导临床用药具有重要价值。下呼吸道标本取样应用最广泛、最简便的方法为自然咳痰法,此法无创、标本易获得,然而其影响因素较多,尤其易受上呼吸道正常定植菌群的影响,因此经常出现致病菌与定植菌难以区分的情况[1],在临床工作中则往往会遇到用药效果和痰培养药物敏感性试验结果不一致的现象[2]。随着医疗技术的发展,大量抗菌药物的使用,呼吸道正常定植菌群作为条件致病菌,已成为下呼吸道感染的主要致病菌,也给临床治疗带来较大的困扰,迫切需要微生物检验提供可靠的病原学资料指导临床诊断及用药[3]。痰涂片不仅可以用来筛选合格痰标本,其镜下内容也为下呼吸道感染诊断提供一定的参考依据[4]。本研究用合格痰标本,镜下观察标本中白细胞(white blood cell,WBC)吞噬细菌情况,探讨其在下呼吸道感染诊断中的应用价值。
1 材料和方法
1.1 材料
1.1.1 标本及来源 随机收集2014年10月—2015年6月南京中医药大学附属医院检验科微生物室接收的临床住院患者痰标本175份(上皮细胞≤10或10~25个/低倍视野,WBC≥25个/低倍视野[5])。
1.1.2 仪器及材料 Vitek 2 Compact全自动细菌分析仪(法国生物梅里埃公司),哥伦比亚血琼脂平板(安图生物公司),M-H琼脂平板(郑州安图生物公司),中国蓝琼脂粉(英国Oxoid Limited公司),革兰染液(珠海BASO公司),显微镜(日本Olympus公司)。
1.2 方法
1.2.1 标本处理和镜检内容 将痰标本进行涂片,自然干燥,火焰固定后革兰染色、镜检。随机收集合格痰标本175份,先在低倍镜下找到合适视野再转为油镜仔细观察至少50个视野,记录镜下观察到的细菌或真菌等微生物以及染色性质(革兰阳性或革兰阴性)和形态(杆状、球状),同时观察有无WBC吞噬或伴行细菌现象,若有此现象,则记录该细菌染色性质和形态等,并计算吞噬WBC所占比例,即50个镜下视野中找到吞噬细菌WBC的个数/WBC总数。最后将所有标本进行分组,将可见WBC吞噬或伴行细菌的标本为A组,未见WBC吞噬或伴行细菌的标本为B组。
1.2.2 痰标本培养 痰标本以三区划线法分别接种于血平板、巧克力平板、中国蓝平板,置于35 ℃ 5% CO2孵育箱中培养18~24 h(常规培养)。筛选培养分离的可疑菌落用微量生化管或Vitek 2 Compact系统及配套鉴定卡进行鉴定,药物敏感性试验采用纸片扩散法或最低抑菌浓度法。当合格痰标本中出现肺炎链球菌、流感嗜血杆菌、β-溶血性链球菌(+)~(++++),或金黄色葡萄球菌、肠杆菌科细菌、不动杆菌、假单胞菌或其他革兰阴性杆菌(++)~(++++)时,确定为分离的下呼吸道潜在病原菌。
1.2.3 质量控制 质控菌株为大肠埃希菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)及金黄色葡萄球菌(ATCC 25923)。
1.2.4 临床资料收集 查阅电子病历,包括患者年龄、性别、基础疾病、是否具有感染症状(体温、咳嗽咳痰等)及其他辅助诊断指标如血常规、胸片等,患者痰标本培养前抗菌药物使用情况及培养后依据药物敏感性试验结果用药后感染症状的改变。
1.2.5 病原菌的确定 患者具有感染指征并且依据药物敏感性试验结果指导临床用药后治疗有效。
1.2.6 定植菌的确定 患者无感染指征或有感染指征但是依据药物敏感性试验结果指导临床用药后治疗无效。
1.3 统计学方法
采用SPSS 19.0软件进行统计分析,定性资料用率表示,率之间比较用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 患者临床资料
175例患者的年龄为2~95岁,其中70岁以上的老年患者99例,占56.6%,其他临床资料见表1。
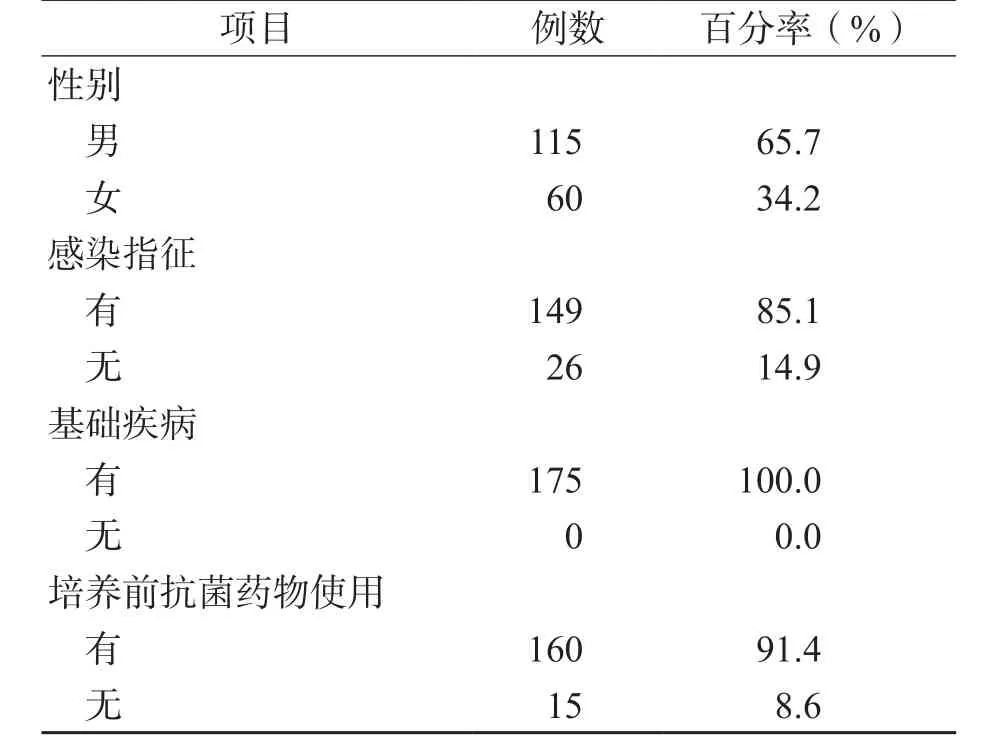
表1 患者的临床资料
2.2 涂片中WBC吞噬或伴行细菌的确定及比例
WBC吞噬细菌的能力对于抵抗病原微生物的侵入发挥着至关重要的作用。呼吸系统细菌感染时,镜下可在合格的痰涂片中找到大量的WBC,并且WBC的胞质中包含有大量细菌(吞噬)或WBC周围分布大量细菌(伴行)(图1),提示机体免疫系统对入侵的病原微生物发挥吞噬杀菌的功能。51份合格痰标本涂片中发生吞噬的WBC比例平均为30%。
2.3 不同分组的痰涂片标本与细菌培养结果一致性的比较
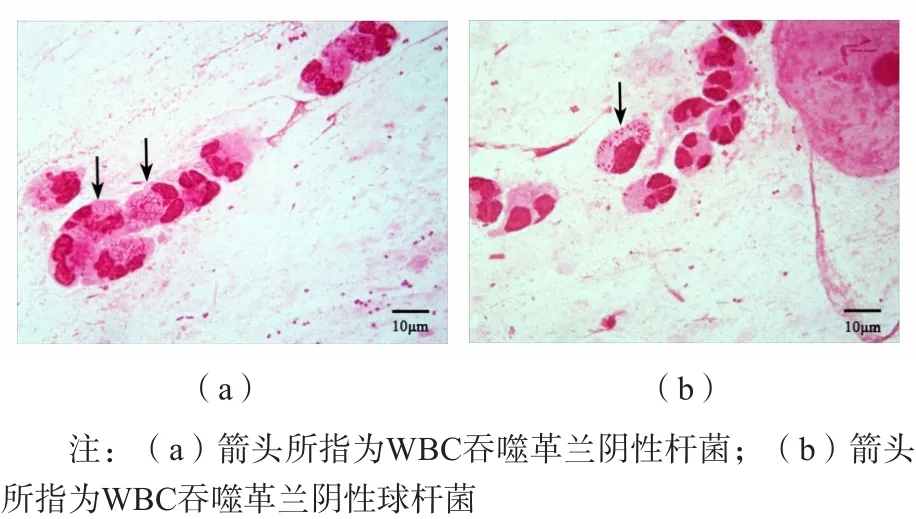
图1 痰涂片中WBC吞噬现象
根据镜下是否检出WBC吞噬或伴行细菌的情况将痰标本分为A、B 2个组,与最终培养结果进行比较。A组痰涂片中可见WBC吞噬或伴行细菌的有51例,与其相应培养结果一致率达84.3%,B组痰涂片中未见WBC吞噬或伴行细菌的有124例,与培养结果一致率为58.1%,2个组之间比较差异有统计学意义(P<0.05),A组与B组痰涂片与细菌培养结果的符合性比较见表2。

表2 痰涂片与细菌培养结果符合性 [例(%)]
2.4 不同分组的痰涂片标本与细菌感染率和定植率的关系比较
A组痰涂片标本中检出致病菌(具有其他感染指征并对抗菌药物有效)占92.2%,而B组痰标本涂片仅为38.7%,61.3%为检出呼吸道定植菌群,2个组之间比较差异有统计学意义(P<0.05)。痰涂片镜检结果与细菌感染和定植的关系见表3。
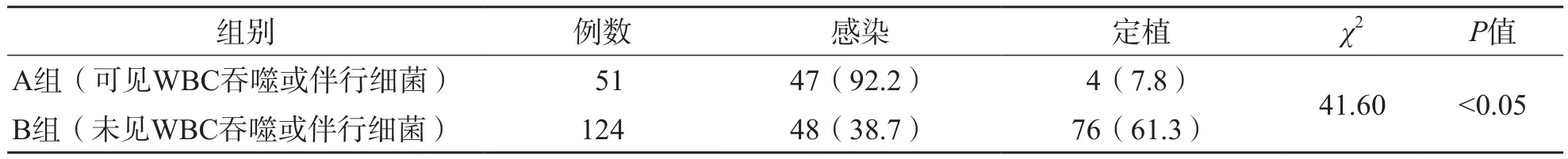
表3 痰涂片与细菌感染和定植的关系 [例(%)]
3 讨论
目前,在我国医院临床微生物实验室接收的标本中,痰标本仍然占有很大的比例,然而关于痰培养的标准化操作程序还不尽完善。痰标本留取不合格[6]、在痰培养前或痰培养的同时对痰标本未能进行革兰染色镜检、盛行以优势菌来判别致病菌、不注重与临床实际情况相结合等不规范操作,不仅存在误导临床诊断的可能,而且也加重了抗菌药物滥用的现象。由于口咽部有大量正常生理菌群,咳痰标本受口咽部生理菌群的污染不可避免。随着现代医疗技术的飞速发展,各种抗菌药物的大量使用,下呼吸道感染病原菌的种类不断变迁。过去典型的致病菌如白喉棒状杆菌、百日咳鲍特菌等已显著减少,相反由条件致病菌引起的感染却不断增多,成为下呼吸道感染的主要病原菌。条件致病菌为人体正常菌群的成员,在合适的定居部位不会引起感染,在机体因各种因素造成的抵抗力下降、菌群失调或天然屏障结构破坏时可引起感染发生[7]。因此,条件致病菌引起下呼吸道感染的病原学诊断已成为目前临床医学的难点。
本研究在进行痰培养检查的患者中发现,所有患者均患有不同程度基础疾病(高血压、糖尿病等),56.6%的患者年龄在70岁以上,85.1%患者具有一定感染症状(呼吸道感染、尿路感染或混合感染),而91.4%的患者在留取痰标本前均不同程度地使用过抗菌药物,接受了一定的抗菌治疗。以上临床资料表明,呼吸道感染的患者多为年龄较大,有其他基础疾病,且接受过一定抗菌药物治疗的患者,这些患者免疫力偏弱,易受到致病细菌的侵犯或引起条件致病菌感染。细菌培养是诊断下呼吸道感染疾病的重要手段,但往往存在标本合格率低,培养时间较长,致病菌与定植菌难以区分等不足,痰涂片为培养结果提供了较好的辅助性判断,根据WBC与上皮细胞的比例可判断标本是来自下呼吸道,还是非口腔唾液等上呼吸道分泌物[8]。本研究随机选取175份合格痰标本,比较痰涂片镜检结果与培养结果的一致性,统计结果显示可见WBC吞噬或伴行细菌的痰涂片标本的一致性要显著高于未见WBC吞噬或伴行细菌的痰涂片标本(P<0.05),表明在临床工作中,进行痰涂片观察时若可见WBC吞噬或伴行细菌,高度提示有培养的必要性。然而仍有小部分存在不一致,其原因可能为:痰涂片中WBC吞噬为机体免疫与微生物共同作用的结果,免疫力较强,细菌基本被清除,培养为阴性,痰涂片上为残留死菌;痰涂片或培养时采集的痰涂片不一致,有些黏稠的痰液未经消化处理,不能采集到有效部位;工作人员的工作经验不足等因素。
在病菌与宿主相互作用过程中,宿主吞噬细胞(主要为WBC)大量趋化浸润至炎症部位,吞噬杀灭病菌,造成感染症状发生[9]。因此,下呼吸道感染患者,不论是由致病菌还是条件致病菌引起,其来自炎症部位的痰液中必定含有大量WBC。WBC吞噬异物(包括病原菌)是机体的一种非特异性免疫防御机制,即便是健康人群其呼吸道分泌物也会有少量WBC存在,而且不同的个体免疫状态不同,因此单纯的咳痰标本细胞学计数无法确定所培养出的条件致病菌为感染病原菌[10]。本研究将患者具有感染指征并且依据药物敏感性试验结果指导临床用药后治疗有效的确定为致病菌,患者无感染指征或者有感染指征,但是依据药物敏感性试验结果指导临床用药后治疗无效的确定为定植菌。结果显示A组(痰涂片中可见WBC吞噬或伴行细菌)的标本中(吞噬WBC比例平均为30%)培养出的细菌确定为致病菌的标本有47例(92.2%),而B组(痰涂片中未见WBC吞噬或伴行细菌)的标本培养出的细菌确定为病原菌的标本有48例(38.7%),由此可见痰涂片中可见WBC吞噬或伴行细菌对鉴别致病菌和定植菌有较好的提示作用,为临床医生正确认识培养结果、正确判断下呼吸道感染并合理使用抗菌药物提供了依据。
综上所述,痰涂片中检出WBC吞噬细菌或伴行细菌对下呼吸道感染的病原学诊断具有重要价值,且革兰染色镜检最为经济、快速,能在早期为患者的诊断和治疗提供重要信息[11-12],此外,结合细菌培养以及药物敏感性试验结果可指导临床用药,提高临床诊断的正确性,减轻患者的痛苦和经济负担。
[1] SUZAKI A. Contribution of rapid diagnostic test in the treatment of infectious diseases [J]. Rinsho Biseibutshu Jinsoku Shindan Kenkyukai Shi,2014,24(2):57-61.
[2] 秦君平,杜斌. 临床医生如何解读培养结果[J]. 实用医院临床杂志,2012,9(6):9-11.
[3] 刘华,黄学斌,肖代文,等. 重症监护病房鲍曼不动杆菌感染/定植情况及耐药性分析[J]. 实用医院临床杂志,2012,9(6):102-104.
[4] 刘建侠,刘胜林,王彦锋. 痰涂片在下呼吸道感染中的应用价值探讨[J]. 吉林医学,2014,35(23):5143-5144.
[5] 杨朵,辛续丽,马东媛,等. 痰培养标本合格性评估标准的比较[J]. 检验医学,2012,27(9):773-775.
[6] 廖亚龙,候铁英,陈晓丽,等. 痰标本处理流程优化成效分析[J]. 中华医院感染学杂志,2013,23(22):5629-5631.
[7] 徐涛,陈玉莲,李磊邦,等. 正常人下呼吸道痰标本主要需氧条件致病菌携带率[J]. 吉林医学,2012,33(11):2344-2346.
[8] 杨卫萍,陈丽. 痰标本质量的评价[J]. 江汉大学学报(自然科学版),2016,44(1):71-73.
[9] GAO P,ZHANG J,HE X,et al. Sputum inflammatory cell-based classification of patients with acute exacerbation of chronic obstructive pulmonary disease[J]. PLoS One,2013,8(5):e57678.
[10] 杨小琴. 痰涂片检查与细菌培养的一致性分析[J]. 检验医学与临床,2010,7(14):1476-1477.
[11] 陈险峰,周庭银. 痰标本涂片革兰染色镜检的临床意义[J]. 检验医学,2013,28(6):499-502.
[12] 孔昌盛,陈俊,祁巧莉,等. 小儿经鼻腔取痰涂片革兰染色镜检对社区获得性肺炎早期诊断的价值[J]. 检验医学,2016,31(3):201-204.
