葡萄糖饥饿对HeLa细胞形态与结构的影响
2018-03-07邵邻相苏佳佳
曾 杰, 陈 佳, 邵邻相, 苏佳佳
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
葡萄糖作为真核生物的主要能源物质和新陈代谢中间产物,对生物体的生长发育具有重要作用,因此,体内葡萄糖水平对生物体的健康具有重要影响.近几年的研究表明:体内高浓度的葡萄糖可增加大多数癌症的发病机率[1],并可促进癌细胞的增殖、转移和粘附[2];低浓度葡萄糖有益于人体对抗由高糖分解癌症和转移性肿瘤(HGCM)引发的疾病[3],并可降低癌细胞的增殖[4].
肿瘤细胞表现出异常的新陈代谢,其葡萄糖的摄取和利用速度增加,糖酵解代谢增强,胞外乳酸堆积增多,肿瘤细胞从细胞外环境摄取的葡萄糖的量大约是正常细胞的10多倍[5].葡萄糖为肿瘤细胞的生长提供了充分的能量,因此,通过剥夺葡萄糖的癌症治疗方法受到人们的广泛关注.文献[6]首次解析了人源葡萄糖转运蛋白GLUT1的晶体结构,有可能实现葡萄糖转运的人工干预,通过特异性阻断对癌细胞的葡萄糖供应,抑制癌细胞生长.文献[7]用碳酸氢钠去除肿瘤内的氢离子,可破坏乳酸根和氢离子的协同作用,从而快速有效地杀死处于葡萄糖饥饿或缺乏的肿瘤细胞.葡萄糖饥饿是指通过降低培养基中的葡萄糖浓度而对细胞进行饥饿处理.本实验通过对HeLa细胞进行葡萄糖饥饿处理,观察细胞形态与结构的变化,为肿瘤的限食疗法提供理论依据.
1 材料与方法
1.1 主要试剂与仪器
高糖DMEM培养基为Gibco公司产品;胎牛血清为兰州百灵生物技术有限公司产品;无糖DMEM培养基、葡萄糖、噻唑蓝(MTT)、二甲基亚砜(DMSO)、吖啶橙(AO)、溴化乙锭(EB)、牛血清蛋白(BSA)、Anti-α-Tubulin鼠多克隆抗体和鬼笔环肽(FITC-Phallodin)为Sigma公司产品;Alexa Fluor®488驴抗鼠IgG为Invitrogen公司产品;3111型CO2细胞培养箱为热电公司产品;iMark Microplate Reader为Bio-Rad公司产品;TS-100型倒置显微镜为尼康公司产品;S-4800日立扫描电子显微镜(SEM)为Hitachi公司产品;TCS SP5Ⅱ激光共聚焦扫描显微镜为Leica公司产品.
1.2 细胞培养
0.0,1.0,1.5,2.0和25.0 mmol/L葡萄糖培养基由无糖培养基配置;对照组培养基内葡萄糖浓度为25.0 mmol/L.培养方法参照文献[8].
1.3 葡萄糖饥饿最适葡萄糖浓度的筛选
根据人体内的葡萄糖浓度(5.5 mmol/L)及参考文献[9],设置葡萄糖浓度梯度为0.0,1.0,1.5和2.0 mmol/L(以上浓度未计算细胞培养时加入的原胎牛血清中的5.5 mmol/L糖浓度)的培养基,分别处理HeLa细胞24 h后,每孔加入5 mg/mL MTT溶液10 μL,培养3 h,弃去培养基,每孔加入75 μL DMSO,震荡15 min,酶标仪570 nm下测定吸光度值,并计算抑制率.

1.4 倒置显微镜观察细胞形态
HeLa细胞经葡萄糖饥饿分别处理24,48及72 h后,倒置显微镜下进行观察,拍照.
1.5 荧光染色观察细胞核形态
HeLa细胞经葡萄糖饥饿分别处理24,48及72 h后,取出细胞爬片,磷酸盐缓冲液清洗3次.临用前将AO(5 μg/mL)和EB(5 μg/mL)溶液等体积混合.在爬片上滴加混合液进行染色,荧光显微镜观察,拍照.
1.6 扫描电镜观察细胞表面超微结构
HeLa细胞经葡萄糖饥饿处理48 h后,使用扫描电子显微镜观察细胞表面结构,实验方法参照文献[10].
1.7 激光共聚焦免疫荧光观察细胞骨架
HeLa细胞经葡萄糖饥饿处理48 h后,3.7%甲醛溶液4 ℃固定过夜;磷酸盐缓冲液清洗3次;0.1%TritonX-100透膜20 min,磷酸盐缓冲液清洗3次;5%BSA室温封闭30 min;α-Tubulin鼠多克隆抗体(1%BSA稀释液1∶1 000)4 ℃过夜;磷酸盐缓冲液清洗3次;Alexa Fluor®488驴抗鼠IgG(1∶1 000)室温避光孵育30 min;磷酸盐缓冲液清洗3次;4′,6-二脒基-2-苯基吲哚(DAPI)染色液染色10 min,磷酸盐缓冲液清洗2次,双蒸水漂洗2次;加防荧光淬灭剂,4 ℃晾干,封片;在激发光为496 nm,发射光范围为515~525 nm条件下观察,拍照.微丝(F-Actin)染色方法:3.7%甲醛溶液4 ℃固定过夜;磷酸盐缓冲液清洗3次;FITC-Phalloidin染色(1%BSA稀释液1∶40)室温避光孵育30 min;以下操作步骤同上.
1.8 统计分析
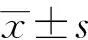
2 结 果
2.1 葡萄糖饥饿最适葡萄糖浓度的筛选结果
如表1所示:HeLa细胞经葡萄糖饥饿处理24 h后,葡萄糖浓度为0.0,1.0,1.5和2.0 mmol/L组细胞增殖抑制率分别为56.16%,36.30%,25.00%和16.44%.细胞增殖抑制率随着葡萄糖浓度的降低而逐渐升高.为了实验的方便性与准确性,选择1.0 mmol/L葡萄糖浓度作为葡萄糖饥饿的最适处理浓度.

表1 葡萄糖饥饿24 h最适葡萄糖浓度的筛选
注:与对照组比较,*表示P<0.05,**表示P<0.01.
2.2 葡萄糖饥饿对细胞形态的影响
如图1所示:HeLa细胞经葡萄糖饥饿处理24 h后,对照组和25.0 mmol/L组的细胞生长良好,细胞形态无明显变化,其分布均匀,贴壁性好,形态饱满;1.0 mmol/L组的细胞密度减小,少数细胞收缩变圆;0.0 mmol/L组的细胞大多数都收缩变圆.48 h后,对照组和25.0 mmol/L组的细胞密度变大,细胞形态正常;1.0 mmol/L组的细胞大多数变圆;0.0 mmol/L组的细胞几乎全部变圆.72 h后,对照组和25.0 mmol/L组的细胞生长状态较好,增殖速度快,细胞间出现相互挤压的现象,但细胞贴壁性好,形态饱满;1.0 mmol/L与0.0 mmol/L组的细胞几乎全部变圆.

A:对照组;B:c(葡萄糖)=25.0 mmol/L组;C:c(葡萄糖)=1.0 mmol/L组;D:c(葡萄糖)=0.0 mmol/L组.标尺长度为50 μm
2.3 葡萄糖饥饿对HeLa细胞核的影响
如图2所示:HeLa细胞经葡萄糖饥饿分别处理24,48及72 h后,AO/EB双重荧光染色观察细胞核染色质的分布,吖啶橙(AO)能透过完整的细胞,嵌入细胞核DNA,使之发出明亮的绿色荧光,溴化乙锭(EB)仅能透过胞膜受损的细胞,嵌入核DNA,发橘红色荧光.葡萄糖饥饿24 h后,对照组、25.0 mmol/L组的细胞结构完整,呈分布均匀的绿色荧光,细胞核完整,边界清晰;1.0 mmol/L组的少部分细胞发生膜皱缩,胞浆稀少,细胞收缩变圆,体积减小,核染色体固缩、边聚,出现凋亡小体等细胞凋亡特征;0.0 mmol/L组多数细胞的细胞核被染成黄色,处于中期凋亡状态.48 h后,对照组、25.0 mmol/L组的细胞结构完整,呈分布均匀的绿色荧光;1.0 mmol/L组多数细胞的细胞核被染成黄色,处于中期凋亡状态;0.0 mmol/L组细胞几乎全部被染成橙红色,处于晚期凋亡的状态.72 h后,对照组、25.0 mmol/L组的细胞结构完整,呈分布均匀的绿色荧光;1.0 mmol/L组与0.0 mmol/L组细胞全部被染成橙红色,处于晚期凋亡的状态.
2.4 葡萄糖饥饿对HeLa细胞表面超微结构的影响
由图3可见:HeLa细胞经葡萄糖饥饿处理48 h后,对照组和25.0 mmol/L组细胞形态饱满,多呈规则的梭形或多角形,贴壁性好,细胞表面具有丰富的微绒毛,伪足发达且延展性好,相邻细胞的伪足相互紧密连接.1.0 mmol/L组的细胞形状变圆,体积缩小,贴壁性降低,细胞表面的微绒毛和伪足等结构几乎全部消失,出现凋亡小体结构.0.0 mmol/L组的细胞收缩变圆,体积进一步缩小,细胞表面的微绒毛和伪足等结构近乎完全消失,细胞膜出现褶皱.
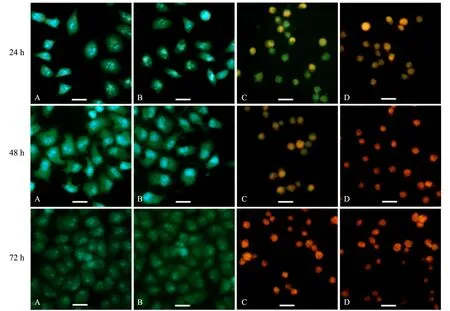
A:对照组;B:c(葡萄糖)=25.0 mmol/L组;C:c(葡萄糖)=1.0 mmol/L组;D:c(葡萄糖)=0.0 mmol/L组.标尺长度为25 μm

A:对照组;B:c(葡萄糖)=25.0 mmol/L组;C:c(葡萄糖)=1.0 mmol/L组;D:c(葡萄糖)=0.0 mmol/L组图3 扫描电镜观察葡萄糖饥饿对HeLa细胞表面超微结构的影响
2.5 葡萄糖饥饿对HeLa细胞微管分布的影响
由图4可见:HeLa细胞经葡萄糖饥饿处理48 h后,对照组和25.0 mmol/L组细胞轮廓清晰,立体感强;微管从微管组织中心散发呈辐射状,围绕在细胞核周围,均匀地分布在整个细胞中.微管着色均一,连贯性好,呈清晰的丝状纤维结构.1.0 mmol/L组细胞整体轮廓清晰度下降,呈圆形或三角形,可见凋亡小体;微管蛋白解聚,聚集于细胞边缘,丝状纤维结构消失.0.0 mmol/L组细胞收缩变小,呈圆形;微管蛋白完全解聚,聚集于细胞边缘两端,丝状纤维结构消失.
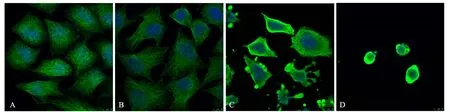
A:对照组;B:c(葡萄糖)=25.0 mmol/L组;C:c(葡萄糖)=1.0 mmol/L组;D:c(葡萄糖)=0.0 mmol/L组图4 激光共聚焦免疫荧光观察葡萄糖饥饿对HeLa细胞微管分布的影响
2.6 葡萄糖饥饿对HeLa细胞微丝分布的影响
由图5可见:HeLa细胞经葡萄糖饥饿处理48 h后,对照组和25.0 mmol/L组细胞形态规则,立体感强,肌动蛋白丝聚合形成束状结构并分布于细胞边缘,细胞间连接紧密.1.0 mmol/L组细胞的细胞核收缩变圆,轮廓模糊.细胞收缩变小,呈圆形或三角形.肌动蛋白丝消失,表面微绒毛减少,细胞间的连接减少或中断.0.0 mmol/L组细胞进一步收缩变圆,微丝蛋白解聚,着色变浅,细胞表面微绒毛完全消失.
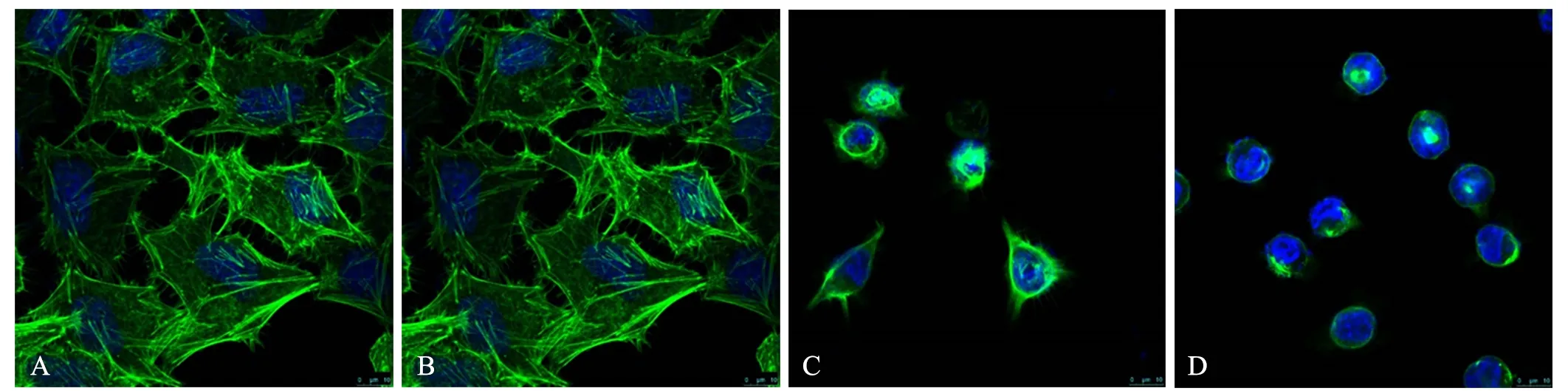
A:对照组;B:c(葡萄糖)=25.0 mmol/L组;C:c(葡萄糖)=1.0 mmol/L组;D:c(葡萄糖)=0.0 mmol/L组图5 激光共聚焦免疫荧光观察葡萄糖饥饿对HeLa细胞微丝分布的影响
3 讨 论
在葡萄糖饥饿条件下,降低癌细胞的异常新陈代谢,诱导癌细胞的凋亡[11].Foster等[9]用0.0,0.5和25.0 mmol/L葡萄糖浓度的条件处理多种肿瘤细胞120 h.结果表明,0.0 mmol/L葡萄糖浓度处理组的所有肿瘤细胞的生长均受到抑制作用;0.5 mmol/L葡萄糖浓度处理可以抑制多种肿瘤细胞的生长.闫珊[12]研究发现,缺糖能降低HeLa细胞的生存率,并诱导细胞发生凋亡.本实验通过对HeLa细胞进行葡萄糖饥饿处理,倒置显微镜下观察细胞形态,结果发现,细胞形态发生改变,细胞由规则的梭形或多角形逐渐转变成三角形或圆形,并出现凋亡小体等凋亡特征,这与闫珊等[12]的研究结果相一致;AO/EB染色结果显示,细胞膜皱缩,胞浆稀少,细胞收缩变圆,体积减小,核染色体固缩,边聚,出现凋亡小体等细胞凋亡特征,这与蒋时红等[13]的研究结果相一致;扫描电镜观察发现:细胞表面的微绒毛和伪足等结构近乎完全消失,细胞膜出现褶皱;免疫荧光检测结果显示:微丝蛋白减少,细胞形态发生改变,微管结构被破坏,微管蛋白解聚并聚集于细胞边缘,并且随着葡萄糖饥饿葡萄糖浓度的降低,细胞骨架被破坏的程度加深.
综上所述,葡萄糖饥饿条件下,HeLa细胞表面的微绒毛和伪足结构消失,微丝蛋白减少,排列混乱,微管蛋白解聚并聚集于细胞边缘,丝状纤维结构消失,染色质凝集,进而诱导HeLa细胞形态变化和凋亡.葡萄糖饥饿能够抑制HeLa细胞活性,改变细胞形态,诱导细胞凋亡,这为临床上饥饿疗法治疗肿瘤提供理论依据.
[1]Giovannucci E,Harlan D M,Archer M C,et al.Diabetes and cancer:A consensus report[J].Diabetes Care,2010,33(7):1674-1685.
[2]Graham N A,Tahmasian M,Kohli B,et al.Glucose deprivation activates a metabolic and signaling amplification loop leading to cell death[J].Molecular Systems Biology,2012,8(1):589.
[3]Mathews E H,Liebenberg L.Can successful cancer therapies build on what we learn from complex disorders[J].Medical Hypotheses,2012,78(5):687-689.
[4]Bost F,Sahra I B,Marchand-Brustel Y L,et al.Metformin and cancer therapy[J].Current Opinion in Oncology,2012,24(1):103-108.
[5]Kallinowski F,Vaupel P,Runkel S,et al.Glucose uptake,lactate release,ketone body turnover,metabolic micromilieu,and pH distributions in human breast cancer xenografts in nude rats[J].Cancer research,1988,48(24):7264-7272.
[6]Deng D,Xu C,Sun P C,et al.Crystal structure of the human glucose transporter GLUT1[J].Nature,2014,510(7503):121-125.
[7]Chao M,Wu H,Jin K,et al.A nonrandomized cohort and a randomized study of local control of large hepatocarcinoma by targeting intratumoral lactic acidosis[J].Elife,2016,2(5):e15691.
[8]成文召,麻艳芳,邵邻相,等.佛手叶挥发油对HeLa细胞形态与结构的影响[J].浙江师范大学学报:自然科学版,2013,36(3):331-336.
[9]Foster R,Griffin S,Grooby S,et al.Multiple metabolic alterations exist in mutant PI3K cancers,but only glucose is essential as a nutrient source[J].Plos One,2012,7(9):1-8.
[10]麻艳芳,邵邻相,张均平,等.佛手挥发油对MDA-MB-435人乳腺癌细胞体外增殖的影响[J].中国药学杂志,2010,45,(22):1737-1741.
[11]Knouzy B,Dubourg L,Baverel G,et al.Ifosfamide metabolite chloroacetaldehyde inhibits cell proliferation and glucose metabolism without decreasing cellular ATP content in human breast cancer cells MCF-7[J].Journal of Applied Toxicology,2010,30(3):204-211.
[12]闫珊.缺糖增加Bcl-2抑制剂S1诱导人宫颈癌细胞凋亡敏感性的实验研究[D].长春:吉林大学,2014.
[13]蒋时红,孙超龙,刘燕,等.麦门冬汤诱导人肺腺癌A549细胞凋亡作用及其机制[J].中华中医药杂志,2015(4):1236-1238.
