MiR-126通过MAPK信号通路抑制oxLDL处理的血管平滑肌细胞增殖和迁移
2018-03-07杨东伟
郑 茜 张 勇 杨东伟
(郑州大学附属郑州中心医院心血管内科,郑州 450000)
越来越多的研究表明小RNA(microRNAs,miRNAs)在动脉粥样硬化的病理生理细胞效应及分子信号通路中起着重要的调控作用[1]。MiRNAs是一类小非编码RNA序列,长约22个核苷酸,目前已发现2 042种miRNAs[2]。这些miRNAs共同调控着基因组中三分之一的基因,而且miRNAs与多种疾病相关[3]。MiRNAs在神经性疾病、哮喘及癌症等疾病中都起着重要作用[4-8]。MiR-126在多种癌症中都低表达,可通过抑制癌细胞生长、迁移及侵袭等影响癌症进程[9]。MiR-126在心血管疾病中也具有重要作用。有研究发现血浆中的miR-126水平与冠状动脉侧支循环形成呈正相关[10]。有数据显示在伴有多种血管疾病的冠状动脉疾病患者中miR-126低表达[11]。在心肌缺血再灌注损伤中,miR-126表达下调,miR-126可保护由缺血再灌注引发的心肌细胞凋亡[12]。大量文献报道miR-126具有保护血管和动脉粥样硬化的功能[13]。过表达miR-126可减弱静脉内皮细胞凋亡抑制深静脉血栓形成[14]。有研究表明内皮微颗粒可通过向受体细胞输送功能性的miR-126来促进血管内皮修复[15]。本文主要目的是利用氧化型低密度脂蛋白(oxidized low density lipoprotein,oxLDL)处理人主动脉血管平滑肌细胞(Vascular smooth muscle cell,VSMC),研究miR-126对oxLDL处理的VSMC生物学功能的影响及其分子机制。
1 材料与方法
1.1细胞系及主要试剂 人主动脉血管平滑肌细胞系T/G HAVSMC购自美国典型培养物保藏中心(American Type Culture Collection,ATCC);oxLDL购自美国Kalen Biomedical公司;促分裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号通路激活剂Anisomycin购自碧云天生物科技公司;SmGM-2培养基购自瑞士Lonza龙沙公司;胎牛血清及转染试剂TurboFect Transfection Regent购自赛默飞世尔科技公司;血脂检测试剂盒购自南京建成生物工程研究所;RNA提取试剂盒RNAiso Plus reagent购自大连TaKaRa公司;CCK-8试剂盒购自日本同仁化学公司;Transwell小室购自美国BD公司;增殖标记蛋白细胞增殖核抗原-67(Antigen identified by monoclonal antibody,Ki-67)和增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA),迁移标记蛋白基质金属蛋白酶9(Matrix metalloprotein 9,MMP-9)和血管内皮细胞生长因子(Vascular endothelial growth factor,VEGF)抗体购自美国NEB公司;MAPK信号通路相关蛋白ERK1/2、p-ERK1/2、p38、p-p38、JNK和p-JNK抗体购自英国Abcam公司。
1.2方法
1.2.1细胞培养及处理和转染 人主动脉血管平滑肌细胞T/G HAVSMC于含5%胎牛血清的SmGM-2培养基中置于37℃、5%CO2的恒温培养箱中培养。用生理盐水处理T/G HAVSMC细胞24 h作为对照组,用50 mg/ml的oxLDL处理T/G HAVSMC细胞24 h作为模型组。依照转染试剂TurboFect Transfection Regent说明书用miR-126 mimic和mimic control分别对模型组细胞进行转染并添加MAPK信号通路激活剂Anisomycin。
1.2.2胆固醇及三酰甘油水平检测 oxLDL处理T/G HAVSMC后收集细胞上清,按照试剂盒说明书测定总胆固醇(Serum total cholesterol,TC)、低密度脂蛋白胆固醇(Low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(High-density lipopro-tein cholesterol,HDL-C)和三酰甘油(Triglyceride,TG)。
1.2.3实时定量PCR(Quantitative real-time reverse transcription PCR,qRT-PCR) 用RNA提取试剂盒提取总RNA并反转成cDNA,以cDNA为模板进行qRT-PCR。miR-126上游引物:GCTGTCAGTTTGTC-AAATAC,miR-126下游引物:GTGCAGGGTCC-GAGGT。根据SYBR Premix Ex TaqTM说明书进行qRT-PCR,用公式2-ΔΔCt计算miR-126的相对表达量。
1.2.4CCK-8检测细胞增殖 转染0、1、2、3、4、5 d后,CCK-8检测各组细胞增殖倍数。首先将CCK-8溶液稀释到10%,然后用上述稀释液将待测的细胞制成1×106个/ml的悬液,37℃培养1~4 h,最后450 nm处检测吸光值,计算细胞增殖倍数。
1.2.5Transwell分析细胞迁移 待测细胞悬浮于无胎牛血清的培养基中至细胞密度为1×106个/ml,然后将细胞悬液加入到Transwell的上室中,在下室中加入含10%胎牛血清的培养基。37℃培养24 h后,0.5%的结晶紫对上室底部细胞进行染色,并用棉签将上室内侧的细胞除去。显微镜下观察细胞形态并随机选取5个视野统计每个视野下被染色的细胞数量。
1.2.6免疫印记 收集待测细胞,用PBS洗3次,然后加入已添加蛋白酶抑制剂的细胞裂解液进行裂解后提取总蛋白。等量的蛋白进行SDS-PAGE凝胶电泳分离,然后转至PVDF膜。用5%的BSA进行封闭后,依次孵育一抗和二抗,最后进行显色。
1.3统计学分析 用SPSS16.0软件对实验数据进行统计学分析,两两比较用独立的t检验。P<0.05表示差异有统计学意义。
2 结果
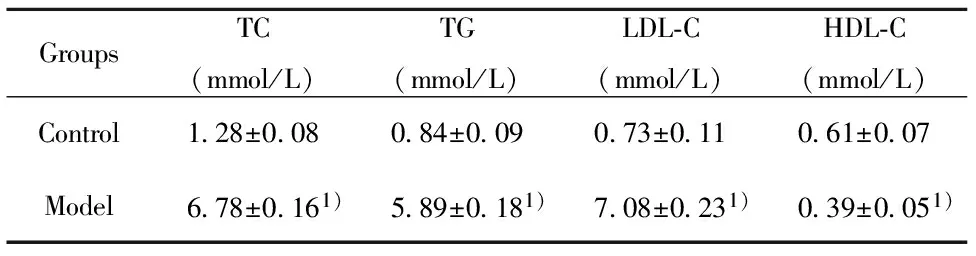
2.1oxLDL对VSMC脂质代谢的影响 用50 mg/ml的oxLDL处理T/G HAVSMC细胞24 h后检测模型组和对照组中TC、TG、LDL-C、HDL-C的浓度。如表1所示,模型组中TC、TG和LDL-C的浓度远高于对照组,HDL-C的浓度则现显著低于对照组(P<0.001)。这些指标的变化说明,oxLDL处理T/G HAVSMC后脂质代谢异常。
2.2oxLDL处理VSMC可降低miR-126表达 利用qRT-PCR检测对照组和模型组中miR-126的表达,如图1所示,模型组中miR-126相对表达量显著降低(P<0.01)。由此可见,在oxLDL处理T/G HAVSMC的模型中miR-126下调表达。
2.3增强oxLDL处理的VSMC中miR-126的表达 将miR-126 mimic和mimic control分别转染模型组细胞,qRT-PCR检测各组细胞miR-126的表达情况。如图2所示,模型组和mimic control组中miR-126的相对表达量显著低于对照组(P<0.01)。miR-126 mimic组中miR-126的相对表达量远远高于模型组(P<0.001)。这些结果说明,miR-126 mimic转染效果显著,大大地提高了模型组细胞miR-126的表达。
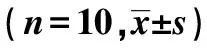
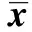
GroupsTC(mmol/L)TG(mmol/L)LDL⁃C(mmol/L)HDL⁃C(mmol/L)Control1 28±0 080 84±0 090 73±0 110 61±0 07Model6 78±0 161)5 89±0 181)7 08±0 231)0 39±0 051)
Note:TC.Total cholesterol;TG.Triglyceride;LDL-C.Low density lipoprotein cholesterin;HDL-C.High density lipoprotein cholesterol.Compared with control group,1)P<0.001.
2.4miR-126对oxLDL诱导的VSMC增殖的影响 为分析miR-126在oxLDL处理的VSMC中对细胞增殖的影响,利用CCK-8检测各组细胞增殖倍数。图3结果显示,与对照组相比,oxLDL诱导的动脉粥样硬化模型组和mimic control组细胞增殖倍数在转染后第2天开始明显增加(P<0.05),转染后第3天则显著增多(P<0.01),转染4 d以后则极显著升高了(P<0.001)。模型组中转染miR-126 mimic后第3天开始细胞增殖倍数明显低于模型组(P<0.05),转染4 d以后增殖倍数显著减少(P<0.01)。由此可见,miR-126 mimic可抑制oxLDL诱导的VSMC增殖的增加。
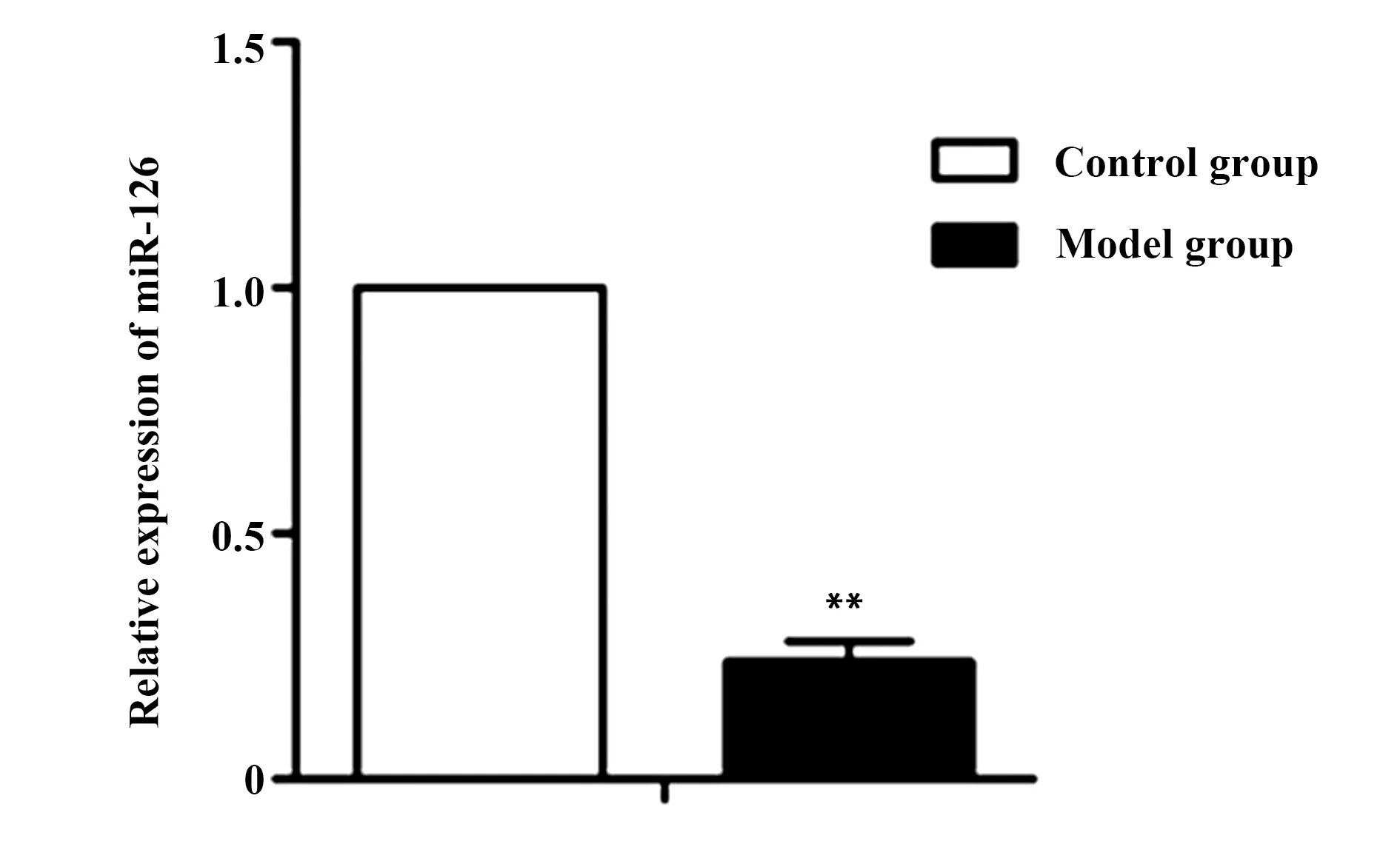
图1 qRT-PCR检测oxLDL处理后miR-126的表达Fig.1 Expression of miR-126 was tested by qRT-PCR after treatment with oxLDLNote: Compared with control group,**.P<0.01.
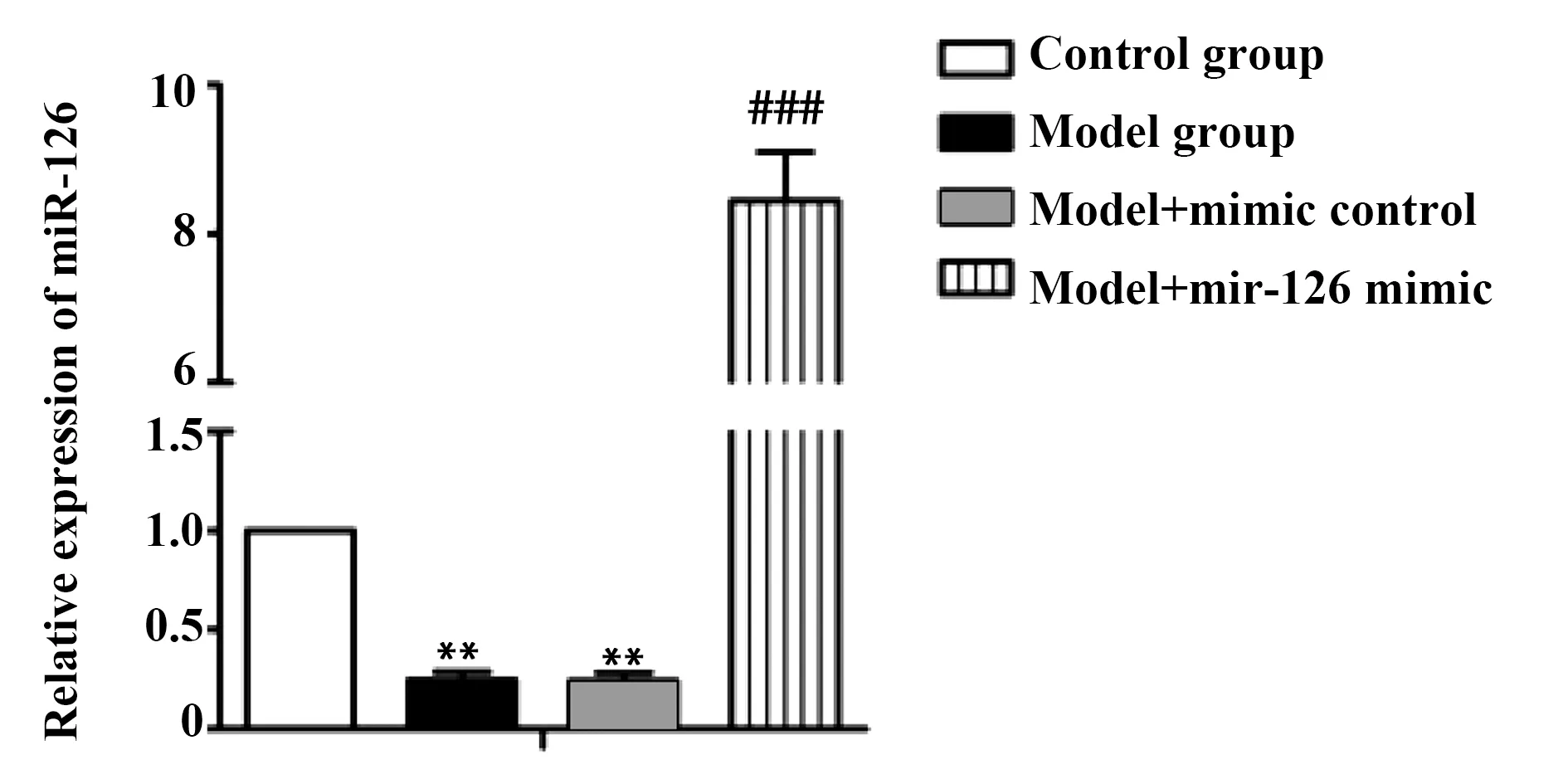
图2 qRT-PCR检测转染miR-126 mimic后miR-126的表达Fig.2 Expression of miR-126 was tested by qRT-PCR after transfection with miR-126 mimicNote: Compared with control group,**.P<0.01;comprared with model group,###.P<0.001.
2.5miR-126在oxLDL处理的VSMC中对细胞迁移的影响 Transwell检测各组细胞迁移结果显示,模型组和mimic control组迁移细胞数最多,其次是miR-126 mimic组,对照组迁移细胞数最少(图4A)。如图4B所示,模型组和mimic control组中平均每个视野的迁移细胞数远远高于对照组(P<0.001)。与模型组相比,miR-126 mimic组迁移细胞数显著降低(P<0.01)。上述结果表明,miR-126 mimic可减弱oxLDL对VSMC迁移能力的促进作用。
2.6miR-126对细胞增殖和迁移标记蛋白表达的影响 为进一步验证miR-126在oxLDL处理的VSMC中对细胞增殖和迁移的影响,免疫印迹检测各组细胞增殖和迁移标记蛋白表达。图5A显示,增殖和迁移标记蛋白Ki-67、PCNA、MMP-9、VEGF在模型组和mimic control组中表达最强,miR-126 mimic组较低,对照组表达最弱。由图5B可知,模型组和mimic control组中Ki-67、PCNA、MMP-9、VEGF的相对表达量显著高于对照组(P<0.01)。与模型组相比,miR-126 mimic组Ki-67、PCNA、MMP-9、VEGF的相对表达量明显减少(P<0.05)。这些结果说明,oxLDL可增强VSMC中细胞增殖和迁移标记蛋白表达。

图3 CCK-8检测细胞增殖Fig.3 Cell proliferation was detected by CCK-8Note: Compared with control group,*.P<0.05,**.P<0.01,***.P<0.001;compared with model group,#.P<0.05,##.P<0.01.
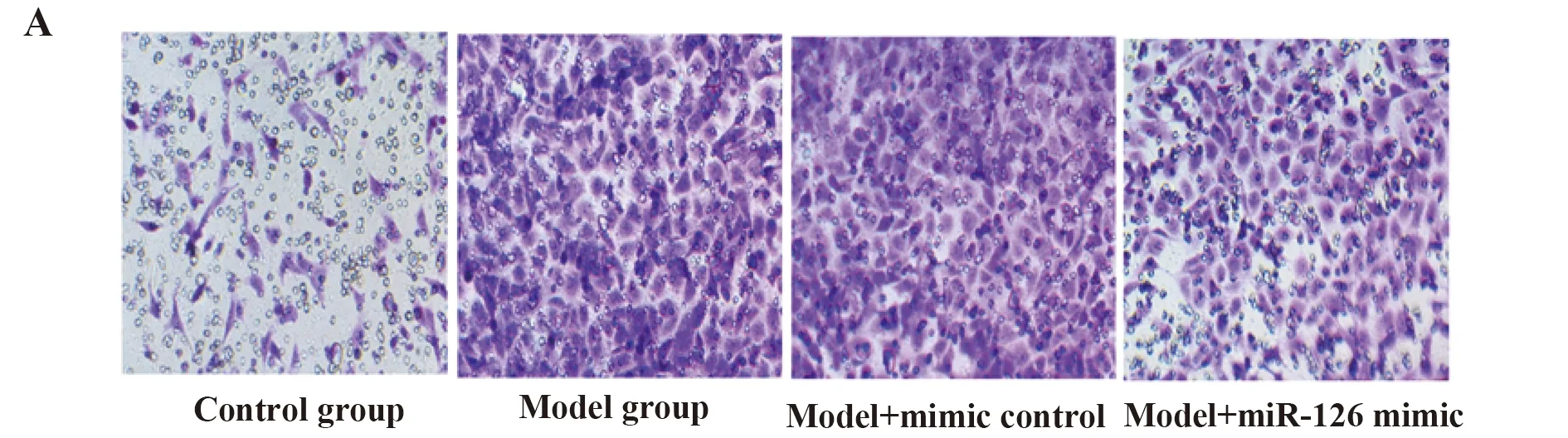
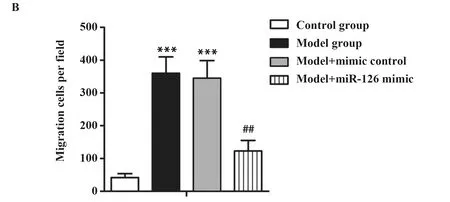
图4Transwell检测细胞迁移(结晶紫染色,×100)
Fig.4MigrationwasmeasuredbyTranswell(crystalvioletstaining,×100)
Note: A.Crystal violet staining;B.Histogram represents the statistical analysis of Transwell migration.Compared with model group,***.P<0.001;compared with model group,##.P<0.01.
2.7miR-126对MAPK信号通路相关蛋白表达的影响 为探索miR-126在oxLDL处理的VSMC中的分子调控机制,免疫印迹分析MAPK信号通路相关蛋白的表达。如图6A所示,磷酸化的蛋白p-ERK1/2、p-p38、p-JNK在模型组和mimic control组表达量最多,其次是miR-126 mimic,对照组中表达量最少,但各组细胞中ERK1/2、p38、JNK蛋白表达无明显变化。图6B显示,与对照组相比,模型组和mimic control组中p-ERK1/2/ERK1/2、p-p38/p38、p-JNK/JNK的相对蛋白表达量的比值显著升高(P<0.01),miR-126 mimic组p-ERK1/2/ERK1/2、p-p38/p38、p-JNK/JNK的相对蛋白表达量的比值则明显低于模型组(P<0.05)。由此可见,miR-126 mimic可降低oxLDL引起的VSMC中MAPK信号通路相关蛋白磷酸化水平的升高,抑制MAPK信号通路活化。
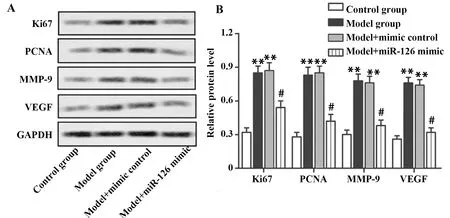
图5 免疫印迹检测细胞增殖和迁移标记蛋白的表达Fig.5 Expression of proliferation and migration marker proteins was tested by Western blotNote: A.Representative graph of Western blot;B.Histogram represents the statistical analysis of Western blot.Compared with control group,**.P<0.01;compared with model group,#.P<0.05.

图6 免疫印迹检测MAPK信号通路相关蛋白的表达Fig.6 Expression of MAPK pathway related proteins was tested by Western blotNote: A.Representative graph of Western blot;B.Histogram represents the statistical analysis of Western blot.Compared with control group,**;P<0.01;compared with model group,#.P<0.05.

图7 免疫印迹检测细胞增殖和迁移标记蛋白的表达Fig.7 Expression of proliferation and migration marker proteins was tested by Western blotNote: A.Representative graph of Western blot;B.Histogram represents the statistical analysis of Ki-67 and PCNA;C.Histogram represents the statistical analysis of MMP-9 and VEGF,compared with control group,**.P<0.01,compared with model group,#.P<0.05.
2.8miR-126通过MAPK信号通路发挥作用 为进一步确认miR-126是通过MAPK信号通路来发挥作用,添加MAPK信号通路激活剂Anisomycin检测各组细胞增殖和迁移标记蛋白表达。图7A显示,增殖和迁移标记蛋白Ki-67、PCNA、MMP-9、VEGF在Anisomycin组中表达最高。如图7B和7C所示,与对照组相比,模型组Ki-67、PCNA、MMP-9、VEGF表达明显升高(P<0.05)。与模型组相比,miR-126 mimic组Ki-67、PCNA、MMP-9、VEGF表达明显降低(P<0.05);Anisomycin组Ki-67、PCNA、MMP-9、VEGF表达明显升高(P<0.05)。miR-mimic+ Anisomycin组Ki-67、PCNA、MMP-9、VEGF表达与模型组无明显差异。由此可见,MAPK信号通路激活剂Anisomycin可逆转miR-126 mimic对oxLDL处理的VSMC增殖和迁移的影响。上述结果表明,miR-126可通过抑制MAPK信号通路减弱oxLDL诱导的VSMC增殖和迁移。
3 讨论
动脉粥样硬化的发生发展过程中会出现内皮细胞功能紊乱,平滑肌细胞增殖和迁移,炎性细胞招募,脂质和基质的积累以及血栓的形成[16]。针对这些变化,目前对于动脉粥样硬化的治疗策略主要包括生活方式的改变、降胆固醇降血压药物和抗血栓药物以及外科手术治疗,但是这些方法并非对所有的患者有效[17]。寻找开发新的治疗方案具有重大意义。随着分子生物学水平的提高,基因治疗已经成为一种极具潜力的疾病治疗手段。表达谱分析表明,在动脉粥样硬化的病理背景下,许多miRNAs在内皮细胞、平滑肌细胞和巨噬细胞中都表达异常[18]。这揭示这些miRNAs可能在动脉粥样硬化中起着重要作用,具有成为治疗靶点的可能。
大量文献报道了miRNAs在多种疾病中对细胞增殖具有重要的调控作用。在胰岛瘤细胞中,miR-126可抑制葡萄糖引起的细胞增殖[19]。Yu等[20]发现miR-126上调表达会导致宫颈癌细胞增殖能力降低。miR-126还可调节类风湿性关节炎骨膜纤维母细胞增殖[21]。Schober等[22]发现miR-126可促进内皮增生并抑制动脉粥样硬化病变。血管平滑肌细胞的增殖是动脉粥样硬化的关键过程之一[23]。有数据表明oxLDL处理血管平滑肌细胞会导致miR-141表达降低,miR-141对血管平滑肌细胞增殖起着重要的调控作用[24]。Kim等[25]研究显示过表达miR-365可降低血管平滑肌细胞增殖能力和增殖标记蛋白PCNA的表达。过表达miR-599可抑制血管平滑肌细胞增殖及增殖标记蛋白PCNA和Ki-67的表达[26]。与前人结果类似,本文结果显示,50 mg/L的oxLDL处理人主动脉血管平滑肌细胞24 h会导致miR-126表达减弱,细胞增殖倍数及增殖标记蛋白表达升高;而miR-126 mimic则可以降低oxLDL诱导的细胞增殖倍数和增殖标记蛋白表达的增加。这说明,miR-126 mimic在可抑制oxLDL诱导的人主动脉血管平滑肌细胞T/G HAVSMC增殖能力的升高。
MiRNAs对多种疾病的细胞迁移也存在很大的影响。在结肠直肠癌中,增强miR-126表达可以抑制结肠直肠癌细胞迁移能力[27]。过表达miR-126还可抑制骨肉瘤细胞迁移[28]。Yang等[29]发现miR-126可抑制胃癌细胞迁移能力。血管平滑肌细胞是动脉管壁最丰富的细胞且与动脉粥样硬化有关。据报道miRNAs还可调控动脉粥样硬化中平滑肌细胞的迁移[30]。有研究显示miR-379可以抑制血管平滑肌细胞迁移[31]。过表达miR-145和miR-181b会导致血管平滑肌细胞迁移能力降低[32,33]。Cho等[34]发现miR-761可抑制血管紧缩素引起的血管平滑肌细胞迁移能力的增强。本研究结果显示,oxLDL处理人主动脉血管平滑肌细胞后,细胞迁移及迁移标记蛋白表达增强;miR-126 mimic则可以抑制这种oxLDL诱导的细胞迁移及迁移标记蛋白表达的升高。这表明,增强miR-126表达可减弱oxLDL导致的人主动脉血管平滑肌细胞T/G HAVSMC迁移能力的升高。
众所周知MAPK信号通路具有重要的生物学功能。据报道许多miRNAs是通过MAPK信号通路来发挥其功能。有研究表明过表达miR-126可通过调节ERK MAPK信号通路促进间质干细胞向内皮细胞分化[35]。Zuo等[36]发现在动脉粥样硬化中,过表达内皮祖细胞的miR-26a会导致p-p38水平下降,p38表达水平无变化,这说明miR-26a可通过p38 MAPK途径调控内皮祖细胞功能。有数据显示在动脉粥样硬化中miR-136可已通过ERK1/2 MAPK通路调节血管平滑肌细胞增殖[37]。Li等[38]发现miR-181b可通过调节p-ERK1/2/ERK1/2平衡来调控血管平滑肌细胞增殖。本文结果显示,在oxLDL处理的VSMC中,MAPK信号通路中的p-ERK1/2/ERK1/2、p-p38/p38、p-JNK/JNK的相对蛋白表达量的比值升高,转染miR-126 mimic可降低MAPK信号通路相关蛋白磷酸化水平的增加。而且,MAPK信号通路激活剂Anisomycin可逆转miR-126 mimic对oxLDL处理的VSMC增殖和迁移的影响。上述结果表明,miR-126可通过MAPK信号通路调节人主动脉血管平滑肌细胞的增殖和迁移。
本研究表明,oxLDL处理人主动脉血管平滑肌细胞的模型中,细胞增殖和迁移能力提高,MAPK信号通路中的p-ERK1/2/ERK1/2、p-p38/p38、p-JNK/JNK比值升高。MiR-126 mimic可降低动脉粥样硬化中细胞增殖和迁移能力及MAPK信号通路相关蛋白磷酸化水平的升高。MAPK信号通路激活剂Anisomycin可逆转miR-126 mimic对oxLDL处理的VSMC增殖和迁移的影响。
综上所述,miR-126可通过MAPK信号通路抑制oxLDL诱导的VSMC增殖和迁移。下一步计划将通过动物模型对miR-126在动脉粥样硬化中的作用进行体内研究,为开发新的动脉粥样硬化治疗方案奠定基础。
[1] Feinberg MW,Moore KJ.MicroRNA regulation of atherosclerosis[J].Circ Res,2016,118(4):703-720.
[2] Di Leva G,Garofalo M,Croce CM.MicroRNAs in cancer[J].Annu Rev Pathol,2014,9:287-314.
[3] Hammond SM.An overview of microRNAs[J].Adv Drug Deliv Rev,2015,87:3-14.
[4] Greenberg DS,Soreq H.MicroRNA therapeutics in neurological disease[J].Curr Pharm Des,2014,20(38):6022-6027.
[5] Igaz P,Igaz I,Nagy Z,etal.MicroRNAs in adrenal tumors:relevance for pathogenesis,diagnosis,and therapy[J].Cell Mol Life Sci,2015,72(3):417-428.
[6] Kai W,Qian XU,Qun WU.MicroRNAs and asthma regulation[J].Iran J Allergy Asthma Immunol,2015,14(2):120-125.
[7] Perge P,Nagy Z,Igaz I,etal.Suggested roles for microRNA in tumors[J].Biomol Concepts,2015,6(2):149-155.
[8] Sellitti DF,Doi SQ.MicroRNAs in renal cell carcinoma[J].Microrna,2015,4(1):26-35.
[9] Ebrahimi F,Gopalan V,Smith RA,etal.miR-126 in human cancers:clinical roles and current perspectives[J].Exp Mol Pathol,2014,96(1):98-107.
[10] Nie X,Su L,Zhou Y,etal.Association between plasma levels of microRNA-126 and coronary collaterals in patients with coronary artery disease[J].Zhonghua Xin Xue Guan Bing Za Zhi,2014,42(7):561-565.
[11] Li HY,Zhao X,Liu YZ,etal.Plasma MicroRNA-126-5p is associated with the complexity and severity of coronary artery disease in patients with stable angina pectoris[J].Cell Physiol Biochem,2016,39(3):837-846.
[12] Li B,Tao Y,Huang Q.Effect and mechanism of miR-126 in myocardial ischemia reperfusion[J].Genet Mol Res,2015,14(4):18990-18998.
[13] Chistiakov DA,Orekhov AN,Bobryshev YV.The role of miR-126 in embryonic angiogenesis,adult vascular homeostasis,and vascular repair and its alterations in atherosclerotic disease[J].J Mol Cell Cardiol,2016,97:47-55.
[14] Chen L,Wang J,Wang B,etal.MiR-126 inhibits vascular endothelial cell apoptosis through targeting PI3K/Akt signaling[J].Ann Hematol,2016,95(3):365-374.
[15] Jansen F,Yang X,Hoelscher M,etal.Endothelial microparticle-mediated transfer of MicroRNA-126 promotes vascular endothelial cell repair via SPRED1 and is abrogated in glucose-damaged endothelial microparticles[J].Circulation,2013,128(18):2026-2038.
[16] Mani S,Untereiner A,Wu L,etal.Hydrogen sulfide and the pathogenesis of atherosclerosis[J].Antioxid Redox Signal,2014,20(5):805-817.
[17] Kivela AM,Huusko J,Yla-Herttuala S.Prospect and progress of gene therapy in treating atherosclerosis[J].Exp Opin Biol Ther,2015,15(12):1699-1712.
[18] Loyer X,Mallat Z,Boulanger CM,etal.MicroRNAs as therapeutic targets in atherosclerosis[J].Exp Opin Ther Targets,2015,19(4):489-496.
[19] Tao H,Wang MM,Zhang M,etal.MiR-126 suppresses the glucose-stimulated proliferation via IRS-2 in INS-1 beta cells[J].PLoS One,2016,11(2):e0149954.
[20] Yu Q,Liu SL,Wang H,etal.miR-126 suppresses the proliferation of cervical cancer cells and alters cell sensitivity to the chemotherapeutic drug bleomycin[J].Asian Pac J Cancer Prev,2014,14(11):6569-6572.
[21] Qu Y,Wu J,Deng JX,etal.MicroRNA-126 affects rheumatoid arthritis synovial fibroblast proliferation and apoptosis by targeting PIK3R2 and regulating PI3K-AKT signal pathway[J].Oncotarget,2016,7(45):74217-74226.
[22] Schober A,Nazari-Jahantigh M,Wei Y,etal.MicroRNA-126-5p promotes endothelial proliferation and limits atherosclerosis by suppressing Dlk1[J].Nat Med,2014,20(4):368-376.
[23] Xu Z,Han Y,Liu J,etal.MiR-135b-5p and MiR-499a-3p promote cell proliferation and migration in atherosclerosis by directly targeting MEF2C[J].Sci Rep,2015,5:12276.
[24] Zhang Y,Chen B,Ming L,etal.MicroRNA-141 inhibits vascular smooth muscle cell proliferation through targeting PAPP-A[J].Int J Clin Exp Pathol,2015,8(11):14401-14408.
[25] Kim MH,Ham O,Lee SY,etal.MicroRNA-365 inhibits the proliferation of vascular smooth muscle cells by targeting cyclin D1[J].J Cell Biochem,2014,115(10):1752-1761.
[26] Xie B,Zhang C,Kang K,etal.miR-599 inhibits vascular smooth muscle cells proliferation and migration by targeting TGFB2[J].PLoS One,2015,10(11):e0141512.
[27] Li Z,Li N,Wu M,etal.Expression of miR-126 suppresses migration and invasion of colon cancer cells by targeting CXCR4[J].Mol Cell Biochem,2013,381(1-2):233-242.
[28] Jiang R,Zhang C,Liu G,etal.MicroRNA-126 inhibits proliferation,migration,invasion,and EMT in osteosarcoma by targeting ZEB1[J].J Cell Biochem,2017,118(11):3765-3774.
[29] Yang Z,Wang R,Zhang T,etal.MicroRNA-126 regulates migration and invasion of gastric cancer by targeting CADM1[J].Int J Clin Exp Pathol,2015,8(8):8869-8880.
[30] Yu X,Li Z.MicroRNAs regulate vascular smooth muscle cell functions in atherosclerosis(review)[J].Int J Mol Med,2014,34(4):923-933.
[31] Li K,Wang Y,Zhang A,etal.miR-379 inhibits cell proliferation,invasion,and migration of vascular smooth muscle cells by targeting insulin-like factor-1[J].Yonsei Med J,2017,58(1):234-240.
[32] Li Y,Huang J,Jiang Z,etal.MicroRNA-145 regulates platelet-derived growth factor-induced human aortic vascular smooth muscle cell proliferation and migration by targeting CD40[J].Am J Transl Res,2016,8(4):1813-1825.
[33] Li X,Cao G.Potential role of microRNA-181b on atherosclerosis[J].Zhonghua Xin Xue Guan Bing Za Zhi,2015,43(6):516-520.
[34] Cho JR,Lee CY,Lee J,etal.MicroRNA-761 inhibits Angiotensin II-induced vascular smooth muscle cell proliferation and migration by targeting mammalian target of rapamycin[J].Clin Hemorheol Microcirc,2015,63(1):45-56.
[35] Huang F,Fang ZF,Hu XQ,etal.Overexpression of miR-126 promotes the differentiation of mesenchymal stem cells toward endothelial cells via activation of PI3K/Akt and MAPK/ERK pathways and release of paracrine factors[J].Biol Chem,2013,394(9):1223-1233.
[36] Zuo K,Zhi K,Zhang X,etal.A dysregulated microRNA-26a/EphA2 axis impairs endothelial progenitor cell function via the p38 MAPK/VEGF pathway[J].Cell Physiol Biochem,2015,35(2):477-488.
[37] Zhang CF,Kang K,Li XM,etal.MicroRNA-136 promotes vascular muscle cell proliferation through the ERK1/2 pathway by targeting PPP2R2A in atherosclerosis[J].Curr Vasc Pharmacol,2015,13(3):405-412.
[38] Li TJ,Chen YL,Gua CJ,etal.MicroRNA 181b promotes vascular smooth muscle cells proliferation through activation of PI3K and MAPK pathways[J].Int J Clin Exp Pathol,2015,8(9):10375-10384.