胍丁胺通过细胞因子介导多器官功能衰竭小鼠保护作用的研究①
2018-03-07唐仕华郭莉佳冯子芳
唐仕华 何 玲 郭莉佳 韦 斌 冯子芳
(兴义市人民医院,兴义 562400)
胍丁胺(Agmatine,AGM)是一种广泛存在于哺乳动物体内的生物活性胺,是 L-精氨酸-NO 代谢途径、多胺代谢及多种神经信号的重要调控者。胍丁胺通过与多种受体结合,参与降压、镇痛、抗炎、神经保护、学习记忆和生长发育等代谢过程[1,2]。目前在小鼠体内胍丁胺对酵母多糖诱导的多器官功能障碍的影响研究尚少。
多器官功能障碍综合征(Multiple organ dysfunction syndrome,MODS),是指患者同时或相继并发两个或两个以上系统和(或)器官的衰竭或急性功能障碍,常常发生于急性疾病过程中,也是脓毒症晚期患者的重要死亡原因。尽管近20年来已有数十种拮抗致炎因子的药物进入临床试验性治疗阶段,但副作用大,且疗效不如动物体内理想,表明上述抗炎措施的安全性或有效性还存在偏差[3-5]。本实验拟通过建立酵母多糖(Zymosan,ZYM)诱导小鼠MODS模型,旨在体内探讨胍丁胺对ZYM诱导MODS小鼠的作用和炎症因子的表达变化,为胍丁胺对MODS的治疗提供理论依据。
1 材料与方法
1.1MODS动物模型及分组 6~8周龄,体重20~25 g健康雄性KM小鼠165只,购自重庆医科大学实验动物中心。小鼠进食标准的饲料和饮水,保持正常的12 h昼夜循环。实验过程中对动物的处置符合动物伦理学标准。小鼠随机分为对照组和实验组,实验组又分为酵母多糖致伤6 h、12 h、24 h、2 d、5~7 d五个亚组,每组16只。酵母多糖诱导MODS模型的制作参照朱庆磊等[6]的方法。将1 g酵母多糖粉剂(Sigma,美国)与40 ml医用石蜡油混合配成25 g/L酵母多糖混悬液,100℃水浴消毒,冷却至室温,小鼠腹部消毒,腹腔注射酵母多糖悬液(500 mg/kg)。常规喂养,观察死亡率。
1.2方法
1.2.1脏器功能检测 摘眼球方法采集小鼠血清,肝素抗凝,静置10 min后3 000 r/min离心10 min取血浆,在全自动生化自动分析仪(奥林巴斯AU5800)上采用酶速率法检测血浆丙氨酸转氨酶(ALT)、天门冬氨酸氨基转移酶(AST)、肌酐(Cr)、肌酸激酶(CK)、淀粉酶(AMY)的活性或浓度。
1.2.2肺病理组织学检查 ①将新鲜取出的肺放入4%的多聚甲醛固定24 h,再放入0.5%的多聚甲醛中保存。②将组织块包埋在石蜡中,并以5 μm厚度切片。③将切片脱蜡和水化(二甲苯Ⅰ10 min;二甲苯Ⅱ10 min;无水乙醇Ⅰ1~3 min;95%乙醇Ⅰ5 min;80%乙醇5 min;75%乙醇5 min;蒸馏水1 min)。④将切片用苏木精液染色:10 min,流水冲洗去苏木精液1 min后1%盐酸-乙醇:1~3 s(显微镜下观察效果);再用水洗:1~2 s。⑤用1%氨水返蓝:10 s后流水冲洗2 min,再用蒸馏水洗 2 min。⑥ 0.5%伊红液染色1 min,蒸馏水稍洗1~2 s。⑦脱水:75%乙醇2 s;80%乙醇Ⅰ3 min;95%乙醇Ⅱ3 min;无水乙醇Ⅰ5 min;二甲苯Ⅰ 5 min;二甲苯Ⅱ5 min。⑧中性树胶封固。观察充血、水肿、炎症和出血等组织学改变。
1.2.3血清细胞因子水平检测 采用ELISA方法测定血清TNF-α、IL-1β、IL-6和IL-10的浓度,具体操作步骤按照北京四正柏生物技术公司试剂盒的说明书进行。
1.2.4qPCR检测腹水TNF-α、IL-1β、IL-6和IL-10的表达 用注射器抽取小鼠腹水10 ml,3 000 r/min离心10 min后,弃上清,将沉淀物按照试剂说明书用TRizol法提取总RNA。提出的RNA溶于DEPC水,依照逆转录试剂盒(大连TaKaRa生物)说明将RNA反转录成cDNA。用实时PCR试剂盒(美国Bio-Rad生物)在实时PCR仪上对cDNA扩增并行实时定量分析。特异性引物使用Primer 4.0合成,引物设计序列见表1。
1.2.5NO浓度测定 腹腔注射24 h后各组眼球取全血,肝素抗凝,静置10 min后3 000 r/min离心10 min取血浆,按照碧云天总NO检测试剂盒操作,通过经典的Griess reagent检测亚硝酸盐从而测定出总NO。

2 结果
2.1MODS病程中不同阶段小鼠的症状、体征及生存率 ZYM组小鼠3 h后出现精神不振、活动与进食减少,6 h后症状加重,表现为拒绝饮食、精神萎靡、腹泻、全身发抖、不睁眼且眼分泌物增多;AGM治疗组小鼠的一般状态也较差,但要明显好于ZYM组。ZYM注射12 h后,小鼠陆续出现死亡情况,在观察期的第7天,大约有79.5%的小鼠发生死亡,而AGM+ZYM组也在12 h后陆续出现死亡情况,至观察期的第7天,小鼠的死亡率62.3%。如图1生存曲线可以看出,AGM+ZYM组小鼠的死亡率明显低于ZYM组,两者差异具有统计学意义(P<0.05)。
表1各引物序列与片段大小
Tab.1Primersequenceandfragmentsize

Gene5′→3′Fragment(bp)TNF⁃αFP:CGTCGTAGCAAACCACCAAG150RP:TTGAAGAGAACCTGGGAGTAGCAIL⁃1βFP:CCTCGTGCTGTCGGACCCATA344RP:CAGGCTTGTGCTCTGCTTGTGAIL⁃6FP:ACCACGGCCTTCCCTACTTC134RP:CTCATTTCCACGATTTCCCAGIL⁃10FP:CAACATACTGCTAACCGACTCCT173RP:TGAGGGTCTTCAGCTTCTCACβ⁃actinFP:GAGACCTCAACACCCCAGC256RP:ATGTCACGCACGATTTCCC
2.2MODS小鼠模型肺组织HE染色病理切片结果 肺组织损伤以肺泡增厚,嗜中性粒细胞浸润及肺泡出血为特征。如图2所示,对照组或AGM 单独给予组中的小鼠没有显著的形态学损害,表明腹膜内注射盐水不诱导炎症反应,AGM对肺组织无毒性反应。然而,在ZYM诱导的小鼠模型中明显有中性粒细胞浸润到肺间质,肺泡壁增厚,肺毛细血管扩张、出血、红细胞大量渗出等现象。胍丁胺处理降低了炎症细胞浸润,改善了在ZYM诱导的大鼠肺结构的破坏。充血、水肿、炎症和出血的情况表明,ZYM诱导的小鼠出现了明显的急性肺损伤,但胍丁胺处理后均有改善。
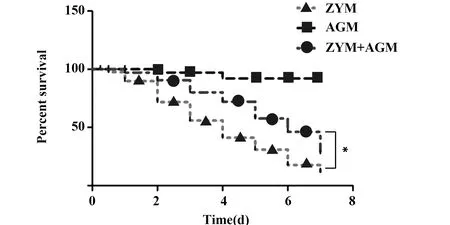
图1 AGM治疗对MODS小鼠生存情况的影响Fig.1 Effect of AGM treatment on survival of MODS miceNote: Compared with the ZYM group,*.P<0.05.
2.3酵母多糖致伤对小鼠脏器功能的影响 如表2所示,ZYM组和AGM+ZYM组的小鼠血浆中ALT、AST、Cr、CK和Amy水平与正常对照组相比均明显升高(P<0.05);AGM+ZYM组血浆中ALT、AST、Cr、CK和Amy水平与单独ZYM组相比,均有不同程度的下降,其中ALT、AST、Cr和Amy水平有明显的降低,其差异具有统计学意义(P<0.05)。
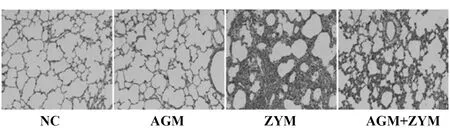
图2 AGM对肺组织病理改变的影响(HE染色)Fig.2 Effects of AGM on histological change of lung(HE staining)
表2AGM对ZYM诱导的MODS小鼠24h后血清ALT、AST、Cr、CK、Amy水平的影响
Tab.2EffectsofAGMonserumlevelsofALT,AST,Cr,CKandAmyinZYMinducedMODSmiceafter24h

GroupsALT(U/L)AST(U/L)Cr(mmol/L)CK(U/L)Amy(U/L)Control37 3±4 976 8±9 1101 2±22 1361±51 2126 3±36 5AGM52 3±7 558 9±9 897 3±25 1298 5±46 3108 3±31 9ZYM98 6±11 21)207 3±27 4236 2±35 11)986±162 81)462 1±84 21)AGM+ZYM58 6±5 81)2)199 1±19 21)156 7±28 21)2)786±97 51)259 5±95 11)2)
Note:Compared with control group,1)P<0.05;compared with ZYM group,2)P<0.05.

图3 ELISA检测各组小鼠血细胞因子TNF-α、IL-1β、IL-6和IL-10的水平Fig.3 Levels of cytokines TNF-α,IL-1β,IL-6 and IL-10 in each group of mice were detected by ELISANote: Compared with control group,*.P<0.05;compared with ZYM group;#.P<0.05.
2.4小鼠血清细胞因子含量的变化 如图3所示,与正常对照组相比,ZYM组和AGM+ZYM组小鼠血清中的TNF-α、IL-1β、IL-6、IL-10含量均明显升高(P<0.05);AGM+ZYM组血清中的TNF-α、IL-1β、IL-6含量较ZYM组明显减少(P<0.05),而血清中IL-10的水平无明显下降(P>0.05)。
2.5小鼠腹腔渗出液中TNF-α、IL-1β、IL-6、IL-10等基因水平的影响 如图4所示,对比正常对照组,ZYM组和 AGM+ZYM 组小鼠腹腔渗出液中,TNF-α、IL-1β、IL-6、IL-10 的含量均明显升高(P<0.05);AGM+ZYM 组的TNF-α、IL-1β、IL-6含量却相较ZYM组有明显的降低(P<0.05),IL-10的下降水平却不明显。
2.6AGM对小鼠血清内NO的影响 如图5所示,AGM组与对照组小鼠血清NO的产生无明显差异;与对照组相比,无论是单独ZYM组,还是AGM+ZYM组,其NO产生明显增加;而在AGM+ZYM组与单独ZYM组相比,小鼠血清内NO表达量明显降低(P<0.05),说明AGM可抑制ZYM诱导的NO产生。
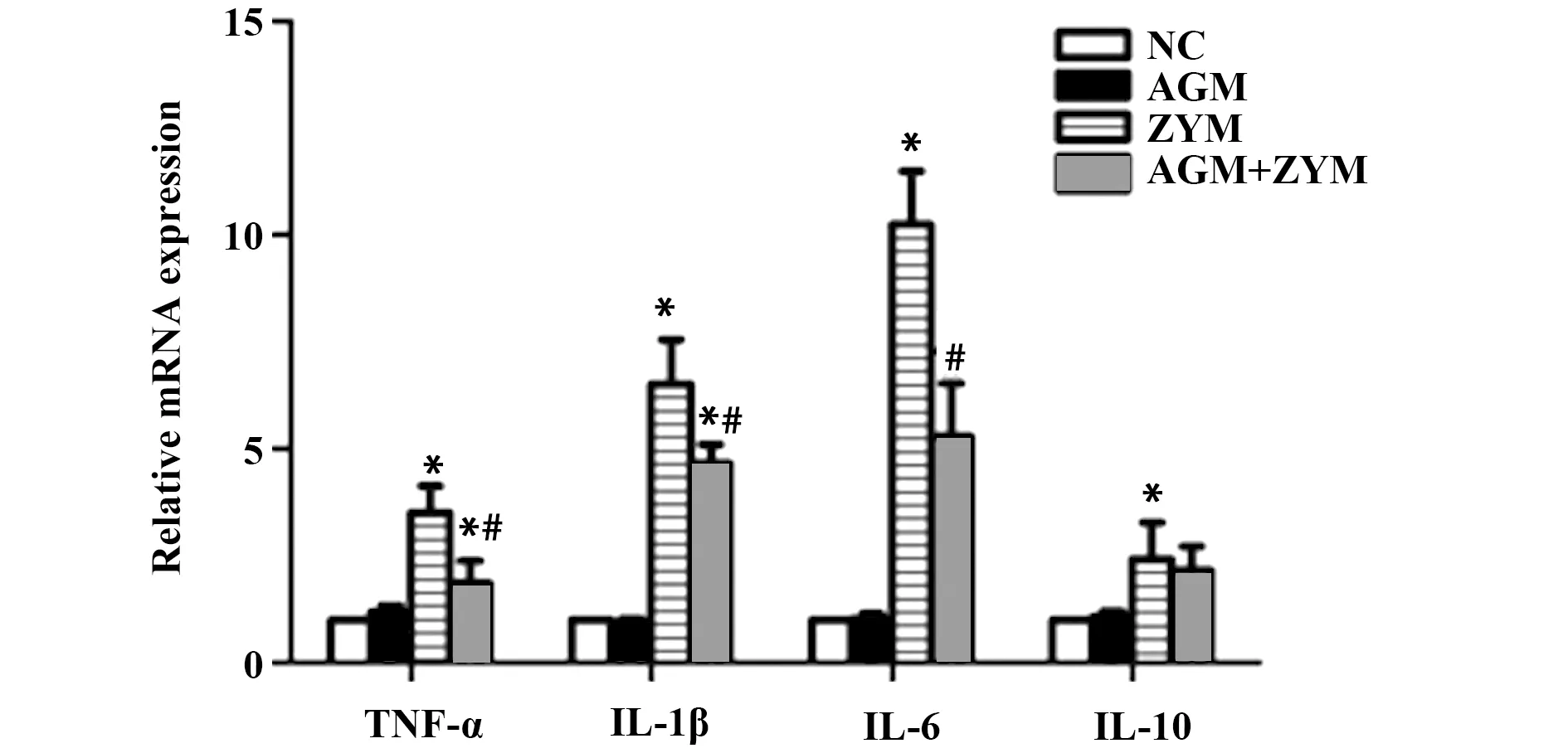
图4 qPCR检测腹水TNF-α、IL-1β、IL-6和IL-10的表达Fig.4 qPCR was used to detect expression of TNF-α,IL-1β,IL-6 and IL-10 in ascitesNote: Compared with control group,*.P<0.05;compared with ZYM group,#.P<0.05.

图5 Griess法测定AGM作用24 h后NO的变化Fig.5 Change of NO after AGM effect 24 h were measured by Griess methodNote: Compared with control group,*.P<0.05;compared with ZYM group,#.P<0.05.
3 讨论
MODS即多器官功能障碍综合征,又被称为多系统器官功能衰竭或多器官衰竭,其以局部和全身性的产生和释放各种介质为特点,目前普遍认同“细胞因子瀑布效应”学说,即过度炎症导致 MODS的发生,但具体机制尚不清楚[7]。相关动物实验及临床观察发现,MODS病程发展经由早期过度炎症反应状态渐变发展为后期显著的免疫抑制[8,9]。因此,在患者病情尚未进入免疫抑制阶段对其进行干预,将有助于大幅降低MODS的病死率。
酵母多糖(ZYM)是目前应用较广泛的建立MODS的模型药物,其机制是能够导致无菌性腹膜炎,引起炎症反应的迁延性失控及过度的激活补体系统,驱动炎性细胞因子参与免疫应答[10]。本研究采用小鼠腹腔注射酵母多糖混悬液建立小鼠MODS模型,其发病特征与MODS的临床病患的病程进展极为相似[11,12]。本研究结果显示,小鼠在注射酵母多糖后,小鼠活动减少,进食减弱甚至不进食,精神萎靡,在不同时间段均出现了死亡,而胍丁胺治疗组,小鼠的各项症状均有明显改善,死亡率有明显的降低。一些研究认为,ZYM是单核细胞和巨噬细胞的强大激活剂,巨噬细胞是其主要作用的靶细胞,其与之接触后能够分泌大量炎症介质(TNF-α、IL-1β、IL-6、IL-10等),由此引发机体过度炎症反应[10,13-15]。本研究结果显示小鼠给予酵母多糖后,小鼠体内TNF-α、IL-1β、IL-6、IL-10基因和细胞因子均明显升高,这提示酵母多糖诱导的急性期小鼠器官功能损害部分原因可能是由于上调了促炎基因表达所致,而在AGM治疗组,TNF-α、IL-1β、IL-6却有明显下降,这些炎症因子的下降与AGM调节了促炎症基因的活化和表达有关。另外,本研究观察到给予酵母多糖后,通过检测到的器官生化标志物的改变,表明酵母多糖与器官代谢障碍有关。而AGM治疗后病情好转,说明AGM在全身炎症反应病程中具有器官保护效应。
IL-10是一种有效的抗炎症因子,与抗原提呈细胞(巨噬细胞、树突状细胞)相互作用,从而减少中性粒细胞的聚集,也可以通过NF-κB信号通路,抑制促炎症因子的产生(如TNF-α、IL-6等),其在缓解器官损伤中扮演着极其重要的作用[16-19]。实验表明,ZYM刺激小鼠后,IL-10的含量显著上调,而AGM组,IL-10的下降却不显著。ZYM刺激小鼠后IL-10的升高是因为机体内的抗炎系统发挥效应,而AGM治疗后,IL-10的水平未出现明显下降,这可能是AGM调节了IL-10的表达,抑制了促炎症因子的产生,这也阐明了IL-10未出现明显下降,而TNF-α、IL-1β、IL-6明显下降的原因。因此,IL-10可能是AGM发挥抗炎作用的一个途径,但其具体作用和机制还需后续试验进行验证。
本次研究证实了AGM在体内能够显著抑制促炎症因子的释放,在体内能够有效缓解ZYM诱导的实验性小鼠脓毒症的严重程度,并且能够减轻急性腹膜炎及肝、肾、胰腺器官的损伤,另外,AGM大大抑制促炎症因子的产生,维持抗炎因子水平等。AGM抑制炎症过程可能是通过抑制NF-κB活化从而抑制局部及全身TNF-α、IL-6、NO的产生并且降低嗜中性粒细胞浸润来实现的,AGM抑制NF-κB活化的分子机制还不明确,需要进一步实验来证实。这些结果表明AGM可以被认为是一种内源性抗炎分子,可能为炎症性疾病提供了一个新的、有效的治疗策略。
[1] Neis VB,Rosa PB,Olescowicz G.Therapeutic potential of agmatine for CNS disorders[J].Neurochem Int,2017,3(5):6-13.
[2] Popolo A,Adesso S,Pinto A,etal.L-Arginine and its metabolites in kidney and cardiovascular disease[J].Amino Acids,2014,46(10):2271-2286.
[3] Sun X,Jones ZB,Chen XM,etal.Multiple organ dysfunction and systemic inflammation after spinal cord injury:a complex relationship[J].J Neuroinflammation,2016,13(1):260.
[4] Hattori Y,Hattori K,Suzuki T.Recent advances in the pathophysiology and molecular basis of sepsis-associated organ dysfunction:Novel therapeutic implications and challenges[J].Pharmacol Therapeutics,2017,4(3):168-175.
[5] Boyd JH,Fjell CD,Russell JA,etal.Increased plasma PCSK9 levels are associated with reduced endotoxin clearance and the development of acute organ failures during sepsis[J].J Innate Immunity,2016,8(2):211-220.
[6] 朱庆磊,钱小顺,杨 洁,等.酵母多糖致老年大鼠多器官功能不全模型细胞因子的变化[J].中国老年学杂志,2007,37(7):618-619.
Zhu QL,Qian XS,Yang J,etal.Changes of cytokines in zymosan induced rat model multiple organ dysfunction model in the elderly[J].Chin J Gerontol,2007,37(7):618-619.
[7] Sauaia A,Moore FA.Postinjury inflammation and organ dysfunction[J].Critical Care Clin,2017,33(1):167-191.
[8] Rosenthal MD.Persistent inflammation,immunosuppression,and catabolism:evolution of multiple organ dysfunction[J].Surgical infections,2016,17(2):167-172.
[9] Rosenthal M,Gabrielli A.The evolution of nutritional support in long term ICU patients:from multisystem organ failure to persistent inflammation immunosuppression catabolism syndrome[J].Minerva Anestesiologica,2016,82(1):84-96.
[10] Volman TJ,Hendriks T.Zymosan-induced generalized inflamma-tion:experimental studies intomechanisms leading to multiple organ dysfunction syndrome[J].Shock(Augusta,Ga.),2005,23(4):291-297.
[11] 李希颖,李景辉.酵母多糖引发MODS机制及其干预的实验研究进展[J].海南医学,2015,3(23):3514-3516.
Li XY,Li JH.Advances in the experimental study of MODS mechanism and intervention by Saccharomyces cerevisiae[J].Hainan Medical J,2015,3(23):3514-3516.
[12] 郑金光,白晓东,胡 森.酵母多糖诱导全身炎症反应及多器官功能障碍综合征模型的研究进展[J].感染、炎症、修复,2015,6(2):122-124.
Zheng JG,Bai XD,Hu S.Advances in yeast polysaccharide induced systemic inflammatory response and multiple organ dysfunction syndrome model[J].Infection Inflammation Repair,2015,6(2):122-124.
[13] 张 莉,王晓春,杨根妹,等.酵母多糖致老年SIRS大鼠模型多器官功能及炎症因子变化的研究[J].上海预防医学,2016,(02):104-108.
Zhang L,Wang XC,Yang GM,etal.Study on the changes of multiple organ function and inflammatory factors in old SIRS rat model induced by yeast polysaccharide[J].Preventive Med Shanghai,2016,9(2):104-108.
[14] Miyasato M,Taguchi K,Tsuda S,etal.Eosinophil chemilu-minescence response to cytokines and opsonized zymosans in atopic dermatitis[J].International Archives Allergy Immunol,1994,104(Suppl 1):24-26.
[15] 马淑芹,刘印华,葛淑芝,等.酵母多糖对免疫功能的影响[J].河北医药,2013,11(15):2245-2246.
Ma SQ,Liu YH,Ge SZ,etal.Effects of Saccharomyces cerevisiae on immune function [J]. Hebei Med,2013,11(15):2245-2246.
[16] Li JJ.Effects of 4 weeks of atorvastatin ad ministration on the antiinflammatory cytokine interleukin-10 in patients with unstable angina[J].Clin Chem,2005,51(9):1735-1738.
[17] 张英杰,禹 丽,郝晓娜,等.间充质干细胞与白细胞介素10对四氯化碳诱发的肝纤维化大鼠的治疗作用[J].中国免疫学杂志,2016,32(1):23-28.
Zhang YJ,Yu L,Hao XN,etal.Treatment of experimental hepatic fibrosis in rats by transplanting with mesenchymal stem cells deri[J].Chin J Immunol,2016,32(1):23-28.
[18] Salim PH,Jobim M,Bredemeier M,etal.Interleukin-10 gene promoter and NFKB1 promoterinsertion/deletion polymorphisms in systemic sclerosis[J].Scandinavian J Immunol,2013,77(2):162-168.
[19] 屈玉兰,邓捷文,邓常文,等.白细胞介素10通过抑制自噬调节树突状细胞功能[J].中国免疫学杂志,2017,33(3):333-337.
Qu YL,Deng JW,Deng CW,etal.Interleukin-10 regulates functions of dendritic cell through autophagy inhibition[J].Chin J Immunol,2017,33(3):333-337.