鸭坦布苏病毒感染对BHK-21细胞分泌胞外体的影响①
2018-03-07周晓雅殷冬冬唐井玉刘红梅王桂军
周晓雅 周 祺 殷冬冬 唐井玉 邢 雪 董 靖 刘红梅 王桂军
(安徽农业大学动物科技学院,兽医病理生物学与疫病防控安徽省重点实验室,合肥 230036)
1987年,Johnstone等[1]发现体外培养的成熟绵羊红细胞分泌囊泡,并提出产生胞外体(Exosome)的说法。Johnstone等[1]还指出,在绵羊红细胞的成熟阶段,胞外体通过释放一些不必要的膜蛋白来调节晚期膜运动。几乎所有细胞均可分泌胞外体[2-4]。胞外体天然存在于体液中,包括血液、唾液、尿液和母乳,体内分泌的胞外体可以从血液、尿液和唾液中提取分离。胞外体富含热休克蛋白(HSP70、HSP90)、四次跨膜蛋白家族(CD9、CD63、CD81)、内吞体分选转运复合体等物质[2-4]。胞外体内还富含mRNAs、miRNAs以及其他ncRNAs[5]。胞外体由于其特殊的组成结构,可通过调节特异性的蛋白、核酸、脂质等的分泌,参与机体内多种生理或病理反应。
鸭坦布苏病毒(Duck Tembusu virus,DTMUV)属于黄病毒科黄病毒属,是单股正链RNA病毒。该病毒有囊膜,表面有纤突,主要在感染细胞的胞浆内复制,病毒大小在40~60 nm之间,病毒基因组仅含有一个开放阅读框,共编码3种结构蛋白(C、prM/M和E)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)[6-11]。该病毒主要感染鸭子,发病率高,传染性强。该病在全国多地均有报道,给我国的养鸭业造成了严重的经济损失[12]。同属于黄病毒科的病毒还有丙型肝炎病毒、猪瘟病毒、登革热病毒。近年来的研究表明,感染人类免疫缺陷病毒、丙型肝炎病毒、登革热病毒的细胞分泌的胞外体会携带病毒的RNA和蛋白质,以及宿主细胞的功能蛋白质或者RNA来参与感染和免疫应答[13]。而相对于其他黄病毒科病毒,鸭坦布苏病毒的相关研究甚少,胞外体在病毒感染及免疫机制中扮演什么角色仍是未知。本实验主要探究鸭坦布苏病毒感染细胞后,外泌体在粒径及蛋白组分上的差异,并为进一步了解该病毒感染机制奠定基础。
1 材料与方法
1.1材料
1.1.1细胞株和病毒来源 BHK-21细胞购自中国科学院上海细胞库,由兽医病理生物学与疫病防控安徽省重点实验室保存。鸭坦布苏病毒AH-F10株由本实验室分离并保存。
1.1.2主要试剂和仪器 DMEM培养基购自HyClone公司,胎牛血清(FBS)购自康源生物,0.25%胰蛋白酶和ECL显色液购自Beyotime公司,0.01 mol/L PBS(Phosphate-buffered saline自制),PEG6000购自Biosharp公司,CD9和CD63单抗购自Abcam公司,羊抗鼠HRP抗体购自Solarbio公司,0.22 μm滤器购自Millex公司,透射电镜购自日立公司,高速冷冻离心机购自Thermo公司。
1.2方法
1.2.1细胞培养 将冻存于液氮中的BHK-21细胞复苏后,用含10%FBS的DMEM培养液继续传代培养3代。
1.2.2病毒处理 利用鸭坦布苏病毒感染BHK-21细胞,用含1%胎牛血清的维持液继续培养96 h后,PBS清洗3次,去除细胞上清,细胞经3次反复冻融,3 000×g离心15 min,获得的病毒感染细胞裂解液离心上清置于-80℃保存,用于后期细胞感染,制备病毒感染细胞胞外体。
1.2.3细胞上清制备 待BHK-21细胞生长密度达80%~90%,弃去培养基上清,用PBS洗涤两次,用已预温37℃的不含FBS的DMEM培养基洗涤两次,试验组(A组)加入1.2.2中制备的细胞上清鸭坦布苏病毒液300 μl(75 cm2培养瓶),37℃,5%CO2,孵化箱孵育2 h。对照组(B组)用不含FBS的DMEM培养基孵育2 h后弃液,用预温的DMEM培养基洗涤3次,再加入不含FBS的DMEM培养基继续培养40 h后,收集上清液于EP管中,同时设置一组正常感染组(C组),添加1%FBS的DMEM培养液继续培养40 h。
1.2.4病毒增殖的检测 分别取上述3组培养40 h 的细胞上清按照Trizol 说明书提取上清总RNA,取10 μl RNA,10 mmol/L dNTPs 3 μl,10 μmol/L下游引物1 μl,置70℃水浴5 min,冰浴2 min;加入M-MLV 1 μl,Buffer 5 μl,反应条件为42℃ 50 min,95℃ 5 min,产物置-20℃备用。针对鸭坦布苏病毒NS基因设计一对特异性引物,上游引物:AGA CTG CTG GTG CAA TGA GAC,下游引物:CGT CGT TCC CAG ATT CCA,目的片段长度为260 bp,引物由上海生工生物工程股份有限公司合成。以cDNA为模板,扩增NS基因,PCR反应体系为 25 μl:2×Pfu PCR Master Mix 12.5 μl,上下游引物各1 μl,模板2 μl,ddH2O 8.5 μl。PCR反应条件:94℃预变性 5 min;94℃变性30 s,51℃退火30 s,72℃延伸30 s,35个循环;72℃总延伸10 min。PCR产物经2%琼脂糖凝胶电泳后进行观察。
1.2.5胞外体的提取 收集的细胞上清4℃下3 000×g离心30 min,弃沉淀,去除细胞及细胞碎片;再将上清10 000×g 4℃离心30 min弃沉淀;加入1/5上清体积量的 40%PEG6000,混匀置于4℃ 孵育过夜。4℃下10 000×g离心50 min。弃去上清,底部沉淀用0.01 mol/L PBS重悬,经0.22 μm滤器过滤,再次4℃下10 000×g离心50 min,沉淀用少量PBS重悬,置于-80℃保存。
1.2.6胞外体蛋白含量测定 取2 μl胞外体重悬液进行Biodrop微量蛋白核酸测量仪校正,将2 μl胞外体重悬液加样于测量孔中进行蛋白含量测定,重复3次取平均值。测完一个样本后用PBS洗3次后再测其他样品。
1.2.7胞外体透射电镜观察 将铜网置于滤纸上,吸取10 μl的胞外体悬液在铜网上,室温烘干5 min左右,滴加10 μl 3%的磷钨酸溶液滴于铜网上,室温负染5 min。80KV透射电镜观察。
1.2.8胞外体SDS-PAGE及标记分子Western blot鉴定 分别取试验组(A组)及对照组(B组)的细胞胞外体悬浮液10 μg加5×上样缓冲液,煮沸10 min,冰上放置5 min;经10%的SDS-PAGE胶电泳分离(浓缩胶70 V电泳30 min,分离胶120 V电泳70 min);转移蛋白胶于0.45 μm的PVDF膜上(按PVDF膜面积1.5 mA/cm2电转45 min);5%脱脂奶粉室温封闭1 h,TBST洗涤5 min,一抗稀释液为含5%脱脂奶粉的TBST,一抗为外泌体标志分子抗体anti-CD63(1∶1 000稀释)、anti-CD9(1∶1 000稀释),4℃孵育过夜,TBST洗膜3次,每次10 min,二抗用TBST以1∶5 000稀释,室温摇床孵育1 h,TBST洗膜3次,每次10 min,进行ECL显影。
1.2.9质谱鉴定 两组各取10 μg 胞外体重悬液(去离子水重悬),进行SDS-PAGE电泳。利用考马斯亮蓝染色,脱色,对整条电泳跑道切胶进行质谱分析。每组设3个重复送样至中国科学技术大学生命科学学院公共平台进行质谱鉴定。
1.3统计学方法 胞外体粒径大小分析,随机测量50个胞外体的直径,每组取3张不同视野的电镜图片进行重复测距。利用GraphPad Prism6软件对统计数据进行t检验分析。
2 结果
2.1BHK-21细胞培养状态及病毒RT-PCR检测 试验组(A组)、对照组(B组)及正常感染组(C组)细胞培养40 h后细胞生长良好,细胞活性较好,细胞排列紧密,胞核清晰胞浆均匀,没有明显分化现象。从3组细胞上清中均未检测到鸭坦布苏病毒核酸。
2.2蛋白含量测定结果 利用8%PEG6000提取细胞上清胞外体,经微量蛋白核酸测量仪测定,感染病毒组(A组、C组)胞外体蛋白含量为528.2 μg/ml,对照组(B组)胞外体蛋白含量为474.8 μg/ml,见图1。
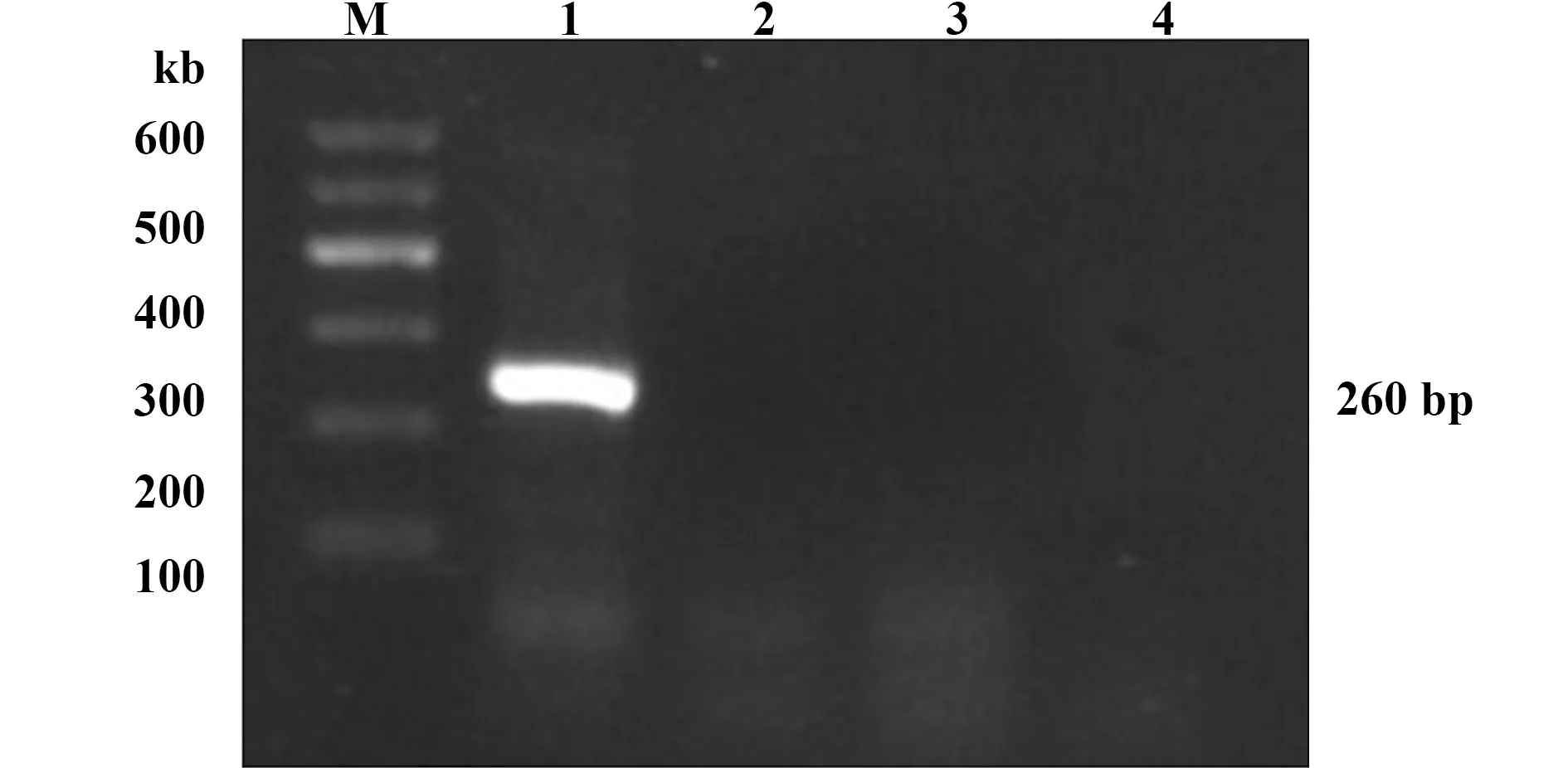
图1 BHK-21细胞培养上清病毒NS基因的RT-PCR检测Fig.1 RT-PCR was used to detect expression of NS in cell supernatantNote: M.Marker;1.Positive control;2.Infected group;3.Normal group;4.Uninfected control group.
2.3电镜观察 将上述制备的细胞上清胞外体,通过电镜观察,电镜背景清晰,且未发现病毒颗粒,直径在30~160 nm,与文献报道相一致,见图2。
2.4胞外体直径比较 通过电镜观察,利用Photoshop软件测距功能测定胞外体的直径大小。统计结果:试验组胞外体直径大小为(71.74±28.33)nm;对照组胞外体直径大小为(58.97±17.34)nm。两组数据进行T检验,P=0.026 9<0.05,两组胞外体直径大小差异具有显著统计学意义。

图2 感染组(A)和对照组(B)胞外体电镜图Fig.2 TEM of exosome from infected group (A) and unfected group (B)
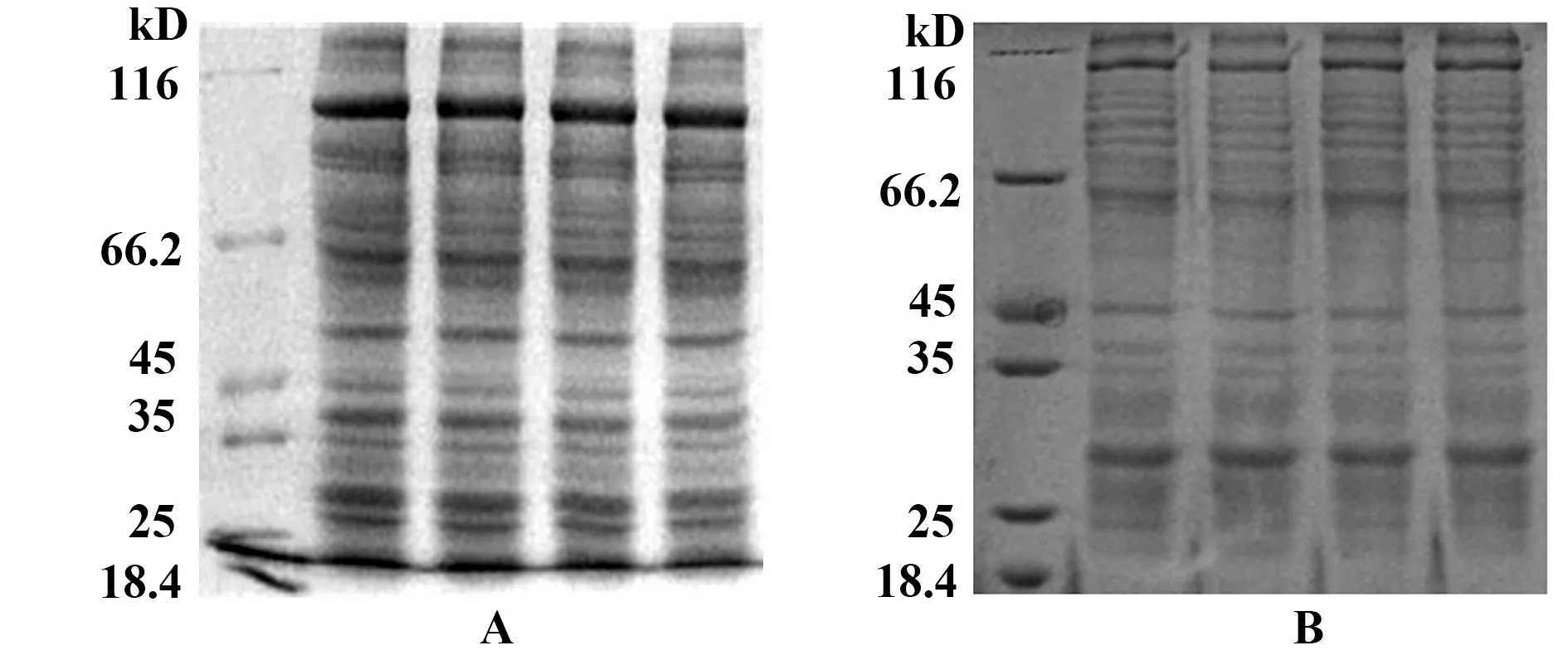
图3 试验组(A)和对照组(B)SDS-PAGE重复电泳图Fig.3 SDS-PAGE of infected group(A) and uninfected group(B)

图4 对照组(A)和感染组(B)上清胞外体CD63和CD9标志分子鉴定Fig.4 Identification of exosome CD63 and CD9 molecular by Western blot from infected group(A) and uninfected group(B)
2.5胞外体的SDS-PAGE及标志分子鉴定 将试验组细胞胞外体及对照组细胞胞外体进行SDS-PAGE电泳,病毒感染的试验组和未感染对照组蛋白条带分布有明显差异(图3)。应用胞外体标志分子(CD63、CD9)对胞外体进行Western blot鉴定,结果显示,试验组和对照组胞外体均检测到CD63和CD9标志分子(图4)。
表1胞外体质谱鉴定蛋白数统计表
Tab.1Quantitystatisticsofexosomebymassspectrometry

GroupsTotalnumberofproteinCommonproteinDifferentproteinExoCartaTreatment84275779Control49272240
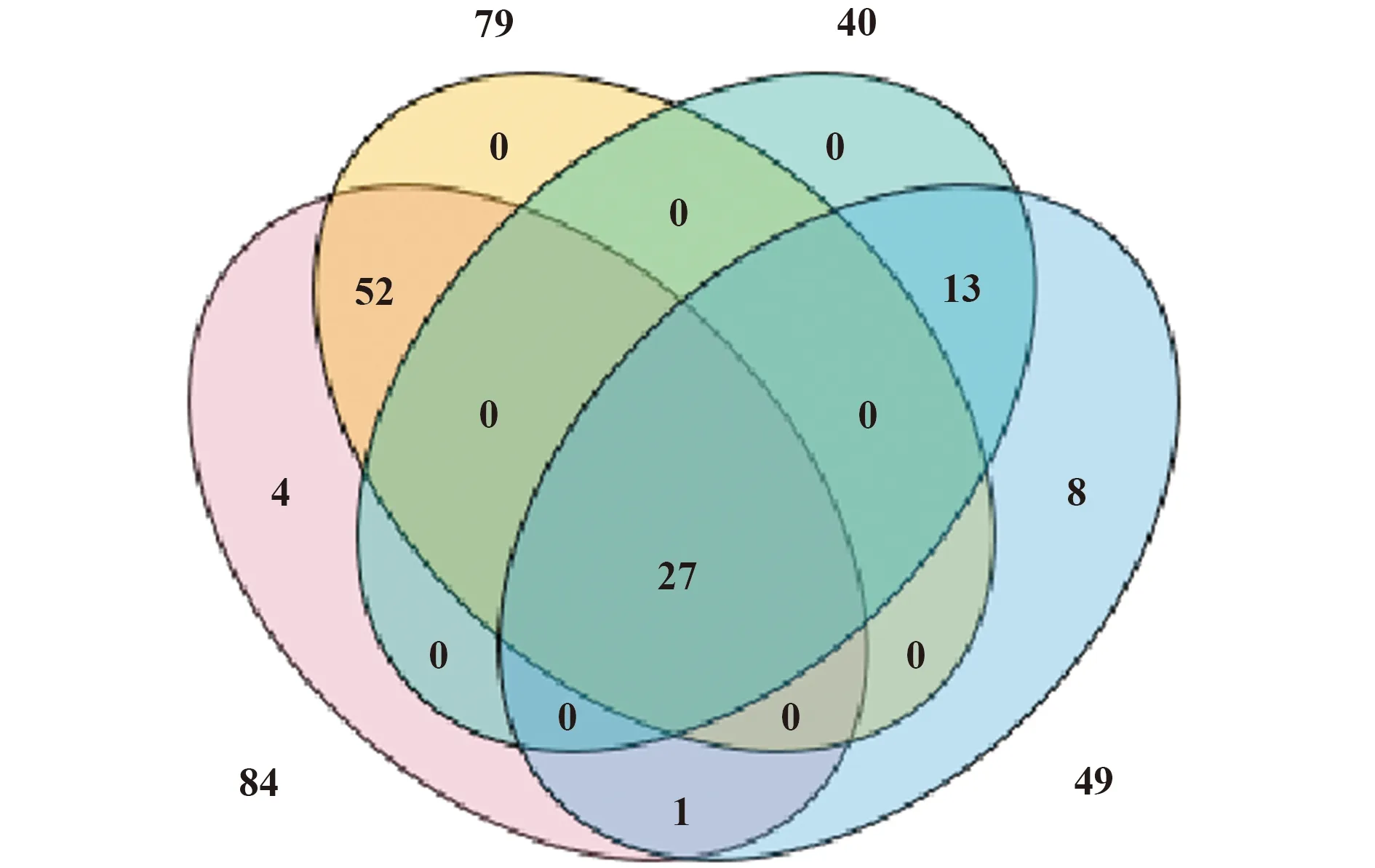
图5 试验组及对照组胞外体蛋白种类同ExoCarta数据库的比较韦恩图Fig.5 Venn diagram of type treatment group and control group exosome protein type comparison with ExoCarta database
2.7胞外体液相质谱分析 应用液相质谱对胞外体蛋白质分子鉴定和种类统计,肽段序列经MASCOT数据库检索,获得蛋白鉴定信息。蛋白被成功鉴定标准为一、二两级质谱综合得分均大于60且可信度大于95%。结果鉴定出试验组及对照组共106种蛋白,试验组检测出84种蛋白,对照组49种蛋白(表1)。利用TBtools对质谱结果同数据库比对的结果,制作韦恩图,其中相同蛋白27种,试验组专有蛋白57种,对照组专有蛋白22种(图5)。经ExoCarta蛋白数据库比对,其中有92种蛋白质在ExoCarta数据库中可检索出,13种蛋白质该数据库中没有记录(表2)。
3 讨论
3.1胞外体的提取 提取胞外体的常用方法是梯度离心,离心力需高达100 000×g,提取繁琐[12,13]。ExoQuickTM(SBI)和Total Exosome Isolation(Life Technologies)试剂是现如今提取胞外体使用度较高的两种试剂,这两种试剂只需要低速离心,步骤简单,但价格昂贵。
表2胞外体蛋白质谱分析结果
Tab.2Massspectrometryassayofexosomes

ProteinGeneNumberofsignificantsequencesExoCartaNoteFibronectin⁃MusmusculusFn125√CommonproteinComplementC3⁃RattusnorvegicusC314√CommonproteinTypeⅠcytoskeletal19⁃RattusnorvegicusKrt191√CommonproteinTypeⅡcytoskeletal5⁃MusmusculusKrt51√CommonproteinTypeⅡcytoskeletal2⁃MusmusculusKrt21√CommonproteinOlfactomedin⁃likeprotein3⁃MusmusculusOlfml36√OnlythetreatmentMajorvaultprotein⁃MusmusculusMvp5√OnlythetreatmentHeatshock⁃related70kDprotein2⁃MusmusculusHspa22√OnlythetreatmentExtracellularmatrixprotein1⁃MusmusculusEcm11√OnlythetreatmentHeatshockproteinHSP90⁃alpha⁃Musmusculushsp90aa11√OnlythetreatmentFibulin⁃1⁃MusmusculusFbln12√OnlythecontrolKeratin,typeⅡcytoskeletal4⁃MusmusculusKrt41√OnlythecontrolGelsolin⁃MusmusculusGsn2√OnlythecontrolComplementfactorB⁃RattusnorvegicusCfv1√OnlythecontrolAlpha⁃2⁃macroglobulin⁃RattusnorvegicusA2m1√Onlythecontrol
利用PEG富集沉淀病毒的历史已经超过50年。由于胞外体与病毒存在相似的生物学特性[14]。借鉴Mahy和Kangro利用PEG富集病毒的方法,提取胞外体[15]。上述实验结果进一步证实,使用PEG提取胞外体,可达到富集及进一步纯化的目的。由于鸭坦布苏病毒粒子呈球形, 直径 45~60 nm[6,7],与胞外体粒径大小相似, 因此上清中不能有病毒干扰,故通过RT-PCR检测DTMUV是否释放,最终确定无血清培养时间为40 h。采用病毒的细胞裂解液作为胞外体后续试验的病毒来源,一方面避免了病毒尿囊液中胞外体的影响,也避免了细胞感染病毒过程中自我分泌于胞外上清中的胞外体的影响。
3.2病毒感染与细胞胞外体 近年来,关于病毒感染细胞产生胞外体的研究逐渐增多,很多研究表明,感染病毒的细胞分泌的胞外体会携带病毒的蛋白或者RNA并参与病毒的感染过程[13]。人类免疫缺陷病毒(Human immunodeficiency virus,HIV)造成患者持续性感染的可能原因是由于从患者血清中分离的胞外体含有HIV中反式激活元件(Transactivating response,TAR)的RNA[16]。鸭坦布苏病毒如何侵入细胞,进入细胞后发生的一系列的生物合成过程及病毒粒子的释放机理尚不清楚。由于胞外体形成的过程复杂,其成分亦复杂,且不同细胞分泌的胞外体所携带物质也会不同[2,3]。本研究提取感染组的细胞上清胞外体,未检测出病毒核酸和病毒蛋白,由于体外实验中采用的细胞为非鸭源细胞,鸭坦布苏病毒感染宿主细胞是否影响胞外体的分泌有待进一步探究。
3.3胞外体质谱结果的分析 本研究应用质谱法检测出的胞外体蛋白种类同ExoCarta数据库比对,蛋白率吻合高,进一步佐证了用PEG可以有效提取细胞上清中的胞外体。其中试验组与对照组共同拥有的蛋白质有27种,包括大量的骨架蛋白(Krt2、Krt5、Krt19、Krt73等)、补体(C3、C4、C7等)、纤维蛋白,在ExoCarta数据库中可检索到,这些蛋白同样可以在动物生理及病理过程中发挥重要的作用。释放于胞外环境的胞外体主要通过黏附作用于靶细胞,并被细胞内吞传递信号分子。纤连蛋白(Fibronectin,Fn)是一种细胞糖蛋白,存在于胞外环境和细胞表面,具有多种生物活性。有研究发现,骨髓瘤细胞和骨髓瘤患者血清中的胞外体含有纤连蛋白,该蛋白是胞外体作用靶细胞的配体,并调节细胞间的相互作用[17]。有研究利用E.coli将丙型肝炎病毒的非机构蛋白NS3蛋白同Fn的结构域A进行融合并纯化,该融合蛋白免疫小鼠可激活树突状细胞的成熟,同时提高免疫细胞抗原呈递能力,该融合蛋白为丙型肝炎病毒新型疫苗的开发奠定基础[18]。试验组检测出57种不同的蛋白,含硫酸类肝素多糖蛋白(HSPG)、过氧蛋白(Olfml3)、穹窿体主蛋白(Major vault protein,MVP)、白细胞介素(IL)等。目前为止,鸭坦布苏病毒同上述蛋白间的作用关系的研究甚少。HSPG仅存在于细胞的表面和胞外中,作为细胞表面受体或共受体,已有证实丙型肝炎病毒感染细胞时,HSPG对丙型肝炎病毒侵入细胞及病毒增殖均有影响,该病毒感染肝癌细胞通过激活NF-KappaB通路,使SMAD6、SMAD7表达上调,进一步使细胞HSPG的表达量增多,进一步实验证明,HSPG表达上调,可促进HCV侵入细胞,并促进病毒增殖[19]。与HSPG受体相关的配体有白细胞介素、干扰素、整合素等,很多研究表明,黄病毒科中西尼罗病毒、日本脑炎病毒和丙型肝炎病毒都能诱导白细胞介素的释放[20,21]。肝细胞白细胞介素水平的升高是丙型肝炎病毒感染炎症期的主要特征[21]。MVP蛋白是一种新型的病毒诱导宿主因子,并可影响Ⅰ型干扰素的释放,引发细胞的抗病毒反应[22,23]。热休克蛋白 90α(Heat shock protein 90α,HSP90α)和热休克蛋白70(HSP70)是细胞受应激原刺激后诱导产生的应激蛋白,作为一种肿瘤标志物并应用于多种肿瘤病的临床检测[24,25]。HSP70在癌症、传染病等相关领域也是研究热点。结核杆菌的HSP70具有分子佐剂和载体效应,可诱导和增强机体的体液免疫和细胞免疫。将HSP70同流行性乙型脑炎病毒E蛋白进行融合,制备的基因工程疫苗可让小鼠产生更好的中和抗体水平,该基因工程疫苗效果优于弱毒苗[26]。控制及预防传染病的主要方式是疫苗接种,利用病毒某单一蛋白同其他配体或受体蛋白结合为病毒疫苗的研制提供了新的研究方向,在了解病毒致病机制的同时也奠定了新型疫苗研制的基础。
近年来胞外体一直是研究热点,利用蛋白质组学及其他生物信息学方法为细胞胞外体的研究提供了很大的便利。本研究通过提取感染病毒的细胞上清中的胞外体并对其进行质谱鉴定,综合其他黄病毒科病毒的研究基础,为鸭坦布苏病毒感染及致病机理研究奠定了基础。
[1] Johnstone RM,Adam M,Hammond JR,etal.Vesicle formation during reticulocyte maturation.Association of plasma membrane activities with released vesicles (exosomes)[J].J Biol Chem,1987,262:9412-9420.
[2] Gross JC,Chaudhary V,Bartscherer K,etal.Active Wnt proteins are secreted on exosomes[J].Nat Cell Biol,2012,14(10):1036-1045.
[3] Mathivanan S,Ji H,Simpson RJ.Exosomes:extracellular organelles important in intercellular communication[J].J Proteomics,2010,73(10):1907-1920.
[4] Schneider A,Simons M.Exosomes:vesicular carriers for intercellular communication in neurodegenerative disorders[J].Cell Tissue Res,2013,352(1):33-47.
[5] Sato-Kuwabara Y,Melo SA,Soares FA,etal.The fusion of two worlds:non-coding RNAs and extracellular vesicles--diagnostic and therapeutic implications (Review)[J].Int J Oncol,2015,46(1):17-27.
[6] 袁 生,李金平,张浩吉,等.我国发现的一种引起鸭产蛋下降综合征的新型黄病毒[J].中国畜牧兽医,2012,39(9):47-49.
Yuan S,Li JP,Zhang HJ,etal.A new type of flavivirus found that causes duck egg drop syndrome in China[J].Chin J Veterinary Med,2012,39(9):47-49.
[7] 袁 生,李金平,张浩吉,等.新型黄病毒在种鹅中垂直传播的研究[J].南方农业学报,2012,43(1):99-102.
Yuan S,Li JP,Zhang HJ,etal.Vertical transmission of new type flavivirus in egg-laying goose [J].J Southern Agriculture,2012,43(1):99-102.
[8] 赵圆圆,李传峰,王桂军,等.鸭产蛋下降-死亡综合征的临床诊断与病原的初步鉴定[J].扬州大学学报(农业与生命科学版),2011,32(3):11-14.
Zhao YY,Li CF,Wang GJ,etal.Clinical diagnosis and pathogenic identification of egg drop-death syndrome in duck[J].J Yangzhou University(Agriculturalan Life Science Edition),2011,32(3):11-14.
[9] 胡旭东,路 浩,刘培培,等.鸭传染性产蛋减少症(暂定名)的病原分离初报[J].中国兽医杂志,2011,7(3):43-47.
Hu XD,Lu H,Liu PP,etal.The primary study on virus isolation of duck Infectious egg failings[J].Chin J Animal Infectious Diseases,2011,7(3):43-47.
[10] 廖 敏,牟小东,耿 阳,等.鹅源黄病毒的分离和初步鉴定[J].中国动物传染病学报,2011,19(1):22-26.
Liao M,Mu XD,Geng Y,etal.Isolation and Identification of Goose flavivirus[J].China Animal Husbandry & Veterinary Medicine,2011,19(1):22-26.
[11] Cao Z,Zhang C,Liu Y,etal.Tembusu virus in ducks,China[J].Emerg Infect Dis,2011,17(10):1873-1875.
[12] Thery C,Amigorena S,Raposo G,etal.Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J].Curr Protoc Cell Biol,2006,3(22):1-29.
[13] Chahar H,Bao X,Casola A.Exosomes and their role in the life cycle and pathogenesis of RNA viruses[J].Viruses,2015,7(6):3204-3225.
[14] Taylor DD,Shah S.Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes[J].Methods,2015,87:3-10.
[15] Rider MA,Hurwitz SN,Meckes DG.ExtraPEG:a polyethylene glycol-based method for enrichment of extracellular vesicles[J].Scientific Reports,2016,6(1):1-14.
[16] Narayanan A,Iordanskiy S,Das R,etal.Exosomes derived from HIV-1-infected cells contain trans-activation response element RNA[J].J Biol Chem,2013,288(27):20014-20033.
[17] Purushothaman A,Bandari SK,Liu J,etal.Fibronectin on the surface of myeloma cell-derived exosomes mediates exosome-cell interactions[J].J Biol Chem,2016,291(4):1652-1663.
[18] Mansilla C,Gorraiz M,Martinez M,etal.Immunization against hepatitis C virus with a fusion protein containing the extra domain A from fibronectin and the hepatitis C virus NS3 protein[J].J Hepatol,2009,51(3):520-527.
[19] Zhang F,Sodroski C,Cha H,etal.Infection of hepatocytes with HCV increases cell surface levels of heparan sulfate proteoglycans,uptake of cholesterol and lipoprotein,and virus entry by up-regulating SMAD6 and SMAD7[J].Gastroente-rology,2016,152(1):257-270.
[20] Kaushik DK,Gupta M,Kumawat KL,etal.NLRP3 inflamma-some:key mediator of neuroinflammation in murine Japanese encephalitis[J].PLoS One,2012,7(2):1-12.
[21] Negash AA,Ramos HJ,Crochet N,etal.IL-1beta production through the NLRP3 inflammasome by hepatic macrophages links hepatitis C virus infection with liver inflammation and disease[J].PLoS Pathog,2013,9(4):1-14.
[22] Gaudieri S,Rauch A,Pfafferott K,etal.Hepatitis C virus drug resistance and immune-driven adaptations:relevance to new antiviral therapy[J].Hepatology,2009,49(4):1069-1082.
[23] Liu S,Peng N,Xie J,etal.Human hepatitis B virus surface and e antigens inhibit major vault protein signaling in interferon induction pathways[J].J Hepatol,2015,62(5):1015-1023.
[24] 张占东,杨 巍,马 飞,等.休克蛋白27,60和90在胃癌中表达及其临床价值[J].中国免疫学杂志,2016,32(7):1042-1049.
Zhang ZD,Yang W,Ma F,etal.Expression of heat shock protein 27, 60 and 90 in gastric cancer and its clinical value[J].Chin J Immunol,2016,32(7):1042-1049.
[25] 王云龙,李 娜,李玉林,等.热休克蛋白90α荧光免疫层析检测方法的建立[J].中国免疫学杂志,2017,33(5):712-720.
Wang YL,Li N,Li YL,etal.Establishment of quantitative fluroscence immunochromatographic assay detection method for heat shock protein 90α(HSP90α)[J].Chin J Immunol,2017,33(5):712-720.
[26] 葛菲菲,邱亚峰,杨耀武,等.乙脑病毒E-Hsp70与E-肽连接区对小鼠特异性免疫的比较[J].中国病毒学,2005,20(4):357-361.
Ge FF,Qiu YF,Yang YW,etal.Compavison of JEV E-Hsp70 and E-bindingdomain fusion protein on immune responses in mice[J].Virologica Sinca,2005,20(4):357-361.